Pentacen
Pentacen (C22H14) ist ein polycyclischer aromatischer Kohlenwasserstoff, und zwar ein Acen mit fünf linear kondensierten Benzolringen.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
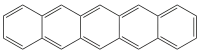 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Pentacen | |||||||||||||||
| Summenformel | C22H14 | |||||||||||||||
| Kurzbeschreibung |
schwarzer Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 278,35 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,35 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1], schwerlöslich in organischen Lösemitteln[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Eigenschaften

_STM.jpg.webp)
In reiner Form bildet Pentacen tiefblaue Kristalle, die allerdings sehr oxidationsempfindlich sind.[3] Mit zunehmender Verunreinigung färbt sich Pentacen violett. Ab 300 °C wird in Gegenwart von Luft eine Zersetzung beobachtet.[3] Ähnlich wie die beiden nächsthöheren Homologen Hexacen und Heptacen ist Pentacen in organischen Lösungsmitteln nur schwer löslich und geht bereitwillig Diels-Alder-Reaktionen ein. Die Verbindung kristallisiert im triklinen Kristallsystem.[2] Die Dampfdruckfunktion ergibt sich nach August entsprechend lg(P) = −A/T+B (P in Torr, T in K) mit A = 18867 und B = 35,823 im Temperaturbereich von 171 °C bis 212 °C.[5] Die Löslichkeiten betragen bei 20 °C in Chloroform 0,21 g·l−1, in Tetrahydrofuran 0,11 g·l−1, in N,N-Dimethylformamid 0,1 g·l−1 und Toluol 0,18 g·l−1.[6]
Anwendung
Anwendung findet Pentacen als Halbleiter in der Organischen Elektronik[7] und wird dort u. a. für organische Dünnschichtfeldeffekttransistoren (OFET) genutzt. Für diese Zwecke wird es entweder thermisch verdampft oder durch Lösungsprozessierung aufgebracht, z. B. durch Rotationsbeschichtung (spin coating). Da Pentacen nahezu unlöslich in allen gebräuchlichen Lösungsmitteln ist, werden hierzu Pentacenderivate verwendet, die erhöhte Löslichkeit aufweisen.[8][9][10] Dabei sind zwei Ansätze bekannt: entweder werden lösliche Diels-Alder-Addukte (Diels-Alder-Reaktion) von Pentacen verarbeitet (nicht halbleitend), die nach Aufbringen thermisch behandelt werden und unter retro-Diels-Alder-Spaltung die für die Funktion als Halbleiter notwendige Pentacen-Struktur wiederherstellen,[7] oder es werden lösliche Pentacenderivate verarbeitet, bei denen die Pentacen-Struktur noch erhalten ist und somit keine nachträgliche thermische Aktivierung notwendig ist.[7][11]
Synthesen

Typische Synthesestrategien für Pentacene verlaufen über Pentacen-6,13-dione oder Pentacen-5,14-dione. Das nebenstehende Schema fasst einige über die 6,13-Dione verlaufende Routen exemplarisch zusammen. Durch die Verwendung geeignet substituierter Ausgangsmaterialien – zur verbesserten Übersichtlichkeit im Schema nicht gezeigt – sind zahlreiche mehrfach und auch unsymmetrisch substituierte Pentacene zugänglich. Die Synthese von Pentacen-6,13-dion wurde bereits 1953 von Ried und Anthöfer beschrieben.[12] Kondensationen von Dialdehyden mit Hydrochinonen nutzten Nuckolls u. a. zum Studium von Selbstorganisationsphänomenen bei der Herstellung von organischen Feldeffekttransistoren.[13] Die zunächst von Cava beschriebenen Umsetzung von Chinodimethanen mit Dienophilen[14] wurde u. a. von Anthony u. a. aufgenommen, um eine Reihe mehrfach substituierter, gut löslicher Pentacenderivate zugänglich zu machen. Löslichkeit wurde dabei durch Addition von Tri-isoproplysilyl-acetylen-Gruppen an das Pentacendion mit nachfolgender Reduktion zum Pentacen mit SnCl2/HCl erreicht.[15]
Einzelnachweise
- Datenblatt Pentacen bei Acros, abgerufen am 19. Dezember 2019.
- Theo Siegrist u. a.: Enhanced Physical Properties in a Pentacene Polymorph. In: Angewandte Chemie International Edition. Band 40, Nr. 9, 3. Mai 2001, S. 1732–1736, doi:10.1002/1521-3773(20010504)40:9<1732::AID-ANIE17320>3.0.CO;2-7.
- Eintrag zu Pentacen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 16. Juli 2011.
- Datenblatt Pentacene, 99% bei Sigma-Aldrich, abgerufen am 1. Dezember 2019 (PDF).
- Vahur Oja, Eric M. Suuberg: Vapor Pressures and Enthalpies of Sublimation of Polycyclic Aromatic Hydrocarbons and Their Derivatives. In: J. Chem. Eng. Data. Band 43, Nr. 3, 1998, S. 486–492, doi:10.1021/je970222l.
- Zhong Huang, Yuansheng Jang, Xiuying Yang, Weiliang Cao, Jingchang Zhang: The synthesis and photoelectric study of 6,13-bis(4-propylphenyl)pentacene, and its TiO2 nano-sized composite films. In: Journal of Physics and Chemistry of Solids. Band 71, Nr. 3, 2010, S. 296–302, doi:10.1016/j.jpcs.2009.12.080.
- Hagen Klauk (Hrsg.): Organic Electronics: Materials, Manufacturing and Applications. Wiley-VCH Verlag, Weinheim 2006, ISBN 3-527-31264-1.
- John E. Anthony: Functionalized Acenes and Heteroacenes for Organic Electronics. In: Chemical Reviews. Band 106, Nr. 12, 2006, S. 5028–5048, doi:10.1021/cr050966z.
- John E. Anthony: The Larger Acenes: Versatile Organic Semiconductors. In: Angewandte Chemie International Edition. Band 47, Nr. 3, 4. Januar 2008, S. 452–483, doi:10.1002/anie.200604045.
- S. Allard, M. Forster, B. Souharce, H. Thiem, U. Scherf: Organic Semiconductors for Solution-Processable Field-Effect Transistors (OFETs). In: Angew. Chem. Int. Ed., 2008, 47, 4070–4098.
- WO 2005/055248 A2: Improvements in and relating to Organic Semiconducting Layers. WIPO-Download (Memento des Originals vom 4. März 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- W. Ried, F. Anthöfer: Einfache Synthese für Pentacen-6,13-chinon. In: Angew. Chem. Band 65, 1953, S. 601.
- Q. Miao, M. Lefenfeld, T.-Q. Nguyen, T. Siegrist, C. Kloc, C. Nuckolls: Self-Assembly and Electronics of Dipolar Linear Acenes. In: Adv. Mater. Band 17, Nr. 4, 2005, S. 407–412, doi:10.1002/adma.200401251 (Details der chemischen Synthese sind in den Supporting Informations beschrieben.).
- M. P. Cava, R. L. Shirley: Condensed Cyclobutane Aromatic Compounds. X. Naphtho[b]cyclobutene. In: J. Am. Chem. Soc. Band 82, Nr. 3, 1960, S. 654–656, doi:10.1021/ja01488a039.
- C. R. Schwarz, S. R. Parkin, J. E. Bullock, J. E. Anthony, A. C. Mayer, G. G. Malliaras: Synthesis and Characterization of Electron-Deficient Pentacenes. In: Organic Letters. Band 7, Nr. 15, 2005, S. 3163–3166, doi:10.1021/ol050872b.
Weblinks
- MacGregor Campbell: Microscopes zoom in on molecules at last. In: New Scientist. 28. August 2009, Abgerufen am 30. August 2009 (AFM-Aufnahme einzelner Pentacenmoleküle).