Azulen
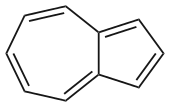
Azulen (von französisch azure ‚blau‘[6]) oder Cyclopentacyclohepten ist ein blauer kristalliner aromatischer Kohlenwasserstoff. Es ist ein Isomer des Naphthalins und hat für einen Kohlenwasserstoff ein auffallend hohes Dipolmoment.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Azulen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C10H8 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 128,17 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
242 °C[4] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Dipolmoment | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
Schon im 15. Jahrhundert konnte man bei der Wasserdampfdestillation der Kamille ein tiefblaues ätherisches Öl gewinnen, das entzündungshemmend wirkt. Erst 1915 wurde von Alfred E. Sherndal durch Säureeinwirkung das Azulen als Träger dieser blauen Farbe isoliert. Die von Sherndal aufgestellte tricyclische (dreifacher Ring) aromatische Strukturformel erwies sich allerdings als falsch. 1926 fand Leopold Ružička die korrekte Summenformel. Erst 1936 konnte von Alexander Pfau und Placidius A. Plattner der Aufbau dieser Verbindung geklärt werden.
Plattner stellte 1941 empirische Regeln zur Vorhersage des Farbtons in Abhängigkeit vom Substitutionsmuster auf. 1955 wurden Azulensysteme durch die von Klaus Hafner und Karl Ziegler entwickelte Ziegler-Hafner-Synthese leichter zugänglich.[7] Trotzdem waren Mitte der 1970er-Jahre erst 60 Verbindungen mit einem Azulensystem bekannt. Mitte der 1990er-Jahre verdoppelte sich durch Synthese von 50 Azulencarbonsäureestern diese Anzahl. Durch NMR-Spektroskopie konnten dabei falsch bestimmte Strukturen korrigiert werden.
Eigenschaften
Physikalische Eigenschaften
Azulen ist in Wasser unlöslich; in organischen Lösemitteln löst es sich mit tiefblauer Farbe. Es ist eines der wenigen bekannten Moleküle, welche nicht der Kasha-Regel gehorchen, d. h. Fluoreszenz aus dem S2-Zustand zeigen.[8] Der Feststoff wirkt reizend.
Chemische Eigenschaften
Kohlenwasserstoffe, die sich formal vom Azulen ableiten, werden Azulene genannt; sie sind blau bis violett gefärbt. Ein Beispiel dafür ist das blaue 6-tert-Butylazulen. Die Farbe ist durch einen Charge-Transfer zwischen den beiden Ringen zu erklären. Azulen ist metastabil. Bei jahrelanger Lagerung isomerisiert es zu Naphthalin.
Synthese
Die Synthese von Azulen gelingt zum Beispiel mittels der Synthese nach Hafner[9] im Eintopf-Verfahren. Sie verläuft über die Edukte 2,4-Dinitrochlorbenzol, Pyridin, Cyclopentadien und Dimethylamin.[10]
Vorkommen

Die bekannteste natürliche Azulenverbindung, „Proazulen C“ (Matricin), kommt in der Kamille vor und geht bei 80 bis 90 °C in Chamazulen (1,4-Dimethyl-7-ethylazulen) über. Bei diesen Azulenen handelt es sich um dehydrierte Sesquiterpenderivate.
Verwendung
Azulenderivate aus natürlichen Quellen werden häufig in Kosmetikprodukten verwendet.
Einzelnachweise
- Eintrag zu AZULENE in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. Februar 2020.
- Datenblatt Azulene, 99% bei AlfaAesar, abgerufen am 21. Juni 2019 (PDF) (JavaScript erforderlich).
- Eintrag zu Azulene. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Februar 2019.
- Datenblatt Azulene bei Sigma-Aldrich, abgerufen am 14. Februar 2019 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Dipole Moments, S. 9-52.
- Siehe Septimus Piesse: On the Colouring Principle of Volatile Oils. In: Chemical News. Nr. 8, 1863, S. 245 (online [abgerufen am 2. März 2015]).
- Karl Ziegler, Klaus Hafner: Eine rationelle Synthese des Azulens. In: Angewandte Chemie. 67, 1955, S. 301–301, doi:10.1002/ange.19550671103.
- Dieter Wöhrle, Michael W. Tausch, Wolf-Dieter Stohrer: Photochemie: Konzepte, Methoden, Experimente - Wöhrle - Wiley Online Library. Wiley-VCH, 1998, ISBN 3-527-29545-3, S. 66.
- K. Hafner, H. Kaiser: 4,6,8-Trimethylazulene In: Organic Syntheses. 44, 1964, S. 94, doi:10.15227/orgsyn.044.0094; Coll. Vol. 5, 1973, S. 1088 (PDF).
- L.F. Tietze, Th. Eicher: Reaktionen und Synthesen. 2. Auflage. Georg Thieme Verlag, Stuttgart 1991, ISBN 3-13-612302-6, S. 304.
