Imidazol
Imidazol ist eine basische organische Verbindung aus der Gruppe der fünfgliedrigen heterocyclischen aromatischen Amine. Die Derivate des Imidazols heißen Imidazole. Mit zwei Stickstoff-Atomen im Ringsystem ist Imidazol der charakteristische Bestandteil in der Seitenkette der basischen Aminosäure Histidin.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
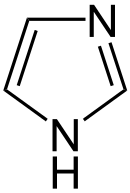 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Imidazol | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C3H4N2 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose, durch Verunreinigung oft hellgelbe Kristalle[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 68,08 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,03 g·cm−3 [2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
257 °C[2] | |||||||||||||||||||||
| pKS-Wert |
6,95 (Imidazolium-Ion, 25 °C)[3] | |||||||||||||||||||||
| Löslichkeit |
gut löslich in Wasser (633 g·l−1 bei 20 °C), Ethanol, Chloroform, Diethylether und Pyridin[2] | |||||||||||||||||||||
| Brechungsindex |
1,4801 (101 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
49,8 kJ/mol[9] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Gewinnung und Darstellung
Heinrich Debus stellte Imidazol 1858 erstmals her durch Reaktion von Glyoxal (Ethandial) mit Ammoniak NH3, daher stammt der veraltete Name Glyoxalin.[10] Mit der Debus-Synthese können aus geeignet substituierten 1,2-Diketonen, Aminen und Aldehyden entsprechend substituierte Imidazole dargestellt werden. In neuerer Zeit sind weitere Wege der Synthese von Imidazolen und Benzimidazolen beschrieben worden.[11]
Eigenschaften und Toxikologie
Imidazol bildet farblose Kristalle, die sich gut in Wasser lösen. Der Heterocyclus besitzt sowohl basische als auch saure Eigenschaften und ist daher ein Ampholyt. Die anionische Form des Imidazols heißt Imidazolid-Ion, die kationische Form Imidazolium-Ion.
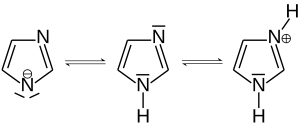
Auf Warmblüter wirkt Imidazol mit LD50-Werten zwischen 220 (Ratte)[7] und 880 mg/kg Körpergewicht (Maus)[8] mäßig toxisch; bei niederen Tieren besitzt es als Antimetabolit des Histidins und der Nicotinsäure eine deutlich höhere Giftigkeit und wird daher als Schädlingsbekämpfungsmittel verwendet.[10]
Verwendung
Imidazol dient hauptsächlich als Ausgangsstoff für die Herstellung verschiedener Medikamente, insbesondere von Fungiziden des Azoltyps, z. B. Clotrimazol. Weiterhin findet es Verwendung bei der Aushärtung bestimmter Kunststoffe.
Ebenfalls verwendet man Imidazol als Puffersubstanz beim Karl-Fischer-Verfahren zur Wasserbestimmung. Eugen Scholz entwickelte 1984 das pyridinfreie Karl-Fischer-Reagenz mit Imidazol als Base. Dieses Reagenz ersetzt nicht nur das giftige und übelriechende Pyridin, es ermöglicht auch eine schnellere und genauere Titration, da Imidazol in einem günstigeren pH-Bereich puffert als Pyridin. Die Untersuchungen von Scholz zur Stöchiometrie zeigten auch, dass Methanol (Lösemittel und gleichzeitig an der Reaktion beteiligt) durch andere Alkohole ersetzt werden kann, z. B. Ethanol, 2-Propanol oder Methoxyethanol, die die Titerstabilität des Reagenzes verbesserten. Aufgrund dieser Erkenntnisse ergab sich folgende Reaktionsgleichung für die Karl-Fischer-Reaktion:
In der Biochemie wird Imidazol zur Elution von Proteinen verwendet, die mit einem Histidin-Tag (mehrere aufeinanderfolgende Histidine) versehen sind. Dabei werden die Proteine an einer Metallionenchelat-Matrix (IMAC) wie z. B. Ni2+-NTA gebunden und durch hohe Konzentrationen von Imidazol wieder von der Säule ausgewaschen. Da Imidazol auch einige alkalische Phosphatasen inhibiert, ist es Bestandteil in der Biochemie verwendeter Phosphataseinhibitor-Cocktails.[12][13]
Imidazol wird auch als Linker für die Synthese von Zeolitic Imidazolate Frameworks (ZIFs) eingesetzt.[14] In den resultierenden Gerüststrukturen ist die deprotonierte Form (Imidazolat, Im) eingebaut, wobei beide Stickstoffatome an die entsprechenden Metallzentren koordiniert sind.
Risikobewertung
Imidazol wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Imidazol waren die Besorgnisse bezüglich der Einstufung als CMR-Substanz, hoher (aggregierter) Tonnage und weit verbreiteter Verwendung. Die Neubewertung fand ab 2012 statt und wurde vom Vereinigten Königreich durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[15][16]
Am 9. Oktober 2020 flossen nach Angaben der BASF ca. 300 kg vom BASF-Werk Ludwigshafen in den Rhein.[17] Das Unternehmen selbst stufte den Vorfall als "für Wasserorganismen nicht gefährlich" ein.[18]
Einzelnachweise
- Eintrag zu IMIDAZOLE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu Imidazol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juni 2014.
- Eintrag zu Imidazole in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 25. Mai 2021.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-300.
- Eintrag zu Imidazole im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu Imidazol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Przeglad Epidemiologiczny. Vol. 67, S. 295, 1993.
- Deutsche Patentoffenlegungsschrift. Vol. #3046325
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, 2006, ISBN 3-906390-29-2, S. 483.
- Imidazole Synthesis.
- Claude Brunel, Guy Cathala: Imidazole: An inhibitor of l-phenylalanine-insensitive alkaline phosphatases of tissues other than intestine and placenta. In: Biochimica et Biophysica Acta (BBA) - Enzymology. 268, 1972, S. 415, doi:10.1016/0005-2744(72)90337-3.
- Sigma Phosphatase Inhibitor Cocktail (PDF-Datei)
- Kyungkyou Noh, Jisu Lee, Jaheon Kim: Compositions and Structures of Zeolitic Imidazolate Frameworks. In: Israel Journal of Chemistry. Band 58, Nr. 9-10, 2018, ISSN 1869-5868, S. 1075–1088, doi:10.1002/ijch.201800107.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Imidazole, abgerufen am 20. Mai 2019.
- BASF: Giftiger Stoff in den Rhein ausgetreten – Chemieunternehmen präsentiert Ursache, auf mannheim24.de
- Produktaustritt in den Rhein, auf basf.com


