Naphthalin
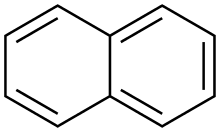
Naphthalin [naftaˈliːn] (von altgriechisch νάφθα naphtha ‚Erdöl‘; Name nach IUPAC Naphthalen) ist ein farbloser Feststoff mit der Summenformel C10H8, der schon bei Raumtemperatur sublimiert. Es ist ein bicyclischer aromatischer Kohlenwasserstoff mit charakteristischem Geruch nach Mottenpulver/Teer. Naphthalin ist gesundheitsschädlich und umweltgefährlich.

| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Naphthalin | |||||||||||||||
| Andere Namen |
Naphthalen (IUPAC) | |||||||||||||||
| Summenformel | C10H8 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff mit Geruch nach Mottenpulver/Teer[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 128,17 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,14 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
218 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
1819 wurde Naphthalin von den britischen Chemikern William Thomas Brande (1788–1866),[4] Alexander Garden († 1829)[5] und John Kidd unabhängig voneinander aus Steinkohlenteer isoliert. Der Name stammt von Kidd. 1826 fand Michael Faraday die Summenformel. 1866 wurde von Emil Erlenmeyer zum ersten Mal die Naphthalinformel aufgestellt. Traditionell wird Naphthalin auch zu den polycyclischen aromatischen Kohlenwasserstoffen (PAK) gezählt. Das Naphthalinmolekül besteht aus zwei anellierten Benzolringen, sein chemisches Verhalten ähnelt dem der anderen PAK.
Vorkommen in der Natur
Spuren von Naphthalin werden von Magnolien und einigen Hirscharten[6] produziert. Außerdem wurde der Stoff bei einer Termitenart nachgewiesen, die es offenbar als Abwehrstoff gegen natürliche Feinde wie Ameisen und giftige Pilze verwendet.
Gewinnung und Darstellung
Naphthalin wird aus der Mittelölfraktion des Steinkohlenteers (bis zu 11 %), sowie Braunkohlen- und Holzteer, Crackgasöl oder auch aus Kohle, wenn diese verkokt wird, gewonnen. Im Steinkohleteer ist es mengenmäßig die größte Komponente. Es kommt auch in Petroleum und anderen fossilen Energieträgern vor und entsteht auch bei der Verbrennung von Holz oder Tabak. Naphthalin wird von Gaswerksstandorten und Holzimprägnierwerken emittiert, des Weiteren entsteht es auch auf Mülldeponien.
1987 wurde ungefähr eine Million Tonnen Naphthalin produziert. Westeuropa ist mit 250.000 Tonnen der Hauptproduzent von Naphthalin, dann folgen Osteuropa (200.000 Tonnen), Japan (200.000 Tonnen) und die USA (125.000 Tonnen).
Eigenschaften
Physikalische Eigenschaften
In Wasser ist Naphthalin weitgehend unlöslich, bei Raumtemperatur lösen sich nur 0,032 g Naphthalin in einem Liter Wasser.[1] In kurzkettigen Alkoholen ist es schlecht, in unpolaren Lösungsmitteln wie Benzol (1,130 g/l), Kohlenstoffsulfid, Ether, Toluol (910 g/l), Xylol (783 g/l), und Chloroform dagegen gut löslich. Naphthalin bildet weiße Kristallblättchen aus, die bei 80 °C zu einer farblosen Flüssigkeit schmelzen, welche bei 218 °C siedet. Es besitzt einen charakteristischen, intensiv aromatischen teerähnlichen Geruch; die Geruchsschwelle liegt je nach Person bei 0,14 bis 125 mg/m3. Naphthalin hat einen brennenden Geschmack. Die Dämpfe sind brennbar, der Flammpunkt liegt bei 80 °C und die Zündtemperatur bei 540 °C.[1] Die Dichte beträgt 1,14 g/cm3, daher sinkt Naphthalin in Wasser.[1]
Chemische Eigenschaften
Naphthalin verbrennt mit leuchtender, rußender Flamme. Es reagiert heftig mit Oxidationsmitteln wie Chromtrioxid und Stickstoffoxiden. Das chemische Verhalten weist große Ähnlichkeit mit dem von Benzol auf, jedoch ist es aufgrund der Molekülstruktur reaktiver als Benzol, aber weniger reaktiv als tricyclische Aromaten, wie beispielsweise Anthracen. Das Naphthalinmolekül weist 10 π-Elektronen auf. Es geht wie Benzol elektrophile Substitutionsreaktionen ein. Azulen, auch ein aromatischer Kohlenwasserstoff, ist ein Isomer des Naphthalins, es besteht aus einem Fünfer- und einem Siebener-Kohlenstoffring; aufgrund einer dipolaren Struktur ist es jedoch tiefblau und deutlich reaktiver als Naphthalin.
Naphthalin kann unter gemäßigten Bedingungen zu Tetralin (C10H12) hydriert werden. Die weitere Hydrierung unter drastischeren Bedingungen führt zum Decalin (C10H18).
Naphthalin bildet durch Reduktion mit Alkalimetallen in aprotischen Lösemitteln (z. B. Tetrahydrofuran, 1,2-Dimethoxyethan) Alkalinaphthalide. Mit Natrium ergibt sich ein tiefgrünes Salz.[7][8] Es handelt sich um ein Radikalanion das ein ESR-Signal bei g = 2,0 hat. Das Reduktionspotential beträgt −2,5 V (gegen Standard-Wasserstoffelektrode (SHE)). Ursache der grünen Farbe sind Absorptionsbanden bei 463 und 735 nm.[9]
Das Anion ist eine starke Base, mit protischen Lösemittel reagiert es zu Dihydronaphthalin:
Mit konzentrierter Salpetersäure bildet Naphthalin je nach den gewählten Reaktionsbedingungen 1-Nitronaphthalin oder 2-Nitronaphthalin.
Nachweis
Die Oxidation mit Chromaten und Permanganaten oder großtechnisch mit Sauerstoff an einem Katalysator ergibt Phthalsäure. Naphthalin kann UV-spektroskopisch oder per Hochleistungsflüssigkeitschromatographie nachgewiesen werden.
Die Emissionsmessung von Naphthalin kann mittels GC/MS erfolgen.[10] Die Immissionsmessung erfolgt mit hochauflösender Massenspektrometrie (HRMS).[11]
Mittels Biomonitoring ist Naphthalin aufgrund seiner Flüchtigkeit nur mit eingeschränkter Zuverlässigkeit bestimmbar.[12]
Verwendung
Früher war Naphthalin der Hauptbestandteil von Mottenkugeln, wird aber heute wegen seines unangenehmen Geruchs oft durch andere Substanzen ersetzt. Des Weiteren ist Naphthalin kaum insektizid wirksam. Auch zur Desinfektion von Insektensammlungen ist es kaum wirksam, obwohl man es lange Zeit dazu verwendete.[13]
Naphthalin kam auch in dem Anfang des 20. Jahrhunderts verwendeten Leuchtgas vor und verstopfte oft die Gasleitungen, da es sich als Feststoff abschied. Trotz seines gesundheitlichen Gefährdungspotenzials wurde es zum Beispiel medizinisch zur Darmdesinfektion verwendet.
Hauptsächlich wird Naphthalin zur Synthese von Phthalsäureanhydrid verwendet, das zu Lösungsmitteln, Kunststoffen und Kraftstoffen weiterverarbeitet wird. Auch zur Herstellung der Lösungsmittel und Kraftstoffzusätze Decalin und Tetralin wird es benötigt, für die Herstellung von Azofarbstoffen, zur Synthese des Holzschutzmittels Chlornaphthalin, von Insektiziden (Carbamaten) sowie von PVC-Weichmacher-Zwischenprodukten, außerdem zur Herstellung von Alkylnaphthalinsulfaten, die als Seifen benutzt werden. Weitere industriell wichtige Abkömmlinge sind die Naphthole, Bromnaphthaline, Naphthylamine und Nitronaphthaline. Eine weitere Anwendung von Naphthalin ist die als Porenbildner bei der Herstellung von Schleifmitteln.[14]
Biologische Bedeutung
In den Mikrosomen der menschlichen Leberzellen wird Naphthalin von Cytochrom P450 metabolisiert. Die Oxidation führt über die kurzlebige Epoxid-Zwischenstufe zu den primären Metaboliten:[15]
- trans-1,2-Dihydro-1,2-naphthalindiol („Dihydrodiol“)
- 1-Naphthol und
- 2-Naphthol
Der Cytochrom-Untertyp CYP1A2 erzeugt dabei vor allem das Dihydrodiol und 1-Naphthol, während der Untertyp CYP3A4 im Wesentlichen 2-Naphthol produziert. Als sekundäre Metaboliten entstehen aus 2-Naphthol direkt 2,6- und 1,7-Dihydroxynaphthalin. Dagegen werden Dihydrodiol und 1-Naphthol nicht weiter in den Mikrosomen abgebaut.
Sicherheitshinweise
Naphthalin führt auf der Haut zu starken Reizungen und zur Dermatitis. Naphthalin kann die roten Blutzellen schädigen. Beim Einatmen kann es zu Schleimhautreizungen, Kopfschmerzen und Übelkeit, Erbrechen und Verwirrtheitszuständen führen. Bei Einnahme führt es zu Magen-Darm-Störungen, Atemlähmung, Krämpfen und Tremor. Es ist trotz seiner geringen Löslichkeit in Wasser stark wassergefährdend (WGK 3).[1] Eine Schädigung der Augenhornhaut, der Leber und Nieren ist möglich. Zwischen einem Luftvolumenanteil von 0,9 bis 5,9 % bildet es explosive Gemische.[1] Eine krebserregende Wirkung wird vermutet.
In Deutschland wurde der Arbeitsplatzgrenzwert von Naphthalin im Jahr 2011 um den Faktor 100 auf 0,5 mg/m3 gesenkt.[14]
Naphthalin wurde 2014 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Naphthalin waren die Besorgnisse bezüglich Exposition von Arbeitnehmern, hoher (aggregierter) Tonnage und hohes Risikoverhältnis (Risk Characterisation Ratio, RCR). Die Neubewertung fand ab 2016 statt und wurde vom Vereinigten Königreich durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[16][17]
Derivate
| Name | SummenFormel | Molmasse [g/mol] | Schmelzpunkt. [°C] | Siedepunkt [°C] | Dichte [g/cm3] | Brechungsindex |
|---|---|---|---|---|---|---|
| 1-Naphthoesäure | C11H8O2 | 172,18 | 157 | 300 | – | – |
| 2-Naphthoesäure | C11H8O2 | 172,18 | 182 | – | 1,08 | – |
| 1-Naphthoesäurechlorid | C11H7ClO | 190,63 | 16–19 | 190 (35 Torr) | 1,265 | 1,6552 |
| 1-Naphthol | C10H8O | 144,17 | 94–96 | 278 | 1,224 | – |
| 1-Naphthaldehyd | C11H8O | 156,18 | 1–2 | 160 (15 Torr) | – | – |
| 1-Nitronaphthalin | C10H7NO2 | 173,17 | 53–57 | 340 | 1,22 | – |
| 1-Fluornaphthalin | C10H7F | 146,16 | −19 | 215 | 1,323 | 1,593 |
| 2-Fluornaphthalin | C10H7F | 146,16 | 61 | 211,5 | – | – |
| 1-Chlornaphthalin | C10H7Cl | 162,62 | −6 | 259 | 1,194 | 1,632 |
| 2-Chlornaphthalin | C10H7Cl | 162,62 | 59,5 | 256 | 1,138 | – |
| 1-Bromnaphthalin | C10H7Br | 207,07 | −2 | 279 | 1,489 | 1,670 |
| 2-Isopropylnaphthalin | C13H14 | 170,255 | 14 | 268 | 0,975 | – |
Siehe auch
Literatur
- BUA – Stoffberichte 39. Naphthalin. Wiley/VCH, Weinheim 1989, ISBN 3-527-28066-9.
- Harald Derner: Untersuchungen über den Resonanz-Ramaneffekt an Anthracen, Naphthalin und p-Nitro-p-dimethylamino-azobenzol. Dissertation. Freiburg (Breisgau) 1986, ISBN 3-8107-2217-0.
Weblinks
Einzelnachweise
- Eintrag zu CAS-Nr. 91-20-3 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. Oktober 2020. (JavaScript erforderlich)
- Eintrag zu Naphthalene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 91-20-3 bzw. Naphthalin), abgerufen am 2. November 2015.
- J. R. Partington: History of Chemistry. Band 4, Macmillan 1972, S. 75–76.
- Ann. Phil. Band 15, 1920, S. 74. Garden war mit Friedrich Accum verbunden. Nach Brian Clegg, Naphthalene, Royal Chemical Society, hatte er einen Laden für Chemikalien in London und war Schotte.
- J. Gassett, D. Wiesler, A. Baker, D. Osborn, K. Miller, R. Marchinton, M. Novotny: Volatile Compounds from the Forehead Region of Male White-Tailed Deer (Odocoileus virginianus). In: J. Chem. Ecol. 23, 1997, S. 569–578; doi:10.1023/B:JOEC.0000006397.63647.5b.
- E. J. Corey, Andrew W. Gross: tert-Butyl-tert-octylamine In: Organic Syntheses. 65, 1987, S. 166, doi:10.15227/orgsyn.065.0166; Coll. Vol. 8, 1993, S. 93 (PDF).
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 102.
- N. G. Connelly, W. E. Geiger: Chemical Redox Agents for Organometallic Chemistry. In: Chem. Rev. 96, 1996, S. 877–910; doi:10.1021/cr940053x.
- VDI 3874:2006-12 Messen von Emissionen; Messen von polyzyklischen aromatischen Kohlenwasserstoffen (PAH); GC/MS-Verfahren (Stationary source emissions; Determination of polycyclic aromatic hydrocarbons (PAH); GC/MC method). Beuth Verlag, Berlin, S. 4.
- VDI 2464 Blatt 4 (Entwurf):2015-06 Messen von Immissionen; Messen von Innenraumluft; Messen von persistenten halogenorganischen Verbindungen (POP) mit GC/HRMS (Ambient air measurement; Indoor air measurement; Measurement of persistent organic pollutants (POPs) with GC/HRMS). Beuth Verlag, Berlin, S. 4, 8.
- VDI 3957 Blatt 2:2016-03 Biologische Messverfahren zur Ermittlung und Beurteilung der Wirkung von Luftverunreinigungen auf Pflanzen (Biomonitoring); Verfahren der standardisierten Graskultur (Biological measuring techniques for the determination and assessment of effects of air pollutants on plants (biomonitoring); Method of the standardised grass exposure). Beuth Verlag, Berlin, S. 24.
- Gerfried Deschka: Die Desinfektion kleiner Insektensammlungen nach neueren Gesichtspunkten. In: Steyrer Entomologenrunde. Nr. 21, Steyr 1987, S. 57–61.
- Kirsten Sucker, Wolfgang Zschiesche, Thomas Hummel, Dietmar Breuer, Silke Werner, Claudia Friedrich, Tobias Weiß, Monika Raulf, Dirk Pallapies, Jürgen Bünger, Thomas Brüning: Naphthalin: Chronische Exposition am Arbeitsplatz – Relevanz für die Grenzwertableitung – Ergebnisse der Querschnittstudie zur Naphthalinexposition in der Schleifmittelindustrie. In: Gefahrstoffe – Reinhalt. Luft. 77, Nr. 10, 2017, S. 439–442.
- T. M. Cho, R. L. Rose, E. Hodgson: In vitro metabolism of naphthalene by human liver microsomal cytochrome P450 enzymes. In: Drug Metab Dispos. 34(1), Jan 2006, S. 176–183; PMID 16243959.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Naphthalene, abgerufen am 26. März 2019.



