Fluoren
Fluoren ist eine chemische Verbindung, die zur Gruppe der polycyclischen aromatischen Kohlenwasserstoffe (PAK) gehört. Fluoren leuchtet bei Bestrahlung mit UV-Licht violett, was der Verbindung ihren Namen gab (siehe auch: Fluoreszenz).
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
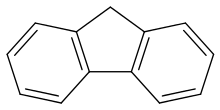 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Fluoren | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C13H10 | |||||||||||||||
| Kurzbeschreibung |
farblose Blättchen[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 166,22 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,2 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
295 °C[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Vorkommen
Fluoren kommt in der Natur als das sehr seltene Mineral Kratochvílit vor.
Gewinnung und Darstellung
Fluoren wird technisch aus Steinkohleteer gewonnen, und zwar aus der Waschölfraktion bei der Destillation des Teers. Die Substanz entsteht auch in kleinen Mengen neben anderen aromatischen polyzyklischen Verbindungen bei der Erhitzung oder Verbrennung von organischem Material unter Sauerstoffmangel, in Spuren auch bei der Verbrennung von Benzin und Diesel.
Eigenschaften
Physikalische Eigenschaften
Fluoren ist ein kristalliner Feststoff, der bei 114,5 °C schmilzt. Die Schmelzenthalpie beträgt 19,1 kJ·mol−1.[5] In fester Phase treten zwei polymorphe Kristallformen auf. Die Tieftemperaturkristallform wandelt sich bei 13 °C in einem Phasenübergang zweiter Ordnung in die Hochtemperaturkristallform um.[6] Die Dampfdruckfunktion der Schmelze ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 5,25103, B = 3011,076 und C = 3,857 im Temperaturbereich von 434 bis 573 K.[7]
Chemische Eigenschaften
Eine Besonderheit des Fluorens ist, dass es bei Deprotonierung ein aromatisches Anion ergibt. Dieses ist dem Cyclopentadienylanion ähnlich. So wird das Fluorenylanion analog zum Cyclopentadienyl- und Indenylanion als Ligand in der metallorganischen Chemie eingesetzt. Die Gruppe Fluorenylmethoxycarbonyl (Fmoc), die wegen der genannten Eigenschaft leicht zu deprotonieren ist, dient als basisch abspaltbare Schutzgruppe bei der chemischen Peptidsynthese.
Verwendung
Fluoren wird zur Herstellung von Farb- und Kunststoffen, sowie von Pestiziden verwendet. Polyfluoren ist weit verbreitet als Luminophor in organischen Leuchtdioden. Fluoren und einige seiner Derivate wirken als Mitogene, d. h., sie leiten eine Zellteilung ein. Dies erklärt die mögliche Verwendung von Fluoren und Fluorencarbonsäuren als Pflanzenwuchsstoffe. In der Medizin werden ungiftige Fluorenderivate (z. B. Fluorenon) als Medikament zur Steigerung der Gewebebildung nach Transplantationen diskutiert (siehe Weblink).
Einzelnachweise
- Eintrag zu Fluoren. In: Römpp Online. Georg Thieme Verlag, abgerufen am 28. Dezember 2014.
- Eintrag zu CAS-Nr. 86-73-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. Dezember 2012. (JavaScript erforderlich)
- Europäisches Arzneibuch, Deutscher Apotheker Verlag Stuttgart, 6. Ausgabe, 2008, S. 605, ISBN 978-3-7692-3962-1.
- Datenblatt Fluoren bei AlfaAesar, abgerufen am 15. Dezember 2010 (PDF) (JavaScript erforderlich).
- Lisicki, Z.; Jamróz, M.E.: (Solid + liquid) equilibria in (polynuclear aromatic+ tertiary amide) systems in J. Chem. Thermodyn. 32 (2000) 1335–1353, doi:10.1006/jcht.2000.0685.
- Finke, H.L.; Messerly, J.F.; Lee, S.H.; Osborn, A.G.; Douslin, D.R.: Comprehensive thermodynamic studies of seven aromatic hydrocarbons in J. Chem. Thermodyn. 9 (1977) 937–956.
- Mortimer, F.S.; Murphy, R.V.: The Vapor Pressures of Some Substances Found in Coal Tar in Ind. Eng. Chem. 15 (1923) 1140–1142, doi:10.1021/ie50167a012.
