Kupfer(I)-chlorid
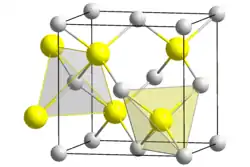
Kupfer(I)-chlorid ist eine chemische Verbindung aus Kupfer und Chlor mit der Formel CuCl. Sie ist eine Lewis-Säure. Kupfer(I)-chlorid kristallisiert in der Sphalerit-Struktur.
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| _ Cu+ _ Cl− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kupfer(I)-chlorid | ||||||||||||||||||
| Verhältnisformel | CuCl | ||||||||||||||||||
| Kurzbeschreibung |
weißes Kristallpulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 99,00 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
4,14 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
1490 °C (Zersetzung)[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,9727[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
0,01 mg·m−3[2] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
-chloride-sample.jpg.webp)
Kupfer(I)-chlorid kann durch Reduktion von Kupfer(II)-sulfat mit Natriumdisulfit in halbkonzentrierter Salzsäure hergestellt werden. Weitere Möglichkeiten zur Herstellung sind die Reduktion von Kupfer(II)-chlorid mit Elektrolytkupfer in siedender Salzsäure oder durch Zink, Hypophosphorsäure, Hydrazin oder Natriumsulfit[3]
sowie durch Ausfällen aus kochsalzhaltiger Kupfersulfat-Lösung mittels durchgeleitetem Schwefeldioxid.
Alternativ bildet sich Kupfer(I)-chlorid beim Erhitzen von Kupfer(II)-chlorid mit metallischem Kupfer in konzentrierter Salzsäure als komplexe Säure H[CuCl2]. Beim Verdünnen der Lösung zerfällt sie unter Abspaltung von Salzsäure und Bildung eines weißen, schwerlöslichen Niederschlags von CuCl.[1]
Großtechnisch wird es durch Reaktion von Kupfer mit Chlor bei Temperaturen zwischen 450 und 900 °C gewonnen.[3]
Eigenschaften
Reines Kupfer(I)-chlorid ist schneeweiß, jedoch durch Oxidation zu basischem Kupfer(II)-chlorid Cu(OH)Cl oft grünlich gefärbt.
Eine Lösung von Kupfer(I)-chlorid in Ammoniak ist in der Lage, Kohlenstoffmonoxid unter Bildung der Komplexverbindung [CuCl(CO)(H2O)2] zu absorbieren. Ebenso bilden außer Ammoniak Acetylen und Olefine entsprechende Komplexverbindungen.[7] Es besitzt eine Kristallstruktur vom Zinkblende-Typ mit der Raumgruppe F43m (Raumgruppen-Nr. 216) (a = 541,6 pm). Bei 407 °C erfolgt der Übergang in eine Hochtemperaturmodifikation vom Wurtzit-Typ mit der Raumgruppe P63mc (Nr. 186) (a = 391, c = 642 pm). Die Bildungsenthalpie beträgt −138,1 kJ/mol.[1]
Verwendung
Kupfer(I)-chlorid wird verwendet:
- als Katalysator für viele organische Reaktionen (MCS-Synthese)
- zur phosgenfreien Polycarbonat-Herstellung
- bei der Sandmeyer-Reaktion
- bei der Olefin-Oxidation
- bei der Ammonoxidation zu Acrylnitril
- zur Herstellung von Phthalocyanin-Blau-Pigmenten
- zur Absorption von Kohlenstoffmonoxid in einer Gasbürette
Weblinks
- OECD: Screening Information Dataset (SIDS) Initial Assessment Report (SIAR) für Copper monochloride
Einzelnachweise
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 973.
- Eintrag zu Kupfer(I)-chlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 5. Januar 2022. (JavaScript erforderlich)
- H. Wayne Richardson: Handbook of copper compounds and applications, ISBN 978-0-8247-8998-5.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Index of Refraction of Inorganic Crystals, S. 10-246.
- Eintrag zu Copper chloride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 5. Januar 2022. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Nantokite. In: mindat.org. Hudson Institute of Mineralogy, abgerufen am 5. Januar 2022 (englisch).
- Cotton/Wilkinson: Anorganische Chemie, Verlag Chemie Weinheim 1967, S. 837.


