Ethinylierung
Die (Reppe-)Ethinylierung ist ein wichtiges technisches Verfahren aus dem Bereich der organischen Chemie. Es wurde in den 1930er Jahren von Walter Reppe und seinen Mitarbeitern in den Hauptlaboratorien der Badischen Anilin- und Soda-Fabrik (heute BASF SE) in Ludwigshafen am Rhein entwickelt. Zusammen mit der Vinylierung, der Cyclisierung und der Hydrocarboxylierung bildet sie die bekannte Reppe-Chemie. Das Verfahren erlangte im Rahmen der Hochdrucksynthese des Acetylens und im Zuge der modernen Verfahrenstechnik große industrielle Bedeutung.
Unter der Ethinylierung versteht man im Allgemeinen die Einführung einer Ethinyl-Gruppe (H–C≡C–R) in organisch-chemische Verbindungen unter Erhalt der C≡C–Dreifachbindung. Sie ist ein Spezialfall einer Alkinylierung.[1]
Geschichtliche Entwicklung
Eine einfache und offensichtliche Methode stellt die Umsetzung von Acetylen (Ethin) mit der jeweiligen organischen Verbindung dar. Problematisch an diesem Konzept war zunächst die Sorge, explosive und damit hochgefährliche Gemische zu bilden, wenn mit Acetylen unter erhöhtem Druck gearbeitet wird. Aus sicherheitsrelevanten Gründen legte die deutsche Acetylen-Verordnung bis zu den 1930er Jahren fest, das Acetylen nur bei maximal 1,5 bar gehandhabt werden darf. Das Forschungsteam unter der Leitung von Walter Reppe fand jedoch durch die Durchführung von Experimenten zum Zündverhalten und Zerfall des Acetylens heraus, dass sich dieses als Druckgas bis zu einem Maximaldruck von 25 bar sicher handhaben lässt. Nach dieser Erkenntnis war es Reppe möglich, seine eigentlichen Forschungsideen mit Acetylen voranzutreiben, um durch die Entwicklung eines technischen Verfahrens, neuartige Vorprodukte für die aufstrebende Kunststoffindustrie bereitzustellen. Als Chemiepionier ebnete Walter Reppe durch die Entwicklung der Ethinylierung den Weg zur großtechnischen Produktion von Vitaminen, Duftstoffen, Pflanzenschutzmitteln sowie Kunststoffen und gilt daher noch heute als Begründer der modernen Acetylenchemie.[2]
Reaktionsgleichung
Bei der Reppe-Ethinylierung werden Aldehyde und Ketone mit Acetylen unter basischer Katalyse zu Alkinolen und Alkindiolen umgesetzt. Im Falle der Ethinylierung von aliphatischen Ketonen werden meist Alkali- oder Erdalkalimetallhydroxide wie Kaliumhydroxid oder auch Amide wie Natriumamid in flüssigem Ammoniak verwendet. Aldehyde lassen sich hingegen bevorzugt mit basischen Kupfer(I)-acetylid-Katalysatoren ethinylieren, da durch basische Hydroxide (wie Kaliumhydroxid) leicht eine Aldoladditions- bzw. Aldolkondensationsreaktion als konkurrierende Nebenreaktion auftritt.[3]
Übersichtsreaktion der Ethinylierung
In der ersten Reaktionsstufe wird Acetylen mit einer Carbonyl-Verbindung in Anwesenheit des jeweiligen Katalysators zum α-Alkinol umgesetzt. Dieses kann nun ein weiteres Mal mit dem Aldehyd oder Keton reagieren und bildet schließlich ein γ-Alkindiol.
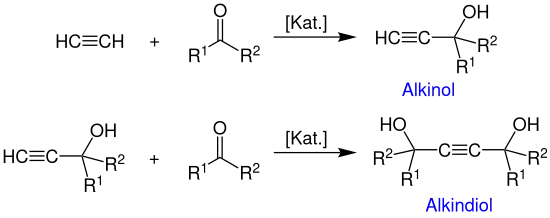
Handelt es sich bei der Carbonyl-Verbindung um ein Aldehyd, so ist R2 ein Wasserstoff-Atom und R1 kann entweder ein Wasserstoff-Atom (Formaldehyd) oder ein Organyl-Rest (Alkyl-, Aryl-, Alkenyl-Rest etc.) sein. Wird jedoch ein Keton als Carbonyl-Komponente eingesetzt, stellen beide Reste R1 und R2 unabhängig voneinander eine Organyl-Gruppe dar.
Katalysatoren und deren Herstellung
Wie bereits schon erwähnt, eignen sich für die Ethinylierung von Aldehyden und Ketonen verschiedene Katalysatoren, welche unterschiedlich wirksam sind.
Wird als Carbonyl-Verbindung ein Aldehyd ethinyliert, so wird in den meisten Fällen Kupfer(I)-acetylid als Katalysator verwendet. Im Labor stellt man diesen her, in dem man ein einwertiges Kupfersalz (vorzugsweise Kupfer(I)-chlorid CuCl) mit Wasser in einem Rührkolben aufschlämmt, welcher mit silikathaltigem Material gefüllt ist (z. B. Bleicherde). Anschließend leitet man bei Temperaturen von 80–90 °C gasförmiges Acetylen ein, bis das komplette Kupfersalz abreagiert hat. Das gebildete Kupfer(I)-acetylid ist nahezu unlöslich in Wasser und fällt praktisch quantitativ aus. Die entstehende Salzsäure wird mit geeigneten Pufferlösungen oder kleineren Mengen an Basen neutralisiert, da das Kupfer(I)-acetylid in stark sauren Medium instabil ist. Danach wird der Filterkuchen mit destilliertem Wasser gewaschen, bis er frei von Chlorid-Ionen ist und direkt ohne weitere Reinigung für die Ethinylierung verwendet.[4]
-acetylid.svg.png.webp)
Industrielle Katalysatoren bestehen meist aus Kupfer(I)-oxid, welches auf einem silikathaltigen Träger (SiO2) aufgetragen ist und enthalten etwa noch 3–6 % Bismut(III)-oxid (Bi2O3) als Promotor und zur Verbesserung der Selektivität, da es die Bildung von sogenannten Cuprene (Polyacetylene) unterdrückt. Das Kupfersalz wird während der Reaktion durch das Acetylen in Kupfer(I)-acetlyid konvertiert.[5]
Bei der Ethinylierung eines Ketons zeigen die Kupfer(I)-acetylid-Katalysatoren wenig Wirkung. Da die konkurrierende Nebenreaktion der basenkatalysierten Aldolreaktion nicht so schnell wie bei Aldehyden eintritt, ist es hier möglich, Alkali- oder Erdalkalimetallhydroxide (z. B. Natrium- oder Kaliumhydroxid), Carbonate, tertiäre Amine sowie Alkalimetallalkoholate oder -amide als Katalysatoren einzusetzen. Besonders gut funktioniert die Ethinylierung bei, vor allem cycloaliphatischen, Ketonen in Gegenwart von Natriumacetylid (in situ gebildet aus Acetylen und Natriumamid) in flüssigem Ammoniak bei tieferen Temperaturen.[3]
Anwendungsbeispiele
Industrielle Anwendung findet die Ethinylierung unter anderem bei der Herstellung von 1,4-Butandiol. Ausgehend von Acetylen und Formaldehyd wird über die Zwischenstufe des Propargylalkohol (Alkinol) das 2-Butin-1,4-diol (Alkindiol) gebildet, welches in einer mehrstufigen katalytischen Hydrierung zu 1,4-Butandiol umgesetzt wird.
Darüber hinaus kommt die Ethinylierung bei der technischen Synthese der Vitamin-E-Vorstufe Isophytol zum Einsatz. Dabei wird in einer ersten Reaktionsschufe Aceton mit Acetylen zum 2-Methyl-3-butin-2-ol ethinyliert, welches dann über mehrere Zwischenstufen (und weitere Ethinylierungen) zum Isophytol umgesetzt wird.[6]
Einzelnachweise
- Eintrag zu Ethinylierung. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Dezember 2019.
- Michael Lang: Tradition der Ideen: Reppe-Chemie. In: BASF SE. April 2008, abgerufen am 30. Dezember 2019.
- Hans R. Christen, Fritz Vögtle: Grundlagen der organischen Chemie. 1. Auflage. Salle und Sauerländer, 1989, ISBN 978-3-7935-5399-1, S. 92.
- Walter Reppe: Äthinylierung III. In: Justus Liebigs Annalen der Chemie. Wiley‐VCH Verlag GmbH & Co. KGaA., 14. November 1955, Vol. 596, Issue 1, doi:10.1002/jlac.19555960106.
- Heinz Gräfje, Wolfgang Körnig, Hans‐Martin Weitz, Wolfgang Reiß, Guido Steffan, Herbert Diehl, Horst Bosche, Kurt Schneider, Heinz Kieczka, Rolf Pinkos: Butanediols, Butenediol, and Butynediol. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley‐VCH Verlag GmbH & Co. KGaA., 23. Juli 2019, S. 2, doi:10.1002/14356007.a04_455.pub2.
- Thomas Netscher, Werner Bonrath: Synthese von Isophytol und Totalsynthese von (all-rac)-a-Tocopherol. In: Aktuelle Wochenschau. 2008, abgerufen am 18. Januar 2020.