Vinylchlorid
Vinylchlorid (Chlorethen, auch Monochlorethen oder – eigentlich veraltet – Monochlorethylen), abgekürzt VC, ist ein farbloses, brennbares, narkotisierendes Gas mit in hoher Konzentration leicht süßlichem, chlorartigem Geruch.[2] Es ist die Grundsubstanz zur Herstellung von Polyvinylchlorid (PVC). Vinylchlorid wurde von Henri Victor Regnault entdeckt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||
| Name | Vinylchlorid | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C2H3Cl | |||||||||||||||
| Kurzbeschreibung |
farb- und geruchsloses Gas[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 62,5 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
2,86 kg·m−3 (0 °C und 1,013 bar)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
−13,4 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Dipolmoment | ||||||||||||||||
| Brechungsindex |
1,3700 (20 °C)[5] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
37,2 kJ/mol[9] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Gewinnung und Darstellung
Historisches Verfahren
Das erste Verfahren zur technische Herstellung von Vinylchlorid wurde von der Chemischen Fabrik Griesheim-Elektron entwickelt. Danach wird Acetylen mit Chlorwasserstoff im Rahmen einer Hydrochlorierung bei Temperaturen von 140–200 °C unter Normaldruck an Quecksilber(II)-chlorid-Katalysatoren, welche auf Aktivkohle geträgert sind, umgesetzt.[10]
.svg.png.webp)
Die gesamte Reaktion läuft in der Gasphase ab und wird in Rohrbündelreaktoren, welche die exotherme Reaktion (ΔHR= –98,8 kJ·mol−1) mithilfe eines Ölkreislaufes kühlen, durchgeführt.[11] Der Acetylenumsatz ist mit 96–97 % nahezu quantitativ und die Vinylchlorid-Selektivität beträgt 98–99 %. Das Verfahren verläuft im Allgemeinen sehr selektiv und ist apparativ wenig aufwendig.[10]
Die Verwendung von Acetylen als Rohstoff für die industrielle Vinylchlorid-Produktion hat in den letzten Jahrzehnten stark an Bedeutung verloren. Die hohen Selbstkosten des Acetylens im Gegensatz zu preiswerteren und besser verfügbaren Rohstoffen auf Basis petrochemischer Erzeugung, vor allem Ethen, führten dazu, dass bis zur Jahrtausendwende lediglich noch 5 % des Vinylchlorids auf Basis von Acetylen hergestellt wurden.
In den letzten Jahren hat sich die Situation erneut stark verändert. Heute werden wieder nahezu 23 % des Vinylchlorids aus Acetylen hergestellt.[12] Dies lässt sich dadurch erklären, dass vor allem in Regionen, in denen Acetylen als Rohstoff noch preiswert zur Verfügung steht und die Gewinnung ebenfalls billig ablaufen kann, die momentane Vinylchlorid-Synthese auf Basis von Acetylen (häufig auch in gekoppelten Prozessen mit der EDC-Route) erfolgt. Besonders in China und Südafrika – beides Gebiete, die noch über große Kohle- und Steinsalzvorkommen verfügen und geringe Nebenkosten (z. B. Strom) haben – ist dieses Verfahren noch rentabel.[10][13]
Moderne Verfahren
Bei der modernen Herstellung von Vinylchlorid wird in einem ersten Schritt aus Ethen und Chlor durch so genannte „Direktchlorierung“ 1,2-Dichlorethan erzeugt.[14]
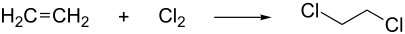 ΔH = −180 kJ/mol
ΔH = −180 kJ/mol
Weit verbreitet ist auch die Darstellung mittels Oxychlorierung von Ethen mit Chlorwasserstoff und Sauerstoff.[14]
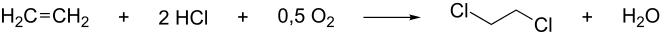 ΔH = −239 kJ/mol
ΔH = −239 kJ/mol
In einem nachgeschalteten Schritt wird das 1,2-Dichlorethan unter Abspaltung von Chlorwasserstoff zu Vinylchlorid umgesetzt.[14][15]
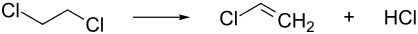 ΔH = +71 kJ/mol
ΔH = +71 kJ/mol
Im Jahr 2010 wurden weltweit ca. 35 Millionen Tonnen an Vinylchlorid verbraucht.
Eigenschaften
Vinylchlorid ist leicht entflammbar (Zündtemperatur 435 °C). Bei einem Volumenanteil von 3,8 bis 31 Prozent in Luft ist es explosiv. Vinylchlorid kondensiert bei −13,9 °C und erstarrt bei −154 °C.
Vinylchlorid polymerisiert bei Einwirkung von Licht, Luft und Wärme zu Polyvinylchlorid. Beim Verbrennen von Vinylchlorid entstehen Chlorwasserstoff und Spuren von Phosgen. Vinylchlorid löst sich fast unbegrenzt in organischen Lösungsmitteln, aber nur wenig in Wasser. Die Polymerisationswärme beträgt −71 kJ·mol−1 bzw. −1135 kJ·kg−1.[16]
Verwendung
Der Hauptverwendungszweck von Vinylchlorid ist die Herstellung von Polyvinylchlorid (2004 rund 38 Millionen Tonnen).[17] Dies geschieht mittels radikalischer Polymerisation. Früher wurde Vinylchlorid auch unter diversen Namen als Kühlmittel verwendet.[18]
Umwelt
In ihren Air Quality Guidelines for Europe[19] geht die WHO davon aus, dass die in westeuropäischen Ländern generell vorhandene, durchschnittliche Luftkonzentration zwischen 0,1 und 0,5 μg/m3 liegt. In der Nachbarschaft von Vinylchlorid- und Polyvinylchlorid-Anlagen können die 24-Stunden-Konzentrationen 100 μg/m3 überschreiten. In Entfernungen von über einem Kilometer zur Anlage liegen sie üblicherweise unter 10 μg/m3. VC zersetzt sich an der Luft und hat eine Halbwertszeit von 20 Stunden. Die WHO geht davon aus, dass bei einer lebenslangen Exposition mit 1 μg/m3 das Krebsrisiko bei 1 zu 1 Million liegt.
1974 lag in der Bundesrepublik Deutschland die Emission von Vinylchlorid bei der Herstellung von PVC zwischen 15 und 55 kg pro Tonne produziertem PVC, konnte aber bereits zwei Jahre später auf Werte zwischen 8 und 20 kg pro Tonne produziertem PVC gesenkt werden.[20]
Sicherheitshinweise
Vinylchlorid wurde lange Zeit lediglich als betäubend und augenreizend eingestuft. Die toxischen Eigenschaften für den Menschen wurden erstmals in den 1960er Jahren erkannt. Erst Anfang der 1970er Jahre wurde das klinische Bild der Vinylchlorid-Krankheit erkannt. Leber, Speiseröhre und Milz sowie die Durchblutung der Hand, die Handknochen und die Haut sind hiervon betroffen.
Exposition mit Vinylchlorid ist ätiopathogenetisch als Ursache der idiopathischen Akroosteolyse (Black-Nail-Syndrom) und des Raynaud-Syndroms beschrieben worden.
Hans Popper (1903–1988) machte die wichtige Beobachtung, dass die berufliche Exposition gegenüber Vinylchlorid hepatotoxisch ist und häufig zum Auftreten eines hepatischen Angiosarkoms führt.[21] Es wurde als krebserzeugend eingestuft und kann beispielsweise Hämangioendothelsarkome der Leber verursachen.[22]
Die Grenzwerte für die maximale Vinylchlorid-Konzentration am Arbeitsplatz wurden laufend herabgesetzt: 1966 betrug der MAK-Wert 500 ppm, 1971 100 ppm und 1974 50 ppm. Wegen der inzwischen erwiesenen Karzinogenität kann heute kein MAK-Grenzwert festgelegt werden.
Bei der Handhabung sind als Schutzmaßnahmen Atemschutz und Vollschutz notwendig. Die Lagerung erfolgt in Druckdosen und -zylindern.
Abbau
Thiodiglycolsäure kann als Metabolit von Vinylchlorid im Urin nachgewiesen werden.
Weitere Angaben
Der verbindliche Arbeitsplatzgrenzwert für Vinylchlorid in der Europäischen Union ist 3 ppm bzw. 7,77 mg·m−3 (Richtlinie 2004/37/EG).[2][23] Der Arbeitsplatzgrenzwert nach TRGS 900 liegt momentan in Deutschland für Vinylchlorid bei 1 ppm (2,6 mg/m³).[24] Vinylchlorid ist als krebserzeugend der Kategorie K1 (Stoffe, die beim Menschen bekanntermaßen krebserzeugend wirken) eingestuft.
Einzelnachweise
- Eintrag zu VINYL CHLORIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 18. September 2021.
- Eintrag zu Vinylchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Eintrag zu Vinylchlorid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Oktober 2014.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-100.
- Eintrag zu Chloroethylene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-01-4 bzw. Vinylchlorid (Monomer)), abgerufen am 14. September 2019.
- Datenblatt Vinyl chloride bei Sigma-Aldrich, abgerufen am 25. April 2011 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-21.
- Hans-Jürgen Arpe: Industrielle Organische Chemie - Bedeutende Vor- und Zwischenprodukte. 6. Auflage. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim 2007, ISBN 978-3-527-31540-6, S. 238 f.
- Manfred Fedtke, Wilhelm Pritzkow, Gerhard Zimmermann: Technische organische Chemie - Grundstoffe, Zwischenprodukte, Finalprodukte, Polymere. 1. Auflage. Deutscher Verlag für Grundstoffindustrie GmbH, Leipzig 1992, ISBN 3-342-00420-7, S. 99.
- Manfred Baerns, Arno Behr, Axel Brehm, Jürgen Gmehling, Kai-Olaf Hinrichsen, Hanns Hofmann, Regina Palkovits, Ulfert Onken, Albert Renken: Technische Chemie. 2. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany 2013, ISBN 978-3-527-33072-0, S. 614.
- Chemische Technik - Prozesse und Produkte. In: Roland Dittmeyer, Wilhelm Keim, Gerhard Kreysa, Alfred Oberholz (Hrsg.): Winnacker Küchler. 5. Auflage. Band 5. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany 2005, ISBN 978-3-527-30770-8, S. 27.
- Hans-Jürgen Arpe: Industrielle Organische Chemie. 6. Auflage. Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31540-6, S. 237–245.
- Joachim Buddrus: Grundlagen der Organischen Chemie. Walter de Gruyter Verlag, Berlin, 4. Auflage, 2011, ISBN 978-3-11-024894-4, S. 252.
- Berufsgenossenschaft Rohstoffe und chemische Industrie, Merkblatt R 008 Polyreaktionen und polymerisationsfähige Systeme, Ausgabe 05/2015, ISBN 978-3-86825-069-5.
- Vortrag mit Produktionszahlen verschiedener Kunststoffe (PDF; 3,3 MB).
- Eintrag zu Vinylchlorid in der ChemSpider-Datenbank der Royal Society of Chemistry, abgerufen am 22. Januar 2014.
- Air Quality Guidelines for Europe (PDF; 1,1 MB), 2nd Ed, 2000.
- Fritz Vahrenholt: Die Entwicklung der Vinylchloridemission bei der PVC-Herstellung. In: Staub – Reinhalt. Luft. 37, Nr. 11, 1977, S. 416–417.
- Rudi Schmid, Hans Popper, National Academy of Sciences, 1994. abgerufen am 14. Februar 2020.
- W. Hiddemann: Medizin im Brennpunkt. Springer-Verlag, 2013, ISBN 978-3-642-59730-5, S. 479 (eingeschränkte Vorschau in der Google-Buchsuche).
- Verbindliche Arbeitsplatzgrenzwerte der EU-Kommission Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, abgerufen 29. Juni 2015.
- Neue Arbeitsplatzgrenzwerte in der TRGS 900.


