Maleinsäureanhydrid
Maleinsäureanhydrid (nach IUPAC-Nomenklatur: Furan-2,5-dion, abgekürzt sehr oft auch als MSA bezeichnet) ist eine organisch-chemische Verbindung aus der Stoffgruppe der Carbonsäureanhydride, genauer das Anhydrid der Maleinsäure, einer ungesättigten Dicarbonsäure. Es ist ein Zwischenprodukt der Chemischen Industrie.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
.svg.png.webp) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Maleinsäureanhydrid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C4H2O3 | ||||||||||||||||||
| Kurzbeschreibung |
weiße Schuppen mit durchdringendem, scharfem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 98,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Dichte |
0,93 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
202 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−469,8 kJ/mol[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Historisches Verfahren
Benzoloxidation
Bis zum Beginn der sechziger Jahre wurde Maleinsäureanhydrid ausschließlich durch die selektive katalytische Gasphasenoxidation von Benzol mit Luftsauerstoff bei Temperaturen von 400–450 °C und Drücken von 2–5 bar an Vanadiumpentoxid-Katalysatoren, welche zusätzlich mit Molybdäntrioxid oder Phosphorsäure modifiziert sein können, hergestellt.[7]
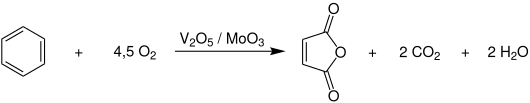
Die komplette Reaktion wird dabei in Rohrbündelreaktoren, bei denen die beträchtliche Reaktionswärme (ΔHR= −1875 kJ·mol−1) mithilfe von Salzschmelzen abgeführt und zur Erzeugung von überhitztem Hochdruckdampf genutzt wird, durchgeführt. Der Benzolumsatz beträgt 85–95 %, dabei wird jedoch nur eine Ausbeute von 60–75 % Maleinsäureanhydrid erreicht. Nachteilig ist außerdem, dass etwa ein Drittel des Benzols als Kohlenstoffdioxid verloren geht. Deshalb ist dieses Verfahren aufgrund der hohen und weiterhin ansteigenden Benzolpreise sowie der einzuhaltenden Emissionsgrenzwerte wirtschaftlich unattraktiv geworden.[7]
Aktuelle Verfahren
Butenoxidation
Aus diesem Nachteil wurde Anfang der sechziger Jahre ein verbessertes Verfahren zur Herstellung von Maleinsäureanhydrid entwickelt. Demnach geht man von butadienfreien C4-Fraktionen aus, die im Wesentlichen Isobuten und die isomeren Butene (But-1-en und But-2-en) enthalten. Dieses Gemisch wird danach mit Luftsauerstoff bei Temperaturen von 350–450 °C und Drücken von 2–5 bar ebenfalls an Vanadiumpentoxid-Katalysatoren, welche mit Oxiden von Titan, Molybdän oder Antimon modifiziert sein können und auf oberflächenarmen Trägern aufgebracht sind, umgesetzt.[7][8]
.svg.png.webp)
Auch hier verwendet man Rohrbündelreaktoren, bei denen die beträchtliche Reaktionsenthalpie (ΔHR= −1315 kJ·mol−1) mithilfe von Salzschmelzen abgeführt und zur Erzeugung von überhitztem Hochdruckdampf genutzt wird. Die Selektivität zu Maleinsäureanhydrid beträgt 45–60 % bezogen auf den oxidierbaren Butengehalt. Das gewünschte Produkt fällt nach zweistufiger Destillation in Leicht- und Schwersiederkolonnen in einer Reinheit von 99 % an. Wesentlich Nebenprodukte sind neben Kohlenstoffdioxid und Kohlenstoffmonoxid, auch Essig-, Acryl-, Fumar-, Croton- und Glyoxylsäure sowie Formaldehyd.[7]
Butanoxidation
Hinsichtlich des weiterhin ansteigenden Bedarfs an Maleinsäureanhydrid führte auch das neuere Butenoxidation-Verfahren aufgrund der geringen Selektivitäten zu einem unbefriedigenden Ergebnis. Angesichts dessen wurde Mitte der siebziger Jahre erstmals von Monsanto in den USA eine Oxidation von Butan als dem preiswertesten Einsatzmaterial für MSA entwickelt. Nach diesem Verfahren setzt man Butan mit Luftsauerstoff bei Temperaturen von 390–430 °C und leichtem Überdruck an Vanadylpyrophosphat-Katalysatoren [(VO2)2P2O7] in der Gasphase um.[3][7]
.svg.png.webp)
Die Reaktion kann hierbei analog zu den Vorgängervarianten in Rohrbündelreaktoren, sowie neuerdings auch in Wirbelschichtreaktoren durchgeführt werden. Der Umsatz an n-Butan beträgt 80–85 %. Damit wird eine Ausbeute an Maleinsäureanhydrid von 50–60 %, in neueren Verfahrensvariante auch 70–75 % erreicht.[3][7]
Es besteht eine Analogie zur Herstellung von Phthalsäureanhydrid: Während ältere Verfahren von Naphthalin ausgehen, verwenden moderne Verfahren o-Xylol.
Eigenschaften
Physikalische Eigenschaften
Maleinsäure bildet farblose, nadelförmige Kristalle, die bei 52,8 °C schmelzen.[9][10] Die molare Schmelzenthalpie beträgt 13,66 kJ·mol−1.[10] Die Verbindung siedet unter Normaldruck bei 202 °C.[2] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 3,79916, B = 1431,009 und C = −101.093 im Temperaturbereich von 317 bis 445 K.[11] Die molare Verdampfungsenthalpie beträgt 54,8 kJ·mol−1.[10][12]
Chemische Eigenschaften
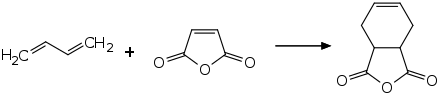
Maleinsäureanhydrid ist sehr reaktionsfreudig. Es hydrolysiert in Wasser zu Maleinsäure. Die Hydrolyse verläuft mit −34,9 kJ·mol−1 exotherm.[13] Mit Alkoholen werden die entsprechenden Monoester oder Diester gebildet.[9] Die Umsetzung mit Ammoniak oder Aminen führt zu den entsprechenden Monoamiden, welche unter Wasserabspaltung in die cyclischen Imide überführt werden können.[10] Wie für ungesättigte Verbindungen typisch geht Maleinsäureanhydrid leicht Additionsreaktionen an der Doppelbindung ein. Mit Halogenen können die entsprechenden Dihalogenbernsteinsäuren, Mono- oder Dihalogenmaleinsäuren bzw. deren Anhydride gewonnen werden.[10][9] Eine Hydrierung kann je nach Reaktionsbedingungen zum Bernsteinsäureanhydrid, 1,4-Butandiol, Tetrahydrofuran oder Butyrolacton führen.[10] In Diels-Alder-Reaktionen tritt es als reaktives Dienophil in Erscheinung. Die Umsetzung mit 1,3-Butadien führt zum 1,3,3a,4,7,7a‐Hexahydro‐2‐benzofuran‐1,3‐dion (Tetrahydrophthalsäureanhydrid). Diese Reaktion verläuft mit −263,6 kJ·mol−1 stark exotherm.[14]
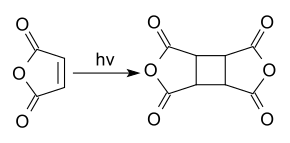
Photochemisch gelingt bei UV-Licht-Bestrahlung die Dimerisierung zum Cyclobutantetracarbonsäuredianhydrid.[15]
Die Verbindung kann auch in Homo- bzw. Copolymerisationen umgesetzt werden.[10] Die Polymerisationswärme beträgt −59 kJ·mol−1.[16]
Sicherheitstechnische Kenngrößen
Maleinsäureanhydrid bildet bei höheren Temperaturen entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 103 °C.[2][17] Der Explosionsbereich liegt zwischen 1,4 Vol.‑% (57 g/m3) als untere Explosionsgrenze (UEG) und 7,1 Vol.‑% (290 g/m3) als obere Explosionsgrenze (OEG).[2][17] Der untere Explosionspunkt beträgt 91 °C.[2] Die Zündtemperatur beträgt 380 °C.[2][17] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
Maleinsäureanhydrid ist ein industrielles Zwischenprodukt. Es dient vor allem der Herstellung ungesättigter Polyesterharze[3] sowie zur Synthese von Tensiden, Insektiziden, Herbiziden, Fungiziden, Wachstumsregulatoren (z. B. Maleinsäurehydrazid) und anderen chemischen Verbindungen. Ein Teil wird zu 1,4-Butandiol und zu Tetrahydrofuran reduziert.[3] Mit α-Olefinen lässt sich MSA zu streng alternierenden Copolymeren umsetzen, die als Schmiermittel große Bedeutung haben.
Gefahrenbewertung
Maleinsäureanhydrid wurde 2013 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Maleinsäureanhydrid waren die Besorgnisse bezüglich hoher (aggregierter) Tonnage und hohes Risikoverhältnis (Risk Characterisation Ratio, RCR) sowie der vermuteten Gefahren durch sensibilisierende Eigenschaften. Die Neubewertung fand ab 2013 statt und wurde von Österreich durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[18][19]
Weblinks
- International Chemical Safety Card (ICSC) für Maleic anhydride beim National Institute for Occupational Safety and Health (NIOSH)
Einzelnachweise
- Eintrag zu MALEIC ANHYDRIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. November 2021.
- Eintrag zu Maleinsäureanhydrid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 30. Juli 2019. (JavaScript erforderlich)
- Eintrag zu Maleinsäureanhydrid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 8. April 2014.
- Eintrag zu Maleic anhydride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 30. Juli 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 108-31-6 bzw. Maleinsäureanhydrid), abgerufen am 17. September 2019.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- Hans-Jürgen Arpe: Industrielle Organische Chemie - Bedeutende Vor- und Zwischenprodukte. 6. Auflage. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim 2007, ISBN 978-3-527-31540-6, S. 408 f.
- Manfred Baerns, Arno Behr, Axel Brehm, Jürgen Gmehling, Kai-Olaf Hinrichsen, Hanns Hofmann, Regina Palkovits, Ulfert Onken, Albert Renken: Technische Chemie. 2. Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany 2013, ISBN 978-3-527-33072-0, S. 603.
- Brockhaus ABC Chemie, 3. Auflage, F.A. Brockhausverlag Leipzig 1971, S. 836.
- K. Lohbeck, H. Haferkorn, W. Fuhrmann, N. Fedke: Maleic and Fumaric Acids. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim, 2012, doi:10.1002/14356007.a16_053.
- Stull, D.R.: Vapor Pressure of Pure Substances Organic Compounds in Ind. Eng. Chem. 39 (1947) 517–540, doi:10.1021/ie50448a022.
- Winstrom, L.O.; Kulp, L.: Vapor Pressure of Maleic Anhydride - Temperature Range from 35° to 77° in Ind. Eng. Chem. 41 (1949) 2584–2586, doi:10.1021/ie50479a044.
- Conn, J.B.; Kistiakowsky, G.B.; Roberts, R.M.; Smith, E.A.: Heats of organic reactions. XIII. Heats of hydrolysis of some acid anhydrides in J. Am. Chem. Soc. 64 (1942) 1747–1752, doi:10.1021/ja01260a001.
- Ghitau, M.; Ciopec, M.; Pintea, O.: Study on Diels-Alder reaction for the synthesis of tetrahydrophthalic anhydride in Rev. Chim. (Bucharest) 34 (1983) 299–305.
- Horie, T.; Sumino, M.; Tanaka, T.; Matsushita, Y.; Ichimura, T.; Yoshida, J.I.: Photodimerization of Maleic Anhydride in a Microreactor Without Clogging in Org. Process Res. Dev. 14 (2010) 405–410, doi:10.1021/op900306z.
- Bandrup, J.; Immergut, E.H.; Grulke, E.A.: Polymer Handbook, 4th Edition, Wiley & Sons Ltd. 2003, ISBN 978-0-471-47936-9, S. II/370.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Report und Conclusion Document.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Maleic anhydride, abgerufen am 26. März 2019.


