Chlordioxid
Chlordioxid ist eine chemische Verbindung aus Chlor und Sauerstoff mit der Summenformel ClO2. Die Schreibweise OClO wird anstatt ClO2 verwendet, wenn von der kurzlebigen Verbindung mit gleicher Summenformel Chlorperoxid, ClOO, unterschieden werden soll.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
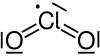 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Chlordioxid | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | ClO2 | ||||||||||||||||||
| Kurzbeschreibung |
gelblich-rötliches Gas mit scharfem, erstickendem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 67,46 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig[2] | ||||||||||||||||||
| Dichte |
3,01 g·l−1[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
11 °C (Zersetzung ab 45 °C)[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Bei Raumtemperatur ist Chlordioxid ein bernsteinfarbenes, giftiges Gas mit stechendem, chlorähnlichem Geruch. Gemische von Luft mit über 10 Vol.-% an Chlordioxid können explodieren. Es wird daher meist in wässriger Lösung verwendet, die nicht explosiv ist. Chlordioxid ist ein Radikal mit oxidierenden Eigenschaften.
Die Anwendungen von Chlordioxid beruhen auf seiner oxidativen Wirkung. Es wird oft anstelle von elementarem Chlor verwendet, da es weniger giftige oder gesundheitsschädliche chlorierte organische Verbindungen bei der Reaktion mit organischen Substanzen bildet. Als Bleichmittel der ECF-Bleiche (Elementar-Chlor-freie Bleiche) von Zellstoff, so zum Beispiel Papier, hat es elementares Chlor fast vollständig ersetzt. Auch in der Trinkwasseraufbereitung dient es zur Desinfektion anstelle von Chlor.
Der Nachweis von Chlordioxid in der Erdatmosphäre über der Antarktis im Jahr 1986 trug zur Entdeckung der Ursachen des Ozonlochs bei. Es ist eines der Chloroxide, die sich dort in der Stratosphäre aus den früher häufig als Treibgas oder Kältemittel verwendeten Fluorchlorkohlenwasserstoffen (FCKW) bilden und an der Zerstörung der Ozonschicht beteiligt sind.
Geschichte

Die Entdeckung von Chlordioxid wird generell Humphry Davy zugeschrieben, der es 1811 durch Disproportionierung (Aufspaltung) von Chlorsäure (HClO3) als erstes bekanntes Halogenoxid gewann.[10] In früheren Experimenten wurde Chlordioxid zwar hergestellt, jedoch aufgrund seiner Löslichkeit in Wasser nicht als Gas erhalten und deshalb weder isoliert noch als neue Verbindung erkannt. Davy merkte an, dass „das Gas beim Sammeln oft explodiert [ … unter] einer sofortigen Freisetzung von Hitze und Licht“ (H. Davy).[10] Chlor selbst wurde zu diesem Zeitpunkt noch als Oxymuriumsäure (oxymuric acid) bezeichnet, da es als Verbindung aus Sauerstoff und Salzsäure (der Muriumsäure) angesehen wurde, bevor Davy Chlor als ein Element erkannte. Heute wird vermutet, dass auch Davy kein reines Chlordioxid isolierte, sondern ein Gemisch aus Chlor und Chlordioxid, das er „Euchlorine“ (‚sehr gelb‘) nannte.[11][12]
Im Jahr 1921 beschrieben Erich Schmidt und Erich Graumann Chlordioxid als selektives Bleichmittel, das nicht mit Kohlenhydraten (Polysacchariden) reagiert und zum Abbau von Lignin bei Erhaltung von Cellulose verwendet werden kann:
- „Pflanzenteile von Inkrusten, z. B. Holz von Lignin, derart zu befreien, daß vollständig inkrusten-freie Kohlenhydrate, wie Cellulose und Hemi-cellulose, erhalten werden, gelang bisher nur unter gleichzeitigem Angriff der Polysaccharide. Entfernt man aber die inkrustierenden Substanzen mittels Chlordioxyde, so lassen sich inkrusten-freie und völlig unangegriffene Kohlenhydrate gewinnen, da auf diese Chlordioxyd nicht einwirkt“[13]
Der industrielle Einsatz zum Bleichen von Zellstoff begann über 20 Jahre später, kurz nach Ende des Zweiten Weltkriegs. Anfangs wurde Chlordioxid nur in der letzten Phase des Bleichens verwendet, später ersetzte es Chlor zunehmend in den früheren Phasen zum Abbau von Lignin, da dies die Qualität des Endprodukts verbesserte.[14]
In den 1990er Jahren nahm das Bewusstsein für die Problematik der chlorierten Abfallprodukte, insbesondere der sehr giftigen Dioxine,[15] beim Bleichen mit Chlor zu. Im Zuge dessen verdrängte Chlordioxid das Chlor mehr und mehr aus den Verfahren zur Zellstoffbleichung.
Durch zunehmende Verbote und Einschränkungen für Chlorbleichung und deren Abfallprodukte entwickelte es sich zum wichtigsten industriellen Bleichmittel. So waren im Jahr 2004 laut Greenpeace 82 % des „chlorfrei gebleichten“ Papiers zwar nicht mit elementarem Chlor gebleicht, allerdings mit Chlordioxid und/oder Chlorperoxid (Cl2O2) (siehe Abbildung zur Zellstoffproduktion im Abschnitt Bleichmittel).[16]
Herstellung
Weil Chlordioxid instabil ist und explodieren kann, wird es direkt vor der Verwendung am Einsatzort hergestellt. Die Darstellung geht entweder von Chlorit (ClO2−) oder von Chlorat (ClO3−) aus; dabei bestimmt die Anwendung, welche Ausgangssubstanz geeigneter ist.
Anwendungen, die große Mengen Chlordioxid benötigen, aber geringe Reinheitsansprüche haben, gehen von Natriumchlorat (NaClO3) aus. So verwenden alle großtechnischen Herstellungsverfahren für den Einsatz als Bleichmittel heutzutage Natriumchlorat als Ausgangsmaterial. Heutige Zellstofffabriken erreichen jeweils eine Produktion von über einer Million Tonnen Zellstoff pro Jahr, zu dessen Bleiche bis zu 40 Tonnen Chlordioxid pro Tag erzeugt werden. Bei diesem Verhältnis von Chlordioxid zu Zellstoff brauchte man 2005 etwa eine Million Tonnen Chlordioxid, um 70 Millionen Tonnen ECF-gebleichten Zellstoff herzustellen.
Für die Herstellung kleinerer bis mittlerer Mengen mit hohen Reinheitsanforderungen, wie der Trinkwasseraufbereitung, wird hauptsächlich Natriumchlorit (NaClO2) verwendet. Die Reaktionsbedingungen bei der Herstellung aus Chlorit sind einfacher zu kontrollieren, andererseits ist Natriumchlorit teurer und weniger stabil als Natriumchlorat und deshalb für großtechnische Anwendungen weniger geeignet. Es ist zwangsläufig teurer, wenn Natriumchlorit selbst durch Reduktion von Chlordioxid in alkalischer Lösung hergestellt wird:
Natriumchlorit hat dann die Funktion eines Zwischenspeichers, in dem Chlordioxid in eine leichter zu transportierende und zu lagernde Form überführt wird, wodurch gleichzeitig ein Endprodukt mit größerer Reinheit entsteht.
Technische Herstellung
Chlordioxid wird durch Reduktion von Chlorat mit einem geeigneten Reduktionsmittel in stark saurer Lösung erzeugt. Die Reduktion hat ein Standard-Redoxpotential E0 von 1,152 V:[17]
In den 1950er Jahren wurde als erstes großtechnisches Verfahren das Mathieson-Verfahren entwickelt, bei dem zur Reduktion Schwefeldioxid (SO2) eingesetzt wird:[14]
In der Reaktion wird Schwefelsäure im Überschuss eingesetzt, da der für die Reaktion benötigte stark saure pH-Wert beibehalten werden muss.[14] Da die Reaktion nur unter stark sauren Bedingungen abläuft, verbleibt bei diesem Prozess viel unverbrauchte Restsäure. Er erzeugt zudem als Nebenprodukt viel Natriumsulfat, das beim Sulfatverfahren zur Ergänzung der Natrium- und Schwefelverluste des Aufschlussprozesses für Zellstoff verwendet wird. Um die spontane Zersetzung oder Explosion des Chlordioxids zu vermeiden, die bei Raumtemperatur ab einem Partialdampfdruck von 10 kPa auftritt,[18] wird Luft durch die Reaktionsmischung geblasen. Das Gemisch aus Chlordioxid und Luft wird im Anschluss zur Lösung des ClO2 in gekühltes Wasser (8–10 °C) eingeleitet. Übliche Konzentrationen der gekühlten wässrigen Lösung liegen bei 8 g/l bis 10 g/l ClO2.
Die Variante der Reduktion mit Salzsäure ist kostengünstig, hat jedoch den Nachteil, dass als Nebenprodukt mehr Chlor entsteht. In der hier gezeigten Gleichung wird zudem die Salzsäure aus Schwefelsäure und Natriumchlorid (Kochsalz) hergestellt:
Daher wurde die Salzsäure in der Solvay-Variante durch den Einsatz von Methanol als Reduktionsmittel ersetzt:
Die direkte Reaktion von Methanol mit Chlorat zu Chlordioxid geht jedoch nur sehr langsam vonstatten. Als das tatsächlich aktive Reduktionsmittel wird auch hier das Chloridion gesehen, das aus einer Reaktion von Methanol mit Chlor gebildet wird. Sowohl Chlor als auch Chlorid-Anionen sind für die Reaktion unerlässlich. Ein kompletter Verbrauch aller Chloridionen führt zu einem als „white-out“ bezeichneten Stillstand der Reaktion, bis wieder Chlorid nachgebildet wird. Aus diesem Grund wird dem Reaktionsgemisch in einigen der Verfahren ständig eine geringe Menge an Chloridionien zugegeben.[17]
Die nach den Verfahren Mathieson und Solvay eingeführten Verfahren werden unter den Bezeichnungen R2 bis R10 geführt. Dabei handelt es sich jeweils um Weiterentwicklungen, bei denen durch Anpassung der Reaktionsbedingungen die Schwächen der früheren Verfahren vermieden werden sollen. Ziele der Optimierung sind dabei eine hohe Chlordioxid-Ausbeute, geringe Bildung von Chlor als Nebenprodukt und eine geringe Menge an zurückbleibender Restsäure und Salzen. Bei den meisten dieser neueren Verfahren wird das Chlordioxid unter reduziertem Druck laufend aus der Reaktionslösung entfernt und in Wasser gelöst, so zum Beispiel in den auf der Reduktion mit Methanol basierenden Varianten R8.SVP-MeOH, R9 und R10.[14] Das R8-Verfahren zielt bereits auf eine verringerte Menge an Restsäure und in der Reaktion gebildeten Salzen ab (52 % weniger als beim R3 Prozess, 66 % weniger als bei Solvay). Beim R9-Verfahren wird zusätzlich das zurückbleibende Natriumsulfat-Natriumhydrogensulfat-Gemisch elektrolytisch in Natriumhydroxid und Schwefelsäure aufgespalten, die wieder in den Prozess zurückgeführt werden, während beim R10-Verfahren neutrales Natriumsulfat durch Ausfällen unter Weiterverwendung der Säure entfernt wird.
Herstellungsverfahren in der Trinkwasseraufbereitung
In Deutschland regelt § 11 der Trinkwasserverordnung, sowie eine darin genannte Substanzliste des Bundesministeriums für Gesundheit,[19] welche Substanzen Trinkwasser zugesetzt werden dürfen und somit, welche Verfahren zur Trinkwasserdesinfektion zugelassen sind.
Die Liste führt zudem für Chlordioxid die Arbeitsblätter W 224 und W 624 des DVGW (Deutscher Verein des Gas- und Wasserfaches) auf. Die in den Arbeitsblättern beschriebenen Herstellverfahren werden zur Herstellung von Chlordioxid eingesetzt. Beschrieben sind dort das Peroxodisulfat-Chlorit-, das Salzsäure-Chlorit- und das Chlor-Chlorit-Verfahren für den Gebrauch zur Trinkwasseraufbereitung.
Im Chlor-Chlorit-Verfahren wird Chlorwasser mit saurem pH-Wert (< 2) mit 10 % Natriumchloritlösung zur Reaktion gebracht:[20]
Dabei wird Chlor immer im Überschuss eingesetzt, um zu verhindern, dass nicht umgesetztes Natriumchlorit im Wasser verbleibt.
Im Salzsäure-Chlorit-Verfahren wird Natriumchlorit mit Salzsäure zu Chlordioxid, Kochsalz und Wasser umgesetzt:
Bei der Reaktion mit Natriumperoxodisulfat entsteht Natriumsulfat als Nebenprodukt, das auch natürlich in Trinkwasser vorkommt:
Nachteil der genannten Verfahren ist die Tatsache, dass Gefahrstoffe in flüssiger (Salzsäure-Chlorit-Verfahren und Peroxodisulfat-Chlorit-Verfahren) oder gasförmiger Form (Chlor-Chlorit-Verfahren) eingesetzt werden und die Kinetik der genannten Reaktionen unterschiedlich ist. Während das Salzsäure-Chlorit-Verfahren zur sofortigen Chlordioxidbildung führt, benötigt das Peroxodisulfat-Chlorit-Verfahren ca. 24 Stunden, um die Sollkonzentration einzustellen. Gleichzeitig sind die notwendigen, stabilisierenden Gleichgewichte unterschiedlich ausgeprägt, sodass die Chlordioxid-Zubereitung aus dem Salzsäure-Chlorit-Verfahren innerhalb von 1 bis 4 Tagen zerfällt (Raumtemperatur, Lichtabschluss), während die Peroxodisulfat-Chlorit-Zubereitung unter gleichen Bedingungen bis zu 10 Tagen Stabilität aufweist. Weiterhin ist es gängige Praxis, vorgelegte Chlordioxid-Konzentratlösungen zur Stabilisierung zu kühlen, was ebenfalls einen Zusatzaufwand darstellt.
Seit 2013 ist ein Herstellungsverfahren verfügbar, das die genannten Nachteile umgeht. Dieses Verfahren wird über eine Einkomponenten-Feststoff-Mischung abgebildet. Die erforderlichen Einzelkomponenten sind hierbei inert verpresst, sodass eine Reaktion während der Lagerung unterbleibt (Lagerstabilität über 3 Jahre). Das Einkomponenten-Feststoff-Verfahren vereint die drei genannten Gleichgewichte in einem Prozess. Primär wird die Reaktion durch ein Säure-Chlorit-Gleichgewicht initiiert, es folgt die Reaktion mit Peroxodisulfat-Chlorit. Als Intermediat liegt noch ein Chlor-Chlorit-Gleichgewicht vor, das die Abbaukinetik verringert. Auf diese Weise wird einerseits eine volumenstromproportionale Zudosierung (Trinkwasser, Rohwasser) vereinfacht (da der natürliche Zerfall (Disproportionierung) reduziert wird), auf der anderen Seite wird die Arbeitssicherheit erhöht und der logistische Aufwand verringert. Die Handhabung wird durch vorkonfektionierte Darreichungsformen (z. B. Tabletten) weiter vereinfacht.
Das Verfahren führt zu einer sofortigen Chlordioxidbildung, gleichzeitig beträgt die Abbaukinetik bei Raumtemperatur und unter Lichtabschluss ca. 10 bis 15 % pro Monat. Dieses Verfahren ist gem. §11 der Trinkwasserverordnung für die Desinfektion von Trinkwasser in Deutschland nicht zugelassen.
Herstellung im Labormaßstab
Im Labormaßstab gewinnt man Chlordioxid ebenfalls durch Oxidation von Chlorit. Das Oxidationsmittel dafür ist entweder Natriumperoxodisulfat Na2S2O8 oder Chlorgas:
Alternativ kann man Chlordioxid auch durch Disproportionierung von Natriumchlorit in saurer Lösung gewinnen:
Eine andere Methode ist die Umsetzung von Kaliumchlorat mittels konzentrierter Schwefelsäure. Um die Explosionsgefahr zu verringern, wird Oxalsäure zugesetzt, wobei ein Chlordioxid-Kohlendioxid-Gemisch entsteht:[21]
Eine weitere Möglichkeit zur Herstellung moderater Mengen von Chlordioxid für die technische Nutzung ist die Reduktion von Chlorat durch Wasserstoffperoxid:
Durch Ansäuern mit Schwefelsäure wird die Redoxreaktion gestartet. Eine geeignete Mischung enthält 40 % Natriumchlorat und 8 % Wasserstoffperoxid, sie ist kommerziell verfügbar. Das entstehende Chlordioxid wird entweder mit Luft ausgetrieben und in kaltem Wasser gelöst oder es wird das Gemisch verdünnt und die stark saure Lösung direkt weiterverarbeitet. Obwohl die Reduktion von Chlorat mit Wasserstoffperoxid auch für große Anlagen geeignet ist, wird üblicherweise Methanol aufgrund der niedrigeren Kosten vorgezogen. In Kraftwerken mit Kühlturmbetrieb wird jedoch aufgrund der geringeren TOC-Werte meist Wasserstoffperoxid eingesetzt.
Eigenschaften

Molekulare Eigenschaften
Das Molekül ist aufgrund der freien Elektronenpaare am zentralen Chloratom gewinkelt aufgebaut, der Bindungswinkel beträgt 117°, die Cl–O-Bindungslänge 147 pm.[3] Da Chlor in Form von zwei verschiedenen Isotopen auf der Erde vorkommt (76 % 35Cl und 24 % 37Cl), haben einzelne Chlordioxidmoleküle die Masse von 67 u oder 69 u. Bindungswinkel und Bindungslänge als Eigenschaft der identischen Elektronenkonfiguration sind jedoch in beiden Fällen gleich.[22] Durch seine ungerade Anzahl von 19 Valenzelektronen ist das Molekül ein paramagnetisches Radikal. Unterhalb −59 °C kristallisiert Chlordioxid und es bilden sich Dimere (Molekül-Paare), wodurch Chlordioxid unterhalb von −84 °C diamagnetisch wird. Im Jahr 1933 schlug Lawrence Olin Brockway (1907–1979) eine Drei-Elektronen-Bindung vor.[23] Linus Pauling entwickelte diese Idee später zu einer Theorie weiter, bei der von einer schwächeren Bindung des dritten Elektrons ausgegangen wird.[24] Spätere Untersuchungen zeigten, dass das ungepaarte dritte Elektron das höchste besetzte Molekülorbital (HOMO) einnimmt.
Physikalische Eigenschaften
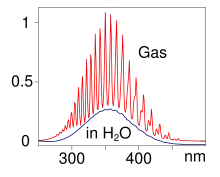
Chlordioxid ist 2,3-mal so schwer wie Luft. In Wasser gelöst besitzt es ein breites Absorptionsband bei einer Wellenlänge von 350 nm. Bei gasförmigem Chlordioxid werden mehrere Maxima aufgrund vibrationsgekoppelter Absorption sichtbar (siehe Abbildung des UV-Spektrums im Abschnitt Ozonloch).[25] Die für die Kopplung verantwortlichen Schwingungen wurden 1933 bestimmt und in Übereinstimmung mit einem erweiterten Franck-Condon-Prinzip gefunden.[26] Die spektroskopischen Eigenschaften erfuhren erneute Aufmerksamkeit zur Aufklärung der Vorgänge im Ozonloch.[27]
Beim Übergang in den festen Zustand unterhalb von −59 °C bildet es explosive orangerote Kristalle. Es kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Pbca (Raumgruppen-Nr. 61) mit den bei 198 K bestimmten Gitterparametern a = 1087 pm, b = 671 pm und c = 559 pm sowie acht Formeleinheiten pro Elementarzelle. In der Kristallstruktur liegen die Chlordioxid-Moleküle als Dimere (ClO2)2 vor. Die Dimerisierung erfolgt dabei über Cl···O-Kontakte zweier benachbarter ClO2-Moleküle, der Cl···O-Abstand beträgt 278 pm.[28]


Chemische Eigenschaften
Bei Temperaturen zwischen −59 °C und 11 °C ist Chlordioxid eine bernsteinfarbene, ölige Flüssigkeit, die oberhalb −40 °C instabil wird und zur Explosion neigt. Bei Standardtemperatur liegt es als Gas vor, das in Gemischen mit Luft von über 10 Vol.-% oder bei einem Partialdruck von über 76 mmHg (10 kPa; 0,1 atm) explosiv ist.[18][30] Als Mechanismus der Explosion von gasförmigem Chlordioxid wird eine Anhäufung von Radikalen in dem Gas angesehen, die aus Zwischenprodukten des langsamen Zerfalls von Chlordioxid entstehen. Die Radikale katalysieren den weiteren Zerfall, bis der Zerfall explosionsartig stattfindet.[18][31] Bei der Explosion zerfällt es in Chlor und Sauerstoff:[32]
Lösungen in Wasser sind gelb bis braungelb gefärbt und sind nicht explosiv, soweit sie kein Chlordioxid-Luft-Gemisch mit mehr als 10 Vol.-% Chlordioxid erzeugen können. Diese Grenze von 10 Vol.-% wird bei Normaldruck in etwa von Lösungen mit 6 g (30 °C) bis 13 g (10 °C) Chlordioxid pro Liter Wasser erreicht (Siehe Abbildung).[29] Bei niedrigen Temperaturen kristallisieren aus wässrigen Lösungen Clathrate, bei denen das Gas zusammen mit dem Wasser kristallisiert und in Hohlräumen des Kristalls eingeschlossen ist. Die gebildeten Gashydrate haben die Summenformel ClO2 · n H2O (n ≈ 6–10).[33]
Chlordioxid und seine wässrige Lösungen wirken stark oxidierend. Abhängig vom Reduktionspartner entstehen Chloride (Cl−), Chlorite (ClO2−) oder Hypochlorite (OCl−). Eine Oxidation von ClO2 ist mit noch stärkeren Oxidationsmitteln ebenfalls möglich, unter anderem mit Fluor (F2), Ozon (O3) und rauchender Schwefelsäure.[3]
Chlordioxid ist bei neutralen und sauren pH-Werten relativ unempfindlich gegen Hydrolyse (Aufspaltung durch Wasser). Bei pH-Werten über 10 setzt jedoch bereits erhebliche Disproportionierung (Reaktion mit sich selbst) ein, die je nach pH-Wert zu Chlorat-/Chloridbildung oder Chlorat-/Chloritbildungen führen.[34]
Beim Einbringen von ClO2 in stark alkalische Lösungen läuft diese Reaktion stürmisch ab. Auch die Einwirkung von Licht führt zu einer Zersetzung.[3]
Verwendung
Als Bleichmittel wird Chlordioxid in der Textil- und Zellstoffindustrie verwendet und hat dort Chlor weitgehend ersetzt.[30] Weiterhin wurde es zum Bleichen von Mehl beziehungsweise Stärke, Schmiermitteln, Salben und Wachs verwendet. So war es in Deutschland als Lebensmittelzusatzstoff bis 1957 zum Bleichen von Mehl zugelassen,[35] aus gesundheitlichen Gründen ist es heutzutage aber nicht mehr zur Behandlung von Lebensmitteln erlaubt. Es kann ferner zum Bleichen von Textilfasern verwendet werden, dort wird jedoch meistens Wasserstoffperoxid sowie in Ländern ohne strenge Umweltauflagen Chlor verwendet.
Als Desinfektionsmittel eingesetzt hat es vor allem bei der Trinkwasserdesinfektion Bedeutung, wird aber auch zur Desinfektion von Abwässern sowie zur Schimmelbekämpfung eingesetzt. Bei den Anthrax-Anschlägen im Jahr 2001 wurde es in einem Fall zur Gebäudedesinfektion eingesetzt.
Blutkonserven dagegen werden nicht mittels ClO2 (oder anderen Konservierungsstoffen) haltbar gemacht.[36]
Im Labor findet Chlordioxid Verwendung bei der Herstellung von Chloriger Säure. In der organischen Chemie kann es als Oxidationsmittel eingesetzt werden, zum Beispiel um Sulfide und Thioether in Sulfoxide zu überführen.
Zellstoffbleichung
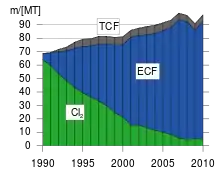
Bei der Zellstoffbleichung hat Chlordioxid das Bleichen mit Chlor fast vollständig verdrängt. Abhängig vom Entwicklungsgrad und dem Umweltbewusstsein wird in einigen Ländern kein Chlor mehr zur Bleiche verwendet. So wird in Skandinavien seit 1994 kein Chlor mehr zur Zellstoffbleiche eingesetzt. Dies geschah, nachdem chlorierte Kohlenwasserstoffe, darunter die giftigen Dioxine, in Abwässern der Chlorbleiche nachgewiesen wurden. Die Chlorbleiche wurde deshalb durch (Elementar-Chlor-Freie) ECF-Bleichen oder (Total-Chlor-Freie) TCF-Bleichen ersetzt. Die ECF-Bleichen verwenden statt elementarem Chlor (Cl2) als Oxidationsmittel chlorhaltige Verbindungen, meistens Chlordioxid. Die TCF-Bleichen basieren hingegen auf der bleichenden Wirkung von chlorfreien Oxidationsmitteln auf Sauerstoffbasis wie Sauerstoff (O2), Wasserstoffperoxid (H2O2) oder Ozon (O3). Darunter ist jedoch zum Beispiel Ozon nur bedingt für die Zellstoffbleiche geeignet, da es zu reaktiv ist und auch die Zellulose angreift.
Im Bleichprozess werden Abbauprodukte von Lignin aus dem Sulfatverfahren oder Sulfitverfahren, Restlignin sowie Farbstoffe im Zellstoff entfärbt und oxidativ abgebaut. Die Verdrängung von Chlor ist darauf zurückzuführen, dass Chlordioxid im Gegensatz zu elementarem Chlor nur als Oxidationsmittel, nicht aber chlorierend wirkt. Im Reaktionsgemisch entstehen jedoch auch immer etwas Hypochlorige Säure und elementares Chlor. Dies führt, wie beim Bleichen mit Chlor selbst, zur Bildung von chlorierten Kohlenwasserstoffen. Der Verlauf und Mechanismus der Oxidation aromatischer Kohlenwasserstoffe mit Chlordioxid hängt vom pH-Wert des Reaktionsgemisches ab. Normalerweise ist die Konzentration von Hypochloriger Säure und elementarem Chlor sehr niedrig und beide Substanzen werden schnell abgebaut, sodass sie in Filtraten der Bleichlösung nicht mehr nachweisbar sind. Die Bildung chlororganischer Verbindungen wird durch viele Faktoren beeinflusst und kann durch Verwendung geringerer Chlordioxid-Gaben, sowie durch die Zugabe von Dimethylsulfoxid oder Amidosulfonsäure verringert werden. Abwässer von ECF-gebleichten Hölzern enthalten jedoch immer noch Chloroform und andere chlorierte Kohlenwasserstoffe und stellen somit weiterhin ein Umweltrisiko dar. Einer Schätzung von 1999 zufolge, sollte sich jedoch beim Ersatz von elementarem Chlor durch ECF-Verfahren nach damaligen Daten der Chloroformausstoß auf 3 % reduzieren lassen.[14] Die Gesamtmenge gebildeter chlorierter Kohlenwasserstoffe wird bei Chlordioxid als etwa fünf Mal geringer als bei Chlor angegeben.[14]
Lebensmittel
Chlordioxid wurde bis 1957 in der EU als Bleichmittel für Mehl[35] und Nussschalen und wird zur Entkeimung von Trinkwasser eingesetzt.[37][38] Chlordioxid ist aus gesundheitlichen Gründen[39] (z. B. wegen schwerer Nierenschäden bei Tierversuchen)[35] in der EU kein zugelassener Lebensmittelzusatzstoff, hat keine E-Nummer und ist entsprechend in der europäischen Liste der Lebensmittelzusatzstoffe nicht aufgeführt. Außerhalb der EU, wo Chlordioxid weiterhin als Mehlbehandlungsmittel oder Konservierungsmittel eingesetzt werden darf, hat es die INS-Nummer 926.
In den USA wird Chlordioxid als antimikrobielle Substanz zur Behandlung von Geflügel, rotem Fleisch, Fisch und Meeresfrüchten sowie Obst und Gemüse[40] eingesetzt. Dies geschieht durch ein äußerliches Waschen der Lebensmittel mit einer Lösung von Chlordioxid in Wasser, typischerweise in Konzentrationen von 50-1200 ppm (entspricht 0,05 bis 0,12 %). Die Anwendung zur Desinfektion von Geflügel in der Europäischen Union wurde diskutiert, jedoch 2008 vom Ministerrat der Europäischen Union abgelehnt.[41] Die EU untersagte 1997 die Einfuhr solcher Geflügelteile.[42] Im Januar 2009 reichten die USA eine Klage vor dem Dispute Settlement Body der WTO ein, da weder die EU-Kommission noch die Mitgliedstaaten eine seriöse, auf wissenschaftliche Erkenntnisse gestützte Begründung für das Verbot vorgelegt hätten.[43][44] In deutschsprachigen Medienberichten über Beziehungen zwischen EU und USA werden so behandelte Hühnerteile mit „Chlorhuhn“, „Chlorhühnchen“ oder „Chlorhähnchen“ bezeichnet. Nach Einschätzung der EFSA bietet die Desinfektion von Geflügelfleisch mit Chlordioxid unter den vorgeschlagenen Anwendungsbedingungen keinen Anlass zu Sicherheitsbedenken.[45] Das Bundesinstitut für Risikobewertung vertritt die Auffassung, dass mit Chlordioxid behandeltes Hähnchenfleisch für den Verbraucher nicht gesundheitsschädlich ist und in Sachen Keimfreiheit sogar Vorteile bringt.[46]
Trink- und Abwasserdesinfektion
Chlordioxid findet Verwendung bei der Trinkwasserdesinfektion, in der es Chlor in einzelnen Ländern weitgehend ersetzt hat. In Deutschland ist es nach § 11 der Trinkwasserverordnung[19] für die Trinkwasseraufbereitung zugelassen, mit Anweisung und in Abstimmung mit dem Gesundheitsamt. Zudem müssen vor einem Einsatz Verbraucher durch Rundfunk oder Presse vorab informiert werden.[36]
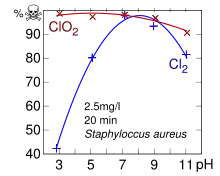
Es ist gegen Bakterien genauso oder besser wirksam als Chlor[47] und, im Gegensatz zu Chlor, auch gegen Viren und viele Protozoen (Einzeller) wirksam. Im Vergleich zu Chlor hat es den Vorteil, aus organischem Material deutlich weniger chlorierte Kohlenwasserstoffe zu bilden. Das alternativ eingesetzte Ozon (O3) kann hingegen mit natürlich im Wasser vorkommenden Bromiden reagieren und daraus krebserregende Bromate bilden. Bei dem schwächeren Oxidationsmittel Chlordioxid findet diese Reaktion nicht statt.[48]
In Deutschland und den USA setzten im Jahre 1998 etwa 10 % der Wasserwerke Chlordioxid ein, Italien in 30 %.[49] Als Höchstwert für das im Wasser gebildete Chlorit nach der Desinfektion gelten in Deutschland und der Schweiz 0,2 mg pro Liter.[19][50] In Deutschland ist die höchste zugelassene Konzentration nach der Desinfektion für Chlordioxid ebenfalls 0,2 mg/l, in der Schweiz beträgt sie 0,05 mg/kg. Empfohlen wird eine Konzentration von 0,05 mg/l.[36]
Chlordioxid wird zudem zur Verbesserung des Geschmacks und Geruchs von Trinkwasser verwendet, wenn diese durch Restverunreinigungen von Algen oder verrottenden Pflanzen unbefriedigend sind. Auch gegen übelriechende phenolische Verunreinigungen ist Chlordioxid aktiv, da es Phenole ähnlich wie bei der Zellstoffbleiche oxidativ abbaut.[51]
Chlordioxid wird auch zur Desodorierung übelriechender Abfälle und Abwässer verwendet. Für Letzteres ist es geeignet, da es im Vergleich zu Chlor hauptsächlich oxidierend wirkt,[52] wodurch mengenmäßig weniger persistente Organochlorverbindungen entstehen, und über einen weiteren pH-Bereich seine Wirksamkeit beibehält. Dies ist auch bei der Trinkwasserdesinfektion ein entscheidender Faktor, da in gechlortem Trinkwasser Chloroform, Dichloressigsäure oder Trichloressigsäure nachgewiesen wurde.[53][54]
Desinfektionsmittel

Chlordioxid kann zur Desinfektion von Gebäuden eingesetzt werden, da es eine breite Wirksamkeit gegen Mikroorganismen besitzt und als Gas auch ansonsten unzugängliche Stellen erreicht. Es ist seit 1988 in den USA von der Environmental Protection Agency EPA zur Desinfektion von Laborgeräten, Werkzeugen und Raumoberflächen zugelassen.[55] Durch seine fungizide Wirkung bietet es sich auch für die Bekämpfung von Schimmel an. So wurde 1991 durch Versprühen einer zweiprozentigen Lösung der Schimmelbefall in einer Bibliothek für Jahre gestoppt, der sonst besonders bei Ausfall des Lüftungssystems merklich auftrat.[56]
Im Jahr 2002 wurde eine Firma durch Artikel in der New York Times bekannt, die sich auf die Desinfektion ganzer Häuser durch Fluten mit dem Gas Chlordioxid spezialisiert hatte. Nach Kontamination mit Anthrax (Milzbrand) wurde im Jahr 2007 ein Bürogebäude (das Hart Senate Office) im Kapitol mit Chlordioxid desinfiziert[55][57] und nach dem Hurrikan Katrina wurde ein Restaurantgebäude in New Orleans nach der Überschwemmung mit Chlordioxid geflutet, um Schimmelpilze und Sporen abzutöten.[58][59]
Zunehmend wird Chlordioxid auch zur Desinfektion vor der Abfüllung von PET-Flaschen verwendet.[60] Dabei dürfen, ähnlich wie bei Trinkwasser, die Grenzwerte für Chlorit durch in der Flasche verbleibende Reste der Desinfektionslösung nicht überschritten werden.
Da bei der Verwendung von Chlordioxid als Desinfektionsmittel in Schwimmbädern zu hohe Gehalte an Chlorit (über 1 mg/l) im Wasser gefunden wurden, wird in Deutschland ClO2 nicht mehr eingesetzt.[61] Heutzutage wird das Wasser in öffentlichen Bädern durch Chlorgas, Natriumhypochlorit oder Calciumhypochlorit desinfiziert, womit zugleich auch eine Depotwirkung im Schwimmbecken sichergestellt wird.[62]
Missbräuchliche Verwendung
Eine „trinkfertige“ 0,3%ige Chlordioxidlösung mit zahlreichen angeblich gesundheitsfördernden Eigenschaften wird als CDL (auch CDS für chlorine dioxide solution) vermarktet. CDL soll analog wie MMS zur Therapie oder Prävention diverser Erkrankungen (z. B. Krebs, Diabetes, Hepatitis, Multipler Sklerose, Alzheimer, AIDS, Malaria, Potenzprobleme), vermeintlicher Erkrankungen (Autismus; dort in Form von Einläufen bei Kindern)[63] oder der Bekämpfung von Krankheitserregern (Pilzen, Viren, Bakterien, Parasiten) dienen.[64] Reputable Nachweise existieren hierfür nicht.
Die verkaufte Chlordioxidlösung überschreitet 10.000-fach den gesetzlich zugelassenen Höchstwert an ClO2 in Wasser.[36] Es ist kein zugelassenes Arzneimittel, mehrere Behörden warnen vor der Einnahme, sie ist gesundheitsschädlich.[65][66][67][36] So wurde nach einer CDL-Einnahme u. a. von Übelkeit, Erbrechen, Durchfall, Nierenversagen, Darmschädigungen und Blutdruckabfall berichtet.[68][65] Vor einer Chlordioxid-Behandlungen bei Kindern oder Säuglingen wird ausdrücklich gewarnt, so rät die Deutsche Gesellschaft für Kinder- und Jugendmedizin „nachdrücklich und klar von einer Einnahme ab“; zudem kann sie (sorge)rechtliche Konsequenzen nach sich ziehen.[65]
Auch eine angebliche Wirkung gegen SARS-CoV-2 bei Einnahme von Chlordioxid ist eine Falschinformation. Im Gegenteil, solche Lösungen sind gesundheitsschädlich und ätzend und können zu massiven Schädigungen führen.[67] In mehreren Ländern wie Bolivien, den USA, Österreich[69] oder Argentinien[70] führte die Einnahme, auch zur vermeintlichen Prophylaxe gegen COVID-19, zu Vergiftungen und Todesfällen. Das bolivianische Gesundheitsministerium lehnte die Einnahme ausdrücklich ab: „Diese Substanz ist hochgefährlich und kann ernste gesundheitliche Probleme verursachen.“[71][72]
Die in anderen Ländern wie Ungarn angebotenen, früher irreführend als Medizinprodukte beworbenen Mittel wie chlordioxidhaltige Zahnbleichlösungen gelten mittlerweile als zulassungspflichtige Arzneimittel (topisches Desinfektionsmittel) und wurden vom Markt zurückgezogen.[36]
Nachweis
Nachweise von Chlordioxid beruhen meist entweder auf seinen spektroskopischen Eigenschaften oder seiner Reaktivität. Als einfache spektroskopische Nachweismethode bietet sich die Messung der Lichtabsorption bei 350 nm an, die insbesondere bei der Detektion in der Atmosphäre bei der Erforschung des Ozonlochs zum Einsatz kam (siehe Abschnitt Ozonloch und das darin abgebildete Absorptionsspektrum).
In Trinkwasser ist der spektroskopische Nachweis am gängigsten, da er am einfachsten automatisiert werden kann.[73] Direkte Methoden detektieren dazu Chlordioxid entweder bei 360 nm oder im Bereich 320–400 nm. Weitaus häufiger publiziert wurden jedoch Messmethoden, die die Bleichung eines Farbstoffs durch Reaktion mit Chlordioxid verfolgen. Als Farbstoffe verwendet werden Chlorphenolrot, Rhodamin, Amaranth oder Neutralrot. Die Messungen lassen sich des Weiteren nach der Entnahmetechnik unterscheiden. Entweder wird eine Probe mit einem bestimmten Volumen entnommen und analysiert, oder die Messung geschieht als Fließinjektionsanalyse, bei der hinter einer Zugabestelle die Reaktion nach einem konstanten Zeitintervall im Fluss beobachtet wird. Seltener als die Analyse der Absorption wird auch das Verschwinden der Fluoreszenz von Farbstoffen bei Reaktion mit Chlordioxid verwendet, unter anderem von Fluorescein oder Rhodamin S. Der Vorteil des Nachweises durch Fluoreszenz ist, dass die Absorption anderer Substanzen die Messung weniger stören kann.
Die Konzentration von Chlordioxid kann auch iodometrisch bestimmt werden. Bei der Bestimmung in Trinkwasser wird dann ebenfalls die Entstehung von Iod aus dem zugegebenen Iodid spektrometrisch gemessen. Ein Nachweis von Chlordioxid alleine neben Chlor, Hypochloriger Säure, Hypochloriten, Chloraminen, Chloriten und Chloraten ist so jedoch schwierig.[74] Soll Chlordioxid neben anderen oxidierenden (zum Beispiel Eisen-) Salzen nachgewiesen werden, so kann es durch Einblasen von Luft und Einleiten in kaltes Wasser in eine Lösung ohne diese Störsalze überführt werden.
Ozonloch

In der Stratosphäre wird Chlordioxid aus Chlormonoxid (ClO) gebildet, meist mit Hilfe von Brommonoxid, das sich danach durch Reaktion des entstandenen Bromradikals mit Ozon zurückbildet:
Die Schreibweise OClO anstatt ClO2 wird im Zusammenhang mit Reaktionen in der Atmosphäre verwendet, um Chlordioxid von seinem instabilen Isomer Chlorperoxid, ClOO zu unterscheiden. In einem Peroxid sind die beiden Sauerstoffatome miteinander verbunden, wie in der Schreibweise ClOO angedeutet. Chlorperoxid entsteht ebenfalls bei den Reaktionen von Chlorradikalen in der Atmosphäre, zerfällt jedoch in weniger als einer Nanosekunde wieder.[75]
Die Rolle von Chlordioxid für die Entdeckung des Ozonlochs beruht auf seiner Absorption bei 350 nm. Gasförmiges Chlordioxid zeigt kein einzelnes, breites Absorptionsband, sondern es sind viele (etwa 20) Absorptionsspitzen einzeln zu erkennen (siehe Bild). Susan Solomon und ihre Mitarbeiter bestimmten 1986 in der Antarktis durch Messungen der Lichtabsorption vom Boden aus die Chlordioxid-Konzentration der Atmosphäre. Sie verwendeten dazu Mondlicht in der Nacht und gestreutes Sonnenlicht am Tag sowie während der Dämmerung.[76] Das dabei verwendete Spektrometer konnte nur Wellenlängen über 400 nm messen und deshalb nur die weniger intensiven Absorptionsspitzen zwischen 400 nm und 450 nm nutzen. Sie konnten aus den gemessenen Werten die Konzentration von Chlormonoxid abschätzen, von dem bekannt war, dass es eine tragende Rolle bei dem Abbau von Ozon und dem dadurch erzeugten Ozonloch spielt.[77]
Einer der Ozon-Abbauzyklen verläuft über eine Chlordioxid-Zwischenstufe, über die Chlorradikale aus Chlormonoxid zurückgewonnen werden. Nach anfänglichen Unsicherheiten über die relative Bedeutung der Abbauzyklen wird dieser Abbauzyklus inzwischen für etwa 75 % des Ozonabbaus verantwortlich gemacht.[77][78]
- Gesamtbilanz:
- Mit M=O2 oder M=O2+N2
Auf der Erdoberfläche freigesetztes Chlordioxid selbst hat jedoch keinen oder nur einen sehr geringen Einfluss auf die Bildung des Ozonlochs, da es in der Luft durch Sonnenlicht in kürzester Zeit zu Chlorit und Chlorat zerfällt, die dann mit Regen zurück auf die Oberfläche gelangen, wo sie reduziert werden:
Mitverursacher des Ozonlochs sind jedoch flüchtige chlorierte Kohlenwasserstoffe (z. B. Chloroform), wie sie bei der Zellstoffbleiche entstehen (siehe Abschnitt Zellstoffbleichung).
Toxikologie
Die Einstufung „Sehr Giftig“ (T+) der Substanz ist auf ihre Giftigkeit beim Einatmen zurückzuführen. So soll die Inhalation von 19 ppm Chlordioxid in der Luft über einen unbestimmten Zeitraum während eines Betriebsunfalls in einem Tank zum Tod eines Betroffenen geführt haben.[79][80] Die maximale Arbeitsplatz-Konzentration in der Atemluft beträgt 0,1 ml/m3, das entspricht 0,1 ppm. Dies ist auch der meist angegebene Wert für die Wahrnehmbarkeitsgrenze des stechenden, chlorähnlichen Geruchs von Chlordioxid. Das Gas ist somit selbst-warnend.[81] Dieser Wert ist ähnlich dem von Chlor, dessen Geruchsgrenze, abhängig vom individuellen Geruchssinn, mit 0,2 bis 3,5 ppm angegeben wird.[82]
Für die Langzeit-Giftigkeit von Chlordioxid in Trinkwasser müssen auch immer Chlorit (ClO2−) und Chlorat (ClO3−) in Betracht gezogen werden, da Chlordioxid bei geeigneten Bedingungen in diese umgewandelt werden kann. Die Einwirkung von UV-Licht katalysiert den Zerfall von Chlordioxid zu Chlorit und Chlorat:
Chlorit kann ebenfalls als Produkt bei der Oxidation anderer Substanzen entstehen, zudem wird Chlordioxid durch Ansäuern von Chloritlösungen hergestellt. Für die Behandlung von Trinkwasser mit Chlordioxid werden in den USA weitaus höhere Dosen verwendet. Dort werden, anders als in Europa, organische Bestandteile nicht zuerst durch Aktivkohlefilter entfernt, weshalb eine höhere Konzentration an Chlordioxid zur Desinfektion nötig wird.[83]
Höhere Organismen sind relativ unempfindlich gegen die Aufnahme von Chlordioxid durch Verschlucken. So wurden zum Beispiel in einer Studie am Menschen bei der einmaligen Einnahme von 24 mg Chlordioxid in einem Liter beziehungsweise 2,5 mg Chlorit in 500 ml Wasser bei zehn gesunden Männern keine negativen Veränderungen festgestellt.[80] Das ist um Faktor zwanzig beziehungsweise hundert höher als die Höchstwerte zur Trinkwasseraufbereitung in Deutschland von 0,2 mg auf einen Liter Trinkwasser. Diese Unempfindlichkeit bei oraler Einnahme von Chlordioxid ist wahrscheinlich auf eine rasche Deaktivierung durch Reaktion mit Substanzen im Magen zurückzuführen. In einer Studie an Äthiopischen Grünmeerkatzen konnten bei einer Gabe von 1,8 mg Chlordioxid (30 ml, 60 mg·l−1) und sofortiger Rückgewinnung der Magenflüssigkeit innerhalb von 5 Minuten nur noch 8 % der ursprünglichen Oxidationswirkung des zugegebenen Chlordioxid durch Titration festgestellt werden, der Rest war durch Reaktion mit den Magensäften unwirksam geworden. Bereits verdünnter Speichel der Affen deaktivierte innerhalb einer Minute Chlordioxid im Reagenzglas in der Größenordnung von 0,15 mg (zu 95 % deaktiviert) bis 1,5 mg (zu 88 % deaktiviert) Chlordioxid auf einen Milliliter Speichel.[84]
In Organismen reagiert Chlordioxid leicht mit den Aminosäuren Cystein und Tryptophan sowie freien Fettsäuren.[81][85] In einer Studie reagierte es jedoch kaum beziehungsweise nur langsam mit (viraler) RNA[86][87] oder der DNA von Sporen, wesentlich langsamer, als diese abgetötet wurden.[88]
Die antivirale Aktivität konnte in einigen Fällen auf eine Abtrennung der viralen RNA vom Kapsid, der Proteinhülle des Virus, zurückgeführt werden.[89][90] Während Chlordioxid gegen Viren, Bakterien, Sporen, Schimmelpilze und sogar Prionen wirksam ist,[81] zeigen einige Typen der sich langsamer vermehrenden Mykobakterien eine hohe Resistenz.[91]
Literatur
- H. Sixta: Handbook of Pulp. VCH-Wiley, Weinheim 2006, ISBN 3-527-30999-3, S. 741–742 (englisch).
- Stefan Wilhelm: Wasseraufbereitung: Chemie und chemische Verfahrenstechnik. 7. Auflage. Springer Verlag, ISBN 978-3-540-25163-7, S. 252–253, doi:10.1007/978-3-540-68887-7, eingeschränkte Vorschau in der Google-Buchsuche.
- Seymour Stanton Block: Disinfection, sterilization, and preservation. Lippincott Williams & Wilkins, 2001, ISBN 0-683-30740-1, S. 215 ff.
Weblinks
- Wolfgang Roeske: Die Desinfektion von Trinkwasser mit Chlor und Chlordioxid. Wasser, Luft und Boden · Zeitschrift für Umwelttechnik, Sonderdruck aus Ausgabe 7–8/1998.
- Greenpeace: Chronologie der Chlorfrei-Kampagne vom 29. März 2004.
- Versuch 24: Darstellung von Chlordioxid. (Memento vom 4. März 2018 im Internet Archive).
- Sigrid März: Darum geht es bei Chlordioxid und MMS. In: MedWatch. 15. November 2021, abgerufen am 21. November 2021.
Einzelnachweise
- Eintrag zu CHLORINE DIOXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 20. November 2021.
- Eintrag zu Chlordioxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 13. Mai 2020. (JavaScript erforderlich)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 482–485.
- Eintrag zu Chlordioxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Mai 2020.
- Eintrag zu Chlorine dioxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 13. Mai 2020. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 10049-04-4 bzw. Chlordioxid), abgerufen am 13. Mai 2020.
- S. Gangolli: The Dictionary of Substances and Their Effects. Royal Society of Chemistry, 1999, ISBN 0-85404-813-8.
- Mohamed S. Abdel-Rahman, Sammy E. Gerges, Howard Alliger: Toxicity of alcide. In: Journal of Applied Toxicology, 1982, 2 (3), S. 160–164, doi:10.1002/jat.2550020308.
- T. Dalhamn: Chlorine Dioxide: Toxicity in animal experiments and industrial risks. In: Archives of Industrial Health, 1957, 15, S. 101–107, PMID 13393816.
- H. Davy: On a combination of oxymuriatic gas and oxygen gas. In: Phil. Trans. Royal Society, London 1811, S. 155–162, doi:10.1098/rspl.1800.0221.
- J. R. Partington: Letters to Editor: Euchlorine. Nature 132, 1933, S. 714, doi:10.1038/132714b0.
- Alois Wehrle: Geschichte der Salzsäure. Carl Gerold, Wien 1819, S. 31 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- Erich Schmidt, Erich Graumann: Zur Kenntnis pflanzlicher Inkrusten. I. Mitteilung: Methode zur Reindarstellung pflanzlicher Skelettsubstanzen (I.). In: Berichte der deutschen chemischen Gesellschaft, 1921, 54 (8), S. 1860–1873, doi:10.1002/cber.19210540819.
- H. Sixta: Handbook of Pulp. VCH-Wiley, Weinheim 2006, ISBN 3-527-30999-3, S. 734–777.
- Lars Renberg, Nils G. Johansson, Christian Blom: Destruction of PCDD and PCDF in bleached pulp by chlorine dioxide treatment. In: Chemosphere, 1995, 30 (9), S. 1805–1811, doi:10.1016/0045-6535(95)00068-J.
- Woran erkennt man umweltfreundliches Papier. Artikel auf greenpeace.de vom 1. Juni 2004, abgerufen am 13. Mai 2020.
- Bal Raj Deshwal, Hyung Keun Lee: Manufacture of Chlorine Dioxide from Sodium Chlorate: State of the Art. In: Journal of Industrial and Engineering Chemistry, 2005, 11 (3), S. 330–346, Abstract, PDF; 5,9 MB.
- Ri Ya Jin, Shuang Qi Hu, Ying Hao Zhang and Tao Bo: Research on the explosion characteristics of chlorine dioxide gas. In: Chinese Chemical Letters. 2008, 19 (11), S. 1375–1378, doi:10.1016/j.cclet.2008.09.001.
- (I) Bekanntmachung des Bundesministeriums für Gesundheit: Liste der Aufbereitungsstoffe und Desinfektionsverfahren gemäß § 11 Trinkwasserverordnung 2001. Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz 2002, 45 (10), doi:10.1007/s00103-002-0474-4, Substanzliste, auf die die Trinkwasserverordnung verweist.
(II) Bekanntmachung des Bundesministeriums für Gesundheit: 7. Änderungsmitteilung zur Liste1 der Aufbereitungsstoffe und Desinfektionsverfahren gemäß § 11 Trinkwasserverordnung 2001. Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz 2007, 50 (8), doi:10.1007/s00103-007-0291-x. - Stefan Wilhelm: Wasseraufbereitung: Chemie und chemische Verfahrenstechnik. 7. Auflage. Springer Verlag, ISBN 978-3-540-25163-7, S. 252–253, doi:10.1007/978-3-540-68887-7, eingeschränkte Vorschau in der Google-Buchsuche.
- G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. 2nd ed., Vol. 1, Academic Press 1963, ISBN 0-12-126601-X, S. 301–303.
- Kazuhiro Miyazaki, Masazumi Tanoura, Keiichi Tanaka, Takehiko Tanaka: Microwave spectrum of chlorine dioxide in excited vibrational states. Journal of Molecular Spectroscopy, 1986, 116(2), S. 435–449, doi:10.1016/0022-2852(86)90138-4.
- L. O. Brockway: The Three-Electron Bond in Chlorine Dioxide. In: Proc. Natl. Acad. Sci. U.S.A., 1933, 19 (3), S. 303–307, PMID 16577512, PMC 1085967 (freier Volltext).
- Linus Pauling: General chemistry. Dover Publications, Inc, Mineola, NY 1988, ISBN 0-486-65622-5.
- H. Kromming, J. Orphala, P. Spietza, S. Voigta, J. P. Burrowsa: New measurements of OClO absorption cross-sections in the 325–435 nm region and their temperature dependence between 213 and 293 K. In: Journal of Photochemistry and Photobiology A: Chemistry, 2003, 157 (2–3), S. 149–160, doi:10.1016/S1010-6030(03)00071-6.
- Z. W. Ku: The Absorption Spectrum of Chlorine Dioxide. In: Phys. Rev., 1933, 44, S. 376–382, doi:10.1103/PhysRev.44.376.
- Holger S. P. Mueller, Helge Willner: Vibrational and electronic spectra of chlorine dioxide, OClO, and chlorine superoxide ClOO, isolated in cryogenic matrixes. In: J. Phys. Chem., 1993, 97 (41), S. 10589–10598, doi:10.1021/j100143a013.
- Anette Rehr, Martin Jansen: Investigations on Solid Chlorine Dioxide: Temperature-Dependent Crystal Structure, IR Spectrum, and Magnetic Susceptibility. In: Inorg. Chem., 1992, 31 (23), S. 4740–4742, doi:10.1021/ic00049a006.
- W. W. Eckenfelder, J. A. Roth, A. R. Bowers: Chemical oxidation – technologies for the nineties. Technomic Publishing Company, 1996.
- Bal Raj Deshwal, Hyung Keun Lee: Manufacture of Chlorine Dioxide from Sodium Chlorite: Process Chemistry. In: Journal of Industrial and Engineering Chemistry, 2005, 11 (1), S. 125–136, Abstract, PDF; 3,6 MB.
- Alfred P. Sattelberger, Jeanne M. Robinson, Robert P. Currier: Inadvertent Production And Explosion Of Liquid Chlorine Dioxide. Chemical & Engineering News, 2002, 80(49), 4–5.
- María I. López, Adela E. Croce, Juan E. Sicre: Explosive decomposition of gaseous chlorine dioxide. In: J. Chem. Soc., Faraday Trans. 1994, 90, S. 3391–3396, doi:10.1039/FT9949003391.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. VCH, Weinheim 1988, ISBN 3-527-26169-9; Kapitel Oxide von Chlor, Brom und Iod.
- Willy J. Masschelein: Chlorine Dioxide: Chemistry and Environmental Impact of Oxychlorine Compounds. Ann Arbor Science, 1979, ISBN 0-250-40224-6.
- Miracle Mineral Supplement (MMS): Erhebliche Gesundheitsgefahr. In: Verbraucherzentrale.de. 16. August 2019, abgerufen am 14. Mai 2020.
- Sigrid März: Darum geht es bei Chlordioxid und MMS. In: MedWatch. 15. November 2021, abgerufen am 21. November 2021.
- Zusatzstoffmuseum.de: 926 Chlordioxid Im Zusatzstoff-Lexikon, abgerufen am 29. Dezember 2021.
- M. Rohrlich, G. Brückner: Die chemische Mehlbehandlung. In: Zeitschrift für Lebensmittel-Untersuchung und -Forschung. 1952, 94 (5), S. 324–356, doi:10.1007/BF01576373.
- Bernd Kerschner und Jörg Wipplinger: MMS: Das gefährliche Wundermittel. In: Medizin transparent. 26. Februar 2020, abgerufen am 13. Mai 2020.
- American Water Works Association: Chlorine Dioxide. American Water Works Association, 2002, ISBN 978-1-58321-180-9, S. 35, (eingeschränkte Vorschau in der Google-Buchsuche).
- Gesetzesänderungen 2/2009 (PDF; 79,8 kB) von der Webseite des Bundesverband der Lebensmittelkontrolleure Deutschlands e. V.
- Der Spiegel: Importverbot. EU will Chlor-Hähnchen wieder zulassen – unter Auflagen. Abgerufen am 13. Mai 2020.
- Frankfurter Allgemeine: Hühnchen-Streit vor die WTO. Ausgabe vom 17. Januar 2009, Nr. 14, S. 10.
- WTO: DISPUTE SETTLEMENT: DISPUTE DS389. Abgerufen am 13. Mai 2020.
- EFSA: Dekontamination von Schlachtkörpern. (Memento vom 4. Juli 2018 im Internet Archive). Abgerufen am 13. Mai 2020.
- Verbraucherschutz: Behörde hält Chlorhühnchen für unbedenklich. In: Spiegel Online, 10. Juni 2014. Ankündigung des Report-Mainz-Berichtes Angst vor dem Chlorhuhn – Geht es beim Kampf gegen US-Geflügelimporte tatsächlich um Verbraucherschutz?
- Huang Junli, Wang Li, Ren Nanqi, Ma Fang and Juli: Disinfection effect of chlorine dioxide on bacteria in water. In: Water Research, 1997, 31 (3), S. 607–613, doi:10.1016/S0043-1354(96)00275-8.
- M. Belluatia, E. Danesia, G. Petruccia, M. Rosellini: Chlorine dioxide disinfection technology to avoid bromate formation in desalinated seawater in potable waterworks. In: Desalination, 2007, 203 (1-3), S. 312–318, doi:10.1016/j.desal.2006.04.014.
- R. A. Deininger. A. Ancheta. A. Ziegler: Chlorine Dioxide. (Memento vom 9. Januar 2017 im Internet Archive). (PDF; 43 kB); OPS. Regional symposium on water quality: effective disinfection. Lima, CEPIS, 1998.
- Verordnung des EDI über Fremd- und Inhaltsstoffe in Lebensmitteln (Fremd- und Inhaltsstoffverordnung, FIV): Anhang 4: Liste der Höchstkonzentrationen (Toleranz- und Grenzwerte) für andere Fremdstoffe oder Inhaltsstoffe. (PDF; 158 kB).
- EPA Guidance Manual, Chapter 4: Chlorine dioxide. (Memento vom 12. Februar 2011 im Internet Archive). (PDF; 158 kB), US Environmental Protection Agency, abgerufen am 13. Mai 2020.
- https://www.sciencedirect.com/science/article/abs/pii/0043135485901824
- David T. Williams, Guy L. LeBel, Frank M. Benoit: Disinfection by-products in Canadian drinking water. In: Chemosphere, 1997, 34 (2), S. 299–316, doi:10.1016/S0045-6535(96)00378-5.
- H. Junli, Q. Fan, G. Kou, C. Liu: Survey of haloform in main drinking water of China. In: Environ Chem., 1987, 6 (4), S. 80–86.
- EPA Fact sheets: Anthrax spore decontamination using chlorine dioxide. (Memento vom 17. Februar 2015 im Internet Archive). November 2012.
- Pat L. Weaver-Meyers, Wilbur A. Stolt, Barbara Kowaleski: Controlling mold on library materials with chlorine dioxide: An eight-year case study. In: The Journal of Academic Librarianship, 1998, 24 (6), S. 455–458, doi:10.1016/S0099-1333(98)90006-4.
- A Nation Challenged: Anthrax; Senate Offices Refumigated A Second Time. (Memento vom 24. Dezember 2013 im Internet Archive). New York Times, 1. Januar 2002, S. A14.
- NY decontamination service rids Pascal’s Manale in New Orleans. (Memento vom 21. Dezember 2009 im Internet Archive). New Orleans CityBusiness, 21. November 2005.
- Rusty Dornin: Mitschrift des CNN Berichts über die Gebäudedesinfektion in New Orleans vom vom 20. November 2005 und 21. November 2005 (Memento vom 13. Dezember 2013 im Internet Archive). Abgerufen am 13. Mai 2020.
- Ch. Kunzmann, H. Schutz: Application of chlorine dioxide for filler hygiene – A viable alternative. In: Trends in Food Science & Technology, 2009, 20, Supplement 1, S23–S26, EHEDG Yearbook 2009, doi:10.1016/j.tifs.2009.01.040.
- Drucksache der Bundesregierung 10/2099: PDF; 285 kB.
- Siehe: Wasseraufbereitung im Schwimmbad.
- Corinna Milborn: Tödliches Wundermittel. In: ZEIT online. 24. November 2021, abgerufen am 22. Dezember 2021.
- Holm Hümmler: Die „Medizin“ der Verschwörungsgläubigen und was ich sonst noch an Kommentaren bekomme. In: quantenquark.com. 25. Februar 2019, abgerufen am 13. Mai 2020.
- Jana Heigl: Wie manche Impfskeptiker ihre Kinder mit Chlorbleiche gefährden. In: BR24. 23. Juli 2021, abgerufen am 25. November 2021.
- Kira Urschinger: Fake News Coronavirus: Wir klären Lügen & falsche Fakten zu Corona. In: SWR3.de. 10. April 2020, abgerufen am 13. Mai 2020.
- Alice Echtermann: Die Einnahme von Chlordioxid hilft nicht gegen das neue Coronavirus. In: correctiv.org. 7. Februar 2020, abgerufen am 13. Mai 2020.
- Hilft die Einnahme von Chlordioxid gegen Corona? In: Süddeutsche Zeitung. 29. April 2020, abgerufen am 13. Mai 2020.
- Corinna Milborn: Tödliches Wundermittel. In: Zeit online. 24. November 2021, abgerufen am 25. November 2021.
- Sigrid März: Andreas Kalcker behauptet, Chlordioxid helfe gegen Corona. Was sagen seine Studien? In: MedWatch. 20. September 2021, abgerufen am 26. September 2021.
- Kathrin Helmreich: Bolivien genehmigt Chlordioxid unter bestimmten Auflagen (Faktencheck). In: Mimikama. 28. Oktober 2020, abgerufen am 22. März 2021.
- Jörg Hilbert, Lea Struckmeier: Corona-Pandemie: Gefährliches Wundermittel hat Konjunktur. In: NDR. 20. Oktober 2020, abgerufen am 22. März 2021.
- Paraskevas D. Tzanavaras, Demetrius G. Themelis, Fotini S. Kika: Review of analytical methods for the determination of chlorine dioxide. In: Central European Journal of Chemistry, 2007, 5 (1), doi:10.2478/s11532-006-0054-9.
- J. F. Haller, S. S. Listek: Determination of Chlorine Dioxide and Other Active Chlorine Compounds in Water. In: Anal. Chem., 1948, 20 (7), S. 639–642, doi:10.1021/ac60019a013.
- Carsten L. Thomsen, Philip J. Reid, and Søren R. Keiding: Quantum Yield for ClOO Formation following Photolysis of Aqueous OClO. In: J. Am. Chem. Soc., 2000, 122 (51), S. 12795–12801, doi:10.1021/ja002148o.
- S. Solomon, G. H. Mount, R. W. Sanders, A. L. Schmeltekopf: Visible spectroscopy at McMurdo Station, Antarctica 2. Observations of OClO. In: Journal of Geophysical Research, 1987, 92 (D7), S. 8329–8338, doi:10.1029/JD092iD07p08329.
- Susan Solomon: Stratospheric ozone depletion: A review of concepts and history. In: Reviews of Geophysics, 1999, 37 (3), S. 275–316, doi:10.1029/1999RG900008.
- L. T. Molina, M. J. Molina: Production of chlorine oxide (Cl2O2) from the self-reaction of the chlorine oxide (ClO) radical. In: J. Phys. Chem., 1987, 91 (2), S. 433–436, doi:10.1021/j100286a035.
- U.S. Department of Health and Human Services: Toxicological Profile. Atlanta, GA September 2004.
- Toxikologischer Review über Chlordioxid und Chlorit. (Memento vom 11. Januar 2010 im Internet Archive). U.S. Environmental Protection Agency (EPA), Washington, DC September 2000.
- Seymour Stanton Block: Disinfection, sterilization, and preservation. 15. Dezember 2000, ISBN 0-683-30740-1, S. 215 ff.
- Chris Winder: The Toxicology of Chlorine. Environmental Research, Section A 85, 2001, S. 105–114, doi:10.1006/enrs.2000.4110.
- Daniel Couri, Mohamed S. Abdel-Rahman, Richard J. Bull: Toxicological Effects of Chlorine Dioxide, Chlorite and Chlorate. In: Environmental Health Perspectives, 1982, 46, S. 13–17, PMC 1569035 (freier Volltext).
- J. P. Bercz, L. Jones, L. Garner, D. Murray, D. A. Ludwig, J. Boston: Subchronic toxicity of chlorine dioxide and related compounds in drinking water in the nonhuman primate. In: Environmental Health Perspectives, 1982, 46, S. 47–55, PMC 1569048 (freier Volltext).
- Charles I. Noss, Fred S. Hauchman, Vincent P. Olivieri: Chlorine dioxide reactivity with proteins. In: Water Research, 1986, 20 (3), S. 351–356, doi:10.1016/0043-1354(86)90083-7.
- Fred S. Hauchman, Charles I. Noss, Vincent P. Olivieri: Chlorine dioxide reactivity with nucleic acids. In: Water Research, 1986, 20 (3), S. 357–361, doi:10.1016/0043-1354(86)90084-9.
- J. Simonet, C. Gantzer: Degradation of the Poliovirus 1 genome by chlorine dioxide. In: Journal of Applied Microbiology, 2006, 100 (4), S. 862–870, PMID 16553743.
- S. B. Young, P. Setlow: Mechanisms of killing of Bacillus subtilis spores by hypochlorite and chlorine dioxide. In: Journal of Applied Microbiology, 2003, 95 (1), S. 54–67, PMID 12807454.
- M. E. Alvarez, R. T. O’Brien: Mechanisms of Inactivation of Poliovirus by Chlorine Dioxide and Iodine. In: Appl Environ Microbiol., 1982, 44 (5), S. 1064–1071, PMC 242149 (freier Volltext).
- Jun Wen Li, Zhong Tao Xin, Xin Wei Wang, Jin Lai Zheng, Fu Huan Chao: Mechanisms of inactivation of hepatitis A virus in water by chlorine dioxide. In: Water Research, 2004, 38 (6), S. 1514–1519, doi:10.1016/j.watres.2003.12.021.
- Robert H. Taylor, Joseph O. Falkinham III, Cheryl D. Norton, Mark W. LeChevallier: Chlorine, Chloramine, Chlorine Dioxide, and Ozone Susceptibility of Mycobacterium avium. In: Applied and Environmental Microbiology. 2000, 66 (4), S. 1702–1705, PMID 10742264.




