Fluorescein
Fluorescein ist ein fluoreszierender Farbstoff aus der Gruppe der Xanthenfarbstoffe und der Triphenylmethanfarbstoffe.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
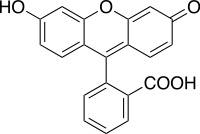 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Fluorescein | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C20H12O5 | |||||||||||||||||||||
| Kurzbeschreibung |
rote Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 332,32 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser, leicht löslich in Ethanol, DMSO, Diethylether und Alkalien[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte

Fluorescein und andere Phthaleine wurden 1871 von Adolf von Baeyer entdeckt. Den alternativen Namen Resorcinphthalein verdankt der Stoff den Reaktanten, aus denen ihn Adolf von Baeyer synthetisierte. Er mischte Phthalsäureanhydrid (auch Phthalsäure ist verwendbar) mit Resorcin und fügte konzentrierte Schwefelsäure als wasserabspaltendes Mittel hinzu. Danach erhitzte er die Mischung zu einer dickflüssigen Schmelze und behandelte dann die abgekühlte Schmelze mit warmem Wasser und Ammoniak, anschließend brachte er den Ansatz in reichlich destilliertes Wasser.
Darstellung
Fluorescein (2) wird in der Regel durch Kondensation von einem Äquivalent Phthalsäureanhydrid (1) und zwei Äquivalenten Resorcin unter Abspaltung von Wasser an einem Katalysator dargestellt. Als Katalysator eignet sich entweder konzentrierte Schwefelsäure oder wasserfreies Zinkchlorid.

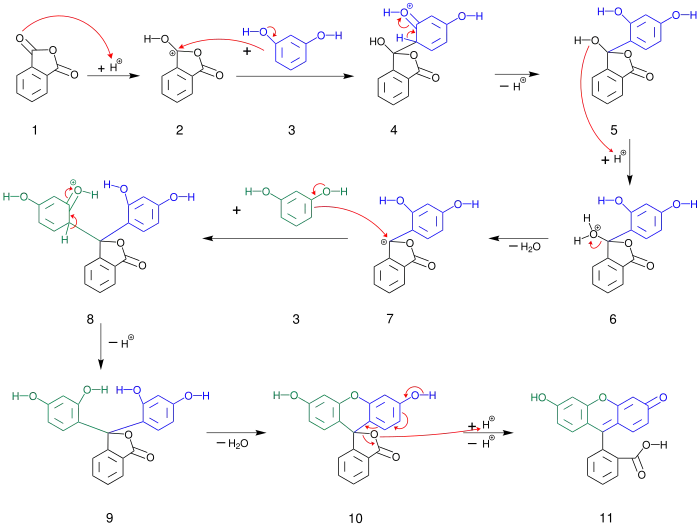
Eigenschaften
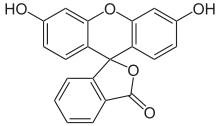
Fluorescein kommt in zwei verschiedenen Strukturen vor. Die stabilere ist dabei die offene Carbonsäure-Form, die im festen Zustand als rote Kristalle vorliegt. Daneben existiert noch die Spiro-Lacton-Form, die eine instabile, gelbe Verbindung bildet.[1]
- Absorptionsmaximum: 485 nm (pH 9)
- Extinktionskoeffizient: 93 000 l·cm−1·mol−1 (pH 9)
- Emissionsmaximum: 514 nm (pH 9)
- Quantenausbeute: 0,93 (50 µmol Fluorescein in 0,1 mol Natriumboratpuffer, pH 9,5)
- Fluoreszenzlebensdauer: 4,16 ns (Dianion in Natronlauge)
Verwendung
Fluorescein wird in der analytischen Chemie als Indikator verwendet. Darüber hinaus dient es zum Nachweis von Bromiden, zur Quellenfärbung und zur Färbung von Seifen und Badeextrakten/-salzen. Weiterhin ist Fluorescein ein Fluoreszenzfarbstoff, der bei Anregung mit blauem Licht (Absorptionsmaximum bei einer Wellenlänge von 496 nm, z. B. durch einen Argon-Ionen-Laser) grünes Licht (Wellenlänge ca. 520 bis 530 nm) abgibt. Verwandte Reaktivfarbstoffe wie z. B. Fluoresceinisothiocyanat (FITC) können mit verschiedenen Antikörpern (Immunglobulinen) gekoppelt werden und so für die Fluoreszenzmikroskopie oder Durchflusszytometrie eingesetzt werden. Damit können in Flüssigkeiten, Zellen oder Geweben dann spezifische Oberflächeneigenschaften (Antigene), z. B. auch von Krankheitserregern, nachgewiesen werden. Man bezeichnet diese Arbeitstechnik als direkte Immunfluoreszenz. Weiterhin wird Fluorescein als Färbemittel in der Augenheilkunde bei der Fluoresceinangiographie und der Applanationstonometrie verwendet.[3]
Fluorescein hat eine hohe Quantenausbeute von bis zu 93 %, seine Nützlichkeit zur Fluoreszenzmarkierung wird aber durch eine Reihe von Nachteilen eingeschränkt: Die Intensität der Fluoreszenz hängt vom pH-Wert ab und fällt stark unterhalb von pH 7 (pKs ≈ 6,4). Unter Beleuchtung geht außerdem die Fluoreszenz schnell zurück (starkes Photobleichen). Das Fluoreszenzmaximum ist nicht sehr scharf, die dazugehörige Absorptionsbande recht breit.
Analytik


Der klassische Nachweis beruht auf der Bromierung, durch die das rote Eosin (Tetrabromfluorescein) entsteht. Außerdem fallen verdünnte Lösungen von Fluorescein durch ihre gelbgrüne Fluoreszenzfarbe, auf der auch der Name beruht, auf.
Uranin

Das wasserlösliche Natriumsalz des Fluoresceins trägt den Namen Uranin (gleiche C.I.-Nummer 45350, Summenformel C20H10Na2O5) und ist ein vielfältig verwendeter gelber, unter UV- und Tageslicht grün fluoreszierender Farbstoff.
Uranin besitzt in wässriger Lösung ein enormes Färbevermögen (so führt gegen einen weißen Hintergrund bereits eine Uraninkonzentration von 0,1 mg/l zu einer sichtbaren Verfärbung).
So kann bei Schiffbrüchigen beziehungsweise nach Notwasserungen mit einer Menge von lediglich 500 g Uranin eine Meeresfläche von ca. 4000 m² auffällig gefärbt und somit die Entdeckung durch Suchtrupps, gerade aus der Luft, erleichtert werden.[1]
Der Farbstoff wird weiterhin vielfältig eingesetzt, insbesondere zum Einfärben von Schaumbädern, Badezusätzen, Shampoos, Kosmetika und Frostschutzmitteln für Autokühler, um Leckagen im Kühlsystem mittels einer UV-Lampe leicht orten zu können. Ist die Abdichtung zwischen Kühlsystem und Brennraum undicht, lässt sich der Farbstoff sogar am Auspuff nachweisen. Ferner nutzt man es auch bei Dichtigkeitsprüfungen von Flachdächern und Tankanlagen. Uranin gilt als biologisch unbedenklich.[4][5] Daher wird es von Hydrologen und Hydrogeologen als sogenannter Tracer zum Verfolgen von Grundwasserströmen und unterirdischen Flussläufen verwendet. 1877 brachte man bei Immendingen 10 kg Uranin in die Donau ein und bemerkte 60 Stunden später in dem Flüsschen Aach eine deutliche Fluoreszenz, wodurch die Donauversinkung aufgeklärt werden konnte.[6]
Uranin wird auch zur Dekoration eingesetzt, zum Beispiel für Leuchtfarben in Diskotheken oder Szenenbildern (in Sciencefiction- oder Horrorfilmen: mit UV-Licht angestrahltes Uranin sieht „giftig-radioaktiv“ aus). Anfangs wurde jährlich am 17. März, dem Saint Patrick’s Day, der durch Chicago fließende Chicago River mit Uranin grün eingefärbt. Aufgrund der Intervention der EPA wird allerdings seit 1966[7][8] ein pflanzlicher Farbstoff verwendet.[9] Uranin wurde am 10. September 2019 von Umweltaktivisten eingesetzt, um die Limmat in Zürich grün zu färben; dies zog ein Ermittlungsverfahren der Polizei wegen Gewässerverunreinigung nach sich.[10]
Weblinks
Einzelnachweise
- Eintrag zu Fluorescein. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. März 2014.
- Eintrag zu Fluorescein in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Robert L. Stamper, Marc F. Lieberman, Michael V. Drake: Becker-Shaffer’s Diagnosis and Therapy of the Glaucomas. 8. Auflage, Elsevier Health Sciences, 2009, ISBN 978-0-323-02394-8, S. 47–50.
- Immer im Fluss: Die perfekte Farbstoffmarkierungslösung. In: Merck Millipore Homepage. Merck, abgerufen am 14. April 2012.
- Arbeitskreis „Human- und ökotoxikologische Bewertung von Markierungsmitteln in Gewässern“: Human- und ökotoxikologische Bewertung von Markierungsmitteln in Gewässern. Empfehlungen eines Arbeitskreises beim Umweltbundesamt. In: Grundwasser. Band 2, Nr. 2, 1. Juni 1997, S. 61–64, doi:10.1007/s767-1997-8521-7.
- A. Knop: Über die hydrographischen Beziehungen zwischen der Donau und der Aachquelle im badischen Oberlande. In: Neues Jahrb. Mineral. Geol. Palaeontol., (1878), S. 350–363.
- Dan O’Leary: The Story Behind Dyeing the River. (Memento vom 28. August 2014 im Internet Archive) In: greenchicagoriver.com. Abgerufen am 4. Februar 2013.
- Miriam Krause: Celebrating St. Patrick’s Day with Fluorescence. In: sustainable-nano.com. Sustainable Nano, 17. März 2015, abgerufen am 28. Dezember 2021 (englisch).
- Other cities dye-ing to know what turns Chicago river green. Meldung in The Columbia Chronicle vom 20. März 2003.
- Nils Pfändler: Umweltaktivisten färben die Limmat grün. In: nzz.ch. Neue Zürcher Zeitung, 10. September 2019, abgerufen am 28. Dezember 2021.
