Kapsid
Als Kapsid oder Capsid (von lateinisch capsula, auf Deutsch etwa ‚kleine Kapsel‘) bezeichnet man bei Viren eine komplexe, regelmäßige Struktur aus Proteinen (Kapsidproteinen, englisch viral coat protein, capsid protein, VCP oder nur CP), die der Verpackung des Virusgenoms dient. Ein Kapsid ist aus einer feststehenden Anzahl von Protein-Untereinheiten, den Kapsomeren, aufgebaut. Bei unbehüllten Viren bildet das Kapsid die äußerste Struktur des Virus und ist damit für die Anheftung und das Eindringen in die Wirtszelle verantwortlich; bei behüllten Viren interagiert das Kapsid mit der äußeren Virushülle (en. coat, enthält Lipide) und verleiht ihr häufig erst die nötige Stabilität.

Die Anordnung der Proteine eines Kapsids basiert auf verschiedenen Symmetrien und ist sehr vielgestaltig. Diese unterschiedlichen Strukturen und Symmetrien von Kapsiden haben wiederum Auswirkungen auf die biologischen Eigenschaften wie die Pathogenität, die Art der Virusvermehrung (Replikation) und die Umweltstabilität. Die Struktur des Kapsids dient auch als Kriterium der Einteilung von Viren innerhalb der Virus-Taxonomie.
Entdeckung
1956 schlossen Francis Crick und James Watson, dass die Verpackung der Nukleinsäure von Viren aus vielen identischen, notwendigerweise symmetrisch angeordneten Untereinheiten bestehen müsse, da die Nukleinsäure kleiner Viren nicht genug Protein kodieren könne, um sich damit zu bedecken. Die genetische Information müsse also durch viele Kopien identischer Proteine mehrfach genutzt werden.[1] Noch im gleichen Jahr fand Donald Caspar durch Röntgenkristallographie die fünfzählige Symmetrie des Ikosaeders an einem Kristall aus Partikeln des Tomato-bushy-stunt-Virus.[2]
Kapsomer
Als Kapsomer (pl. Kapsomere) bezeichnet man die kleinste regelmäßige Einheit, aus der ein Kapsid aufgebaut ist und die dessen Symmetrie bestimmt. Im einfachsten Fall besteht ein Kapsid aus identischen Kapsomeren, die wiederum nur aus einem Proteinmolekül bestehen. Sehr häufig jedoch besteht ein Kapsomer aus zwei bis fünf verschiedenen Proteinen, die sich zu einem regelmäßigen Kapsid zusammenlagern. Das Kapsid kann auch aus verschiedenen Kapsomeren aufgebaut sein, z. B. bestehen Adenoviren aus zwei unterschiedlichen Kapsomeren (Pentone und Hexone), die wiederum selbst aus verschiedenen Virusproteinen bestehen.
Geläufige Bezeichnungen für die Kapsidproteine sind: Hauptkapsidprotein (en. major capsid protein, MCP), Nebenkapsidprotein (en. minor capsid protein, mCP), Virus-CP (VCP), oder die (bis zu fünf) Proteine werden durchnummeriert VP1, VP2 etc.
Die einzelnen Untereinheiten, aus denen ein Kapsomer wiederum aufgebaut sein kann, werden gelegentlich auch als Protomere bezeichnet.
Bei einer vorgegebenen Genomsequenz eines Virus können jene Proteine, die das Kapsomer bilden, sehr leicht erkannt werden, da sie in bestimmten Abschnitten eine hohe Konzentration von positiv geladenen bzw. basischen Aminosäuren (Arginin, Lysin, Histidin) enthalten. Diese basischen Proteindomänen der Kapsidproteine (Coreproteine) sind zur nicht-kovalenten Bindung an die negativ geladene virale Nukleinsäure notwendig, die verpackt werden soll.
Symmetrieformen
Ikosaedrische Symmetrie
Die häufigste Symmetrie eines Kapsids ist ein regelmäßiges Ikosaeder (Zwanzigflächner), da dieses unter allen regelmäßigen Vielflächnern (Polyeder) bei gegebener Kantenlänge das größte Volumen hat. Die Kantenlänge wird durch die Größe der Kapsomere und ihre Anzahl bestimmt. Bei der Darstellung von Virionen im Elektronenmikroskop (EM) oder mittels Röntgenstrukturanalyse entspricht jedoch bei vielen Viruskapsiden das Erscheinungsbild, also die äußere Gestalt, nicht einem Ikosaeder, sondern ist meist kugelförmig, teilweise mit herausragenden Proteinschleifen (englisch spikes) versehen. Verbindet man aber gleiche Molekülpositionen der Kapsomere miteinander, so findet man eine ikosaedrische Anordnung der Kapsomere. Daher gilt es zwischen dem Begriff der Symmetrie eines Kapsids und der Form (Morphologie) eines Kapsids gut zu unterscheiden. Bei einigen Viren kann die innere Symmetrie eines Ikosaeders auch sofort an der äußeren Form erkannt werden, z. B. bei Mitgliedern der Familie Adenoviridae oder einigen Bakteriophagen.
Die meisten viralen Kapside mit ikosaedrischer Symmetrie sind isometrisch, d. h. alle Seitenkanten des Ikosaeders sind gleich lang, was am ehesten der Idealform eines mathematischen Ikosaeders entspricht. Hiervon gibt es einige abweichende Beispiele, z. B. in den Familien Myoviridae (mit dem T4-Phagen) und Siphoviridae. Das länglich-gestreckte erscheinende Kapsid ist damit im geometrischen Sinne kein Ikosaeder mehr, sondern ein fünfeckiges, bipyramidales Antiprisma. Weitere Abweichungen mit einer ausgezeichneten Ecke findet man in der Familie Mimiviridae (Mimivirus: Stargate) und Phycodnaviridae (Chlorovirus: Vortex mit Dorn). Virologen sprechen bei diesen Formen jedoch trotzdem von einem nicht-isometrischen Ikosaeder.
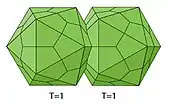
Ein weiterer Sonderfall sind die „Zwillingsviren“ Geminiviridae (sowie deren Satelliten Geminialphasatellitinae und Tolecusatellitidae) mit zwei „aneinandergeklebten“ Ikosaedern. Diese Satelliten „borgen“ sich die Kapsidbausteine von den Geminiviridae (ihren Helferviren), was die übereinstimmende Morphologie erklärt.
Symmetrieachsen
 |
Für die Struktur des Ikosaeders sind drei Typen von Symmetrieachsen charakteristisch, die eine Rotationssymmetrie zeigen: durch gegenüberliegende Seitenkanten verläuft je eine Symmetrieachse mit zweistrahliger (180°) Symmetrie, durch gegenüberliegende Seitenflächen je eine dreistrahlige (120°) und durch gegenüberliegende Ecken je eine fünfstrahlige (72°). Die entsprechenden Symmetrien haben die Kapsomere oder ihre Anordnung auf dem Ikosaeder. So kann ein Kapsid aus Kapsomeren mit einer dreistrahligen oder einer fünfstrahligen Symmetrie aufgebaut sein; häufig haben die Kapsomerformen innerhalb eines Kapsids je nach Position auch verschiedene Symmetrien, da sie meist aus zwei, drei oder fünf identischen Proteinuntereinheiten bestehen. Die Anordnung der Kapsomere zu einer bestimmten Rotationssymmetrie ist nicht immer zwangsläufig durch die Struktur der Proteine vorgegeben. Es gibt bei manchen Viruskapsiden auch verschiedene Möglichkeiten der Anordnung zu einem Ikosaeder, was sich in der Bildung unterschiedlicher Viruspartikel mit gering verschiedenen Durchmessern bei demselben Virus zeigt. So bestehen die Kapside von natürlichen Virionen des Hepatitis-B-Virus überwiegend aus 180 Kapsomeren (T = 3, siehe unten), etwa 20 % der Kapside, jedoch aus 240 Kapsomeren (T = 4).[3] Die biologische Bedeutung unterschiedlicher Kapsidsymmetrien bei demselben Virus ist bislang nicht geklärt.
Triangulationszahl
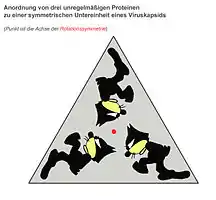 Drei asymmetrische, aber identische Objekte bilden eine dreizählige Rotationssymmetrie. |
 Felix als Kapsid mit der Triangulationszahl T = 1 |
Zur genaueren Beschreibung eines ikosaedrischen Kapsids wurde 1962 von Donald Caspar und Aaron Klug eine geometrische Kennzahl eingeführt,[4] die sogenannte Triangulationszahl (T). Mit ihr kann man die Größe und die Komplexität eines Kapsids beschreiben.
Durch Zusammenlagerung von drei identischen Molekülen eines beliebigen unregelmäßigen, nicht-symmetrischen Proteins kann ein gleichseitiges (dreizählig rotationssymmetrisches) Dreieck gebildet werden. Diese Anordnung ist die kleinstmögliche symmetrische Einheit zur Ausbildung eines ikosaedrischen Kapsids. Da ein solches regelmäßiges Dreieck also aus mindestens drei Untereinheiten aufgebaut ist und ein Ikosaeder aus zwanzig solcher regelmäßiger Dreiecke besteht, sind mindestens 3 · 20 = 60 solcher Untereinheiten zur Ausbildung der einfachsten ikosaedrischen Symmetrie notwendig. Diese Mindestzahl von 60 wird durch die Triangulationszahl T = 1 beschrieben. Größere und komplexere Kapside besitzen nur ganzzahlige Vielfache von 60, also z. B. häufig 180 (T = 3), 240 (T = 4), 960 (T = 16). Bei Kapsiden mit einer T > 1 entstehen sogenannte Pseudo-6-Symmetrien, bei denen Pentons und Hexons entstehen. Die jeweilige Anzahl an Hexons zwischen zwei Pentons ergeben die Triangulationszahlen h und k. Die Anzahl der Hexons in einer direkten Linie von einem Penton zum nächsten = h. Die Anzahl an Hexons nachdem man einen "Knick" in der direkten Linie zum nächsten Penton machen muss = k. Die geometrisch möglichen Triangulationszahlen ergeben sich dann aus der Formel T = h² + hk + k², wobei h und k ganze Zahlen sind.
Helikale Symmetrie
Bei einigen Viren lagern sich die Kapsomere schraubenförmig zu einer helikalen Quartärstruktur um die zu verpackende Nukleinsäure; dabei bilden sie nach außen eine längliche Zylinderform. Der Durchmesser eines helikalen Kapsids ist durch die Größe der Kapsomere festgelegt, die Länge des Zylinders ist direkt abhängig von der Länge der zu verpackenden Nukleinsäure.
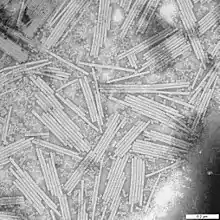 Helikale Kapside des Tabakmosaikvirus
Helikale Kapside des Tabakmosaikvirus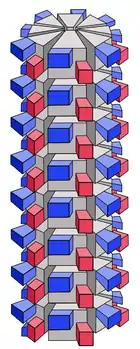 Schema eines helikalen Kapsids
Schema eines helikalen Kapsids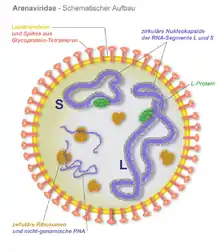 Mehrere ringförmige, helikale Kapside (blau) bei Arenaviren
Mehrere ringförmige, helikale Kapside (blau) bei Arenaviren
Unbehüllte (nackte) helikale Kapside kommen nur bei einigen Pflanzenviren (z. B. Tabakmosaikvirus, Lily-Mottle-Virus) und Bakteriophagen (Familie Inoviridae) vor, während Viren mit behülltem helikalem Kapsid bei Tieren weit verbreitet sind. Wichtige Krankheitserreger mit helikalem Kapsid sind beispielsweise die Influenzaviren, die Paramyxoviridae (z. B. das Mumpsvirus und Masernvirus), die Bunyaviridae oder Rhabdoviridae (z. B. das Tollwutvirus). Eine Sonderform der helikalen Symmetrie liegt bei der Virusgattung Torovirus vor. Hier bildet sich aus einem länglichen helikalen Kapsid ein geschlossener Ring mit der geometrischen Form eines Torus.
Komplexe oder keine Symmetrie
Manche Kapside besitzen weder eine eindeutig ikosaedrische noch helikale Symmetrie, trotz der regelmäßigen Struktur ihrer Form. Dies ist insbesondere bei Mitgliedern der Familie Poxviridae (Pockenviren) zu beobachten. Daher wird die Symmetrie dieser Viren als „komplex“ bezeichnet.
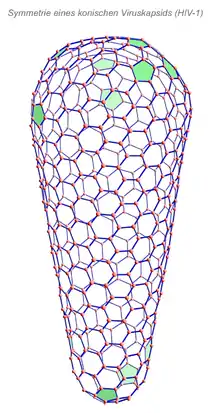
Eine Sonderstellung innerhalb der komplexen Symmetrien nehmen die konischen (kegelförmigen) Nukleokapside bei Retroviren, z. B. dem HIV-1, ein. Das Coreprotein dieses Virus kann in vitro Röhren mit helikaler Symmetrie ausbilden, jedoch auch die natürliche Form der konischen, geschlossenen Röhre annehmen. Dabei zeigt sich, dass dieses Kapsid aus einem Netz von Sechsecken aufgebaut ist, das durch 12 Netzmaschen mit fünfeckiger Anordnung unterbrochen ist (in der Abbildung grün markiert).[5] Von den zwölf fünfeckigen Lücken befinden sich sieben am breiten und fünf am schmalen Ende des Konus. Damit folgt diese Netzsymmetrie einem mathematischen Theorem von Leonhard Euler, nach dem eine geschlossene Oberfläche, die durch Sechsecke bedeckt werden soll, stets mindestens zwölf fünfeckige Lücken hat (Eulerscher Polyedersatz). Durch diese sehr variablen Winkelverhältnisse der Kapsomere zueinander und die durch die Fünfecke entstehenden Stellen mit geringerer Stabilität wird wahrscheinlich die Freisetzung des Retrovirus-Genoms in den Zellkern erst ermöglicht.
Darüber hinaus gibt es Viren, bei denen keine eindeutige Kapsidform nachgewiesen werden konnte. Diese Viren verfügen jedoch über Proteine mit den oben beschriebenen basischen Proteindomänen, die zwischen Nukleinsäure und Virushülle vermitteln und meist von innen in der Virushülle verankert sind. Mit dieser Verankerung in der Hülle sind sie mit den sogenannten Matrixproteinen verwandt, die bei anderen Viren (z. B. den Herpesviridae und Paramyxoviridae) zusätzlich zu einem Kapsid die Hülle von innen auskleiden; strenggenommen dürfte man nicht von einem Kapsid sprechen. Diese Proteine werden aus historischen Gründen meist als Coreproteine bezeichnet. Die bekanntesten Beispiele hierfür sind das Hepatitis-C-Virus und das Bovine Virusdiarrhoe-Virus BVDV.
Kapsid und Nukleokapsid
Häufig werden die Begriffe Kapsid und Nukleokapsid fälschlicherweise synonym verwendet. Nur ein Kapsid, das direkt mit der Nukleinsäure assoziiert ist, ist auch ein Nukleokapsid. Es gibt Viren (z. B. das Humane Immundefizienz-Virus), bei denen sich innerhalb eines äußeren Kapsids ein zweites befindet; hier wird nur dieses innerste als Nukleokapsid (oder Core) bezeichnet. Im Inneren eines Kapsids kann sich die Nukleinsäure zusätzlich mit basischen Proteinen (z. B. zellulären Histonen) assoziieren oder mit Proteinen kovalent verknüpft sein. In diesem Falle spricht man von einem Nukleoprotein-Komplex.
Auch viele behüllte Viren wie die Coronaviren besitzen ein Nukleokapsid-Protein, das im funktionsfähigen Virion (Viruskörper) vollständig innerhalb der Virushülle liegt.[6]
Sonderfälle
Einzelverpackte Genomsegmente
Manche Viren mit segmentierten Genom verpacken die einzelnen Teile in ein einziges Kapsid, andere bilden für jedes Segment ein eigenes Kapsid. Im letzteren Fall gibt es für jedes Segment einen eigenen Typ von Viruspartikel (unterschieden durch den Genominalt); das Virus kann seine volle Funktionalität in der Wirtszelle erst entfalten, wenn diese mit Viruspartikeln eines jeden Typs infiziert und das Virusgenom komplett ist (Beispiel Nanoviridae).
Kapsidbausteine vom Helfervirus
Manche Satellitenviren, wie die Sarthroviridae und Deltavirus, „stehlen“ Kapsidbausteine von ihren Helferviren.
Kapsidlose Viren
Einige sehr primitiv aufgebauten Viren, fehlt das CP, so dass sie ohne Kapside keine echten Virionen (Viruspartikel) aufbauen. Beispiele sind die Endornaviridae, Narnaviridae, Mitoviridae und einige Botourmiaviridae.
Energetische Betrachtung der Kapsidbildung
Kapside können sich innerhalb einer Zelle oder experimentell als gereinigte Proteinlösung der Kapsomere spontan und ohne Energieverbrauch bilden; dies wird auch oft als Selbstassemblierung (engl. self-assembly) bezeichnet. Zum ersten Mal konnte die spontane Kapsidbildung beim Tabakmosaikvirus beobachtet werden; in vitro gelang dies auch später bei animalen Viren wie z. B. den Alphaviren.[7]
Bei einer großen Anzahl von Viren gelang diese Kapsidbildung in vitro jedoch nicht. Man fand heraus, dass zur Zusammenlagerung der Kapsomere und zu deren korrekter Faltung zum Teil zelluläre Proteine notwendig sind (sogenannte Chaperone)[8] oder erst eine Assoziation mit Nukleinsäure zur Kapsidbildung führt.
Ausgehend von der Tatsache, dass eine Kapsidbildung spontan erfolgen kann und die Symmetrie des Ikosaeders besonders oft vorkommt, nahm man bisher an, dass die Kapsidstruktur der energetisch günstigste Zustand für die Kapsomere sei. Tatsächlich zeigen neuere Untersuchungen, dass Kapside eher einem metastabilen energetischen Zustand entsprechen.[9] Dies würde auch zum Teil erklären, warum Kapside sich bei der Ausschleusung des Virus aus der Zelle zunächst zusammenlagern, hingegen bei Eintritt in die Zelle die gleichen Kapside wieder spontan zerfallen, um die virale Nukleinsäure freizusetzen. Der energetisch instabilste und limitierende Schritt für das self-assembly eines ikosaedrischen Kapsids scheint der Einbau der letzten Kapsomere zur Komplettierung zu sein.[10] Dieser metastabile Zustand wird auch dadurch begünstigt, dass ein Kapsid seine Stabilität lediglich aus sehr schwachen Wechselwirkungen der Kapsomere gewinnt.[11]
Manche Kapside werden nach dem Zusammenbau auf der Außenseite oder auch der Innenseite (z. B. beim Kapsid des Hepatitis-B-Virus) durch mitverpacktes ATP und Phosphokinasen phosphoryliert, zum Teil auch durch zelluläre Enzyme glykosyliert; diese Modifikationen scheinen auch die Stabilität bzw. gewünschte Instabilität der Kapside zu beeinflussen.
Ein besonderes Merkmal mancher unbehüllter Viren oder der in vitro synthetisierten Kapside behüllter Viren ist die Möglichkeit zu kristallisieren. Diese Beobachtung führte schon in den 1940er Jahren zu Diskussionen über die Zuordnung von Viren zu den Lebensformen, da sonst nur unbelebte Stoffe die Eigenschaft der Kristallbildung zeigen. Kristallisierte Kapside sind bei der Erforschung der Virusstruktur durch die Röntgenstrukturanalyse unerlässlich.
Biologische Bedeutung von Kapsiden
Neben dem Schutz des viralen Genoms vor DNA- und RNA-spaltenden Enzymen (Nukleasen) und der Formgebung bei behüllten Viren haben Kapside einige besondere biologische Funktionen und Eigenschaften:
- Bei unbehüllten Viren bildet das Kapsid die Oberfläche eines Virions. Dadurch ist es direkt dem Angriff durch das Immunsystem ausgesetzt und wirkt als Antigen. Bei Viren ändern sich häufig die Oberflächenepitope und entgehen dadurch dem Immunsystem des Wirts, was jedoch bei nackten Kapsiden nur sehr eingeschränkt möglich ist, da etliche Veränderungen der Kapsidproteine auch zum Verlust der Stabilität oder einer Beeinträchtigung der self-assembly führen können. Unbehüllte Viren sind daher in der Regel weniger variabel in den Oberflächenepitopen als behüllte.
- Da regelmäßig angeordnete Proteine ein wesentlich stärkeres Antigen darstellen als unregelmäßig angeordnete, eignen sich Kapside besonders gut als Material für Impfungen.[12]
- Das Kapsid unbehüllter Viren vermittelt ebenfalls die Bindung an Rezeptoren der Zielzelle, um den Eintritt in die Zelle einzuleiten. Bei einigen behüllten DNA-Viren sorgt ein spezieller Transport des Kapsids an die Kernporen für das Eindringen des Virusgenoms in den Zellkern.
- Durch die Fähigkeit von Kapsiden, als Transportvehikel für Nukleinsäure in Zellen zu dienen, sind in vitro erzeugte Kapside, sogenannte Virus-like particles (VLPs), von besonderem Interesse in der Gentechnik und Gentherapie.
Quellen
Literatur
- D. M. Knipe, P. M. Howley (Hrsg.): Fields’ Virology. 5. Auflage. 2 Bände, Philadelphia 2007, ISBN 978-0-7817-6060-7.
- S. J. Flint, L. W. Enquist, V. R. Racaniello, A. M. Skalka: Principles of Virology. Molecular Biology, Pathogenesis, and Control of Animal Viruses. 2. Auflage. ASM-Press, Washington D.C. 2004, ISBN 1-55581-259-7.
- A. J. Cann: Principles of Molecular Virology. 3. Auflage. Academic Press, 2001, ISBN 0-12-158533-6.
- A. Granoff, R. G. Webster (Hrsg.): Encyclopedia of Virology. (Band 1–3). San Diego 1999, ISBN 0-12-227030-4.
- R. H. Cheng, T. Miyamura (Hrsg.): Structure-based study of viral replication. Singapore 2008, ISBN 978-981-270-405-4.
- Roya Zandi, David Reguera et al.: Origin of icosahedral symmetry in viruses. PNAS (2004) 101 (44): S. 15556–15560. PMID 15486087
Einzelnachweise
- Francis Crick, James Watson: Structure of Small Viruses. Nature (1956) 177: S. 473–475. PMID 13309339
- David L.D. Caspar: Structure of bushy stunt virus. Nature, 1956, doi:10.1038/177475a0.
- M. Newman, F. M. Suk, M. Cajimat, P. K. Chua, C. Shih: Stability and morphology comparisons of self-assembled virus-like particles from wild-type and mutant human hepatitis B virus capsid proteins. Journal of Virology. (2003) 77(24): S. 12950–12960. PMID 14645551
- Donald L. D. Caspar, Aaron Klug: Physical Principles in the Construction of Regular Viruses. Cold Spring Harbor Symposia on Quantitative Biology XXVII, Cold Spring Harbor Laboratory, New York 1962, S. 1–24.
- B. K. Ganser, S. Li, V. Y. Klishko et al.: Assembly and analysis of conical models for the HIV-1 core. Science (1999) 283 (5398): S. 80–83. PMID 9872746
- Andrea Thorn, Nicole Dörfel, et al.: RNA & Nucleocapsid (en) Coronavirus Structural Task Force an der Universität Hamburg. Abgerufen am 3. Juli 2021.(Die angebotene deutschsprachige Fassung ist nicht sehr empfehlenswert, sie hat sprachliche Schwächen)
- E. Hiebert, J. B. Bancroft, C. E. Bracker: The assembly in vitro of some small spherical viruses, hybrid viruses, and other nucleoproteins. Virology (1968) 3: S. 492–508. PMID 5651027
- J. R. Lingappa, R. L. Martin, M. L. Wong, D. Ganem, W. J. Welch, V. R. Lingappa: A eukaryotic cytosolic chaperonin is associated with a high molecular weight intermediate in the assembly of hepatitis B virus capsid, a multimeric particle. Journal of Cell Biology (1994) 125(1): S. 99–111. PMID 7908022 A Eukaryotic Cytosolic Chaperonin Is Associated with a High Molecular Weight Intermediate in the Assembly of Hepatitis B Virus Capsid, a Multimeric Particle.
- Robijn F. Bruinsma, William M. Gelbart: Viral Self-Assembly as a Thermodynamic Process. Physical Review Letters (2003) 90 (24): S. 248101 (e-pub) PMID 12857229
- H. D. Nguyen, V. S. Reddy, C. L. Iii: Deciphering the kinetic mechanism of spontaneous self-assembly of icosahedral capsids. Nano Lett. (2007) 7(2): S. 338–344. PMID 17297998
- P. Ceres, A. Zlotnick: Weak protein-protein interactions are sufficient to drive assembly of hepatitis B virus capsids. Biochemistry (2002) 41(39): S. 11525–11531. PMID 12269796
- Nadja Thönes, Anna Herreiner, Lysann Schädlich, Konrad Piuko, Martin Müller: A Direct Comparison of Human Papillomavirus Type 16 L1 Particles Reveals a Lower Immunogenicity of Capsomeres than Viruslike Particles with Respect to the Induced Antibody Response. J. Virol. (2008) 82(11): S. 5472–5485 PMC 2395182 (freier Volltext)
Weblinks
- Galerie verschiedener Viruskapside als molekulare Modelle und Röntgenstrukturanalyse (Memento vom 29. April 2007 im Internet Archive) (aus dem ICTV-Report)
- Weiterführendes Tutorial zur Triangulationszahl von Kapsiden
- Beispiele zur Berechnung von Kapsidstrukturen und Triangulationszahlen (Memento vom 5. Februar 2008 im Internet Archive)
- SIB: Virus symmetry and T number, auf: ViralZone