Ozonloch
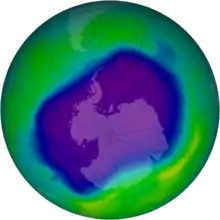
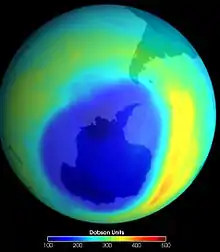
Als Ozonloch bezeichnet man eine starke Ausdünnung der Ozonschicht, wie sie 1985 erstmals am Südpol über der Antarktis festgestellt wurde, Anfang 2020 nach einem Bericht des Alfred-Wegener-Instituts zum ersten Mal auch über der Arktis (Nordpol).[2] Die Ursachen der Ozonzerstörung sind hauptsächlich radikalische Chloratome aus chlorierten organischen Verbindungen, die zusammenfassend als Fluorchlorkohlenwasserstoffe (FCKW oder CFCs) bezeichnet werden. Daneben sind Halon und auch teilbromierte und teilchlorierte Kohlenwasserstoffe (H-FBKW, H-FCKW), Bromchlormethan, Tetrachlorkohlenstoff, Methylbromid und Trichlorethan an der Zerstörung beteiligt. Die ausgedünnte Ozonschicht lässt mehr vom UV-B-Anteil der Sonnenstrahlung zum Erdboden durch: Ultraviolette Strahlung kann bei Lebewesen karzinogen wirken.
Halogenkohlenwasserstoffen, gewichtet nach
ihrem Ozonabbaupotential.[1]
Beobachtungsgeschichte
Erste Hinweise auf eine Schwächung der Ozonschicht über der Antarktis gab es bereits 1957, doch die Messungen der britischen Forschungsstation Halley Bay wurden weitgehend nicht beachtet.[3]
1974 warnten die Physikochemiker Mario J. Molina und Frank Sherwood Rowland, die Anreicherung der schwer abbaubaren FCKW in der Atmosphäre würde zu einer wesentlichen Abnahme der Ozonkonzentration führen, weltweit und ganzjährig – das Ozonloch hatte bis dahin niemand vorausgesehen.[4] Die beiden Forscher erhielten 1995 zusammen mit dem Atmosphärenchemiker Paul Crutzen den Nobelpreis für Chemie für die Aufklärung der Mechanismen, die zum Auf- und Abbau der Ozonschicht beitragen.[5]
Seit Anfang der 1980er Jahre tritt das Ozonloch jährlich auf: Innerhalb weniger Wochen nach dem Sonnenaufgang in der Antarktis bricht die Ozonkonzentration ein und erholt sich innerhalb weniger Monate. Ursache dieser Dynamik ist die Reaktion von Schadstoffen, die auf den Eiskristallen stratosphärischer Wolken gespeichert sind und nach der langen, kalten Polarnacht mit dem Ozon verdunsten. Dabei wird dieses abgebaut.
Die Größe des Einbruchs entwickelte sich innerhalb weniger Jahre von wenigen Prozent auf mehr als fünfzig Prozent. Betroffen ist der ganze Polarwirbel, eine Fläche von mehreren Millionen Quadratkilometern, wie die damals beginnende Fernerkundung eindrucksvoll illustrierte. Die dramatische Entwicklung und die zweifelsfreien wissenschaftlichen Beweise der Ursachen[6] führten schnell zu einem weltweiten Verbot von FCKW. Der US-Präsident Ronald Reagan und die britische Premierministerin Margaret Thatcher unterstützten 1987 die Einberufung einer internationalen Konferenz, auf der ein stufenweiser Abbau mehrerer industriell genutzter Chemikalien ausgehandelt und im Montrealer Protokoll verabschiedet wurde.
Die Photolyse der FCKW-Moleküle durch UV-C setzt nicht nur die schädlichen Halogen-Atome frei, sondern leitet auch den vollständigen Abbau des FCKW-Moleküls ein. Allerdings beträgt die Lebensdauer der meisten FCKW-Verbindungen durch diesen Prozess viele Jahrzehnte, da die UV-C-Strahlung der Sonne den größten Teil der Atmosphäre nicht erreicht. Daher dürfte sich das Ozonloch erst in der zweiten Hälfte des 21. Jahrhunderts schließen.[7]
Nach Auswertungen der Messungen aus dem Jahre 2012 wurde am Südpol zum ersten Mal von einer Umkehrung des Ozon-Trends gesprochen: Laut der Leitung des meteorologischen Observatoriums der Forschungsstation Neumayer III sei die Hauptursache dieser Trendumkehrung der Erfolg des weltweiten Verbots von FCKW.[8]
Im September 2014 veröffentlichte die Welt-Organisation für Meteorologie (WMO) einen Bericht: Das Ozonloch werde spätestens im Jahr 2050 kein Thema mehr sein, wenn der Trend anhielte, den die Forschung seit Jahren beobachte.[9]
Im Herbst 2015 teilte das Deutsche Zentrum für Luft- und Raumfahrt (DLR) mit, nach den jüngsten Daten sei das Ozonloch über der Antarktis (Südpol) ca. 2,5 Mio. Quadratkilometer größer als im Vorjahr und erreiche mit etwa 26 Mio. Quadratkilometern (mehr als die Fläche Nordamerikas) die größte Ausdehnung seit dem Rekordjahr 2006 (ca. 27 Mio. km²).[10][11]
Im Juni 2016 gaben Forscher bekannt, dass sich die Ozonschicht, wie seit Jahren vermutet, tatsächlich wieder erholt. Laut ihren Messungen hat sich das Loch im September um etwa 4 Mio. km² verringert, gegenüber dem Wendepunkt zur Jahrtausendwende. Nach Computersimulationen sei höchstens die Hälfte davon auf Wetterschwankungen zurückzuführen. Der Größenrekord vom Vorjahr sei maßgeblich auf den Ausbruch des Vulkans Calbuco zurückzuführen.[12][13]
Im Jahr 2017 erreichte das antarktische Ozonloch laut NASA mit rund 20 Mio. Quadratkilometern seine geringste Ausdehnung seit dem Jahr 1988; während ansonsten während des Peaks immer in zumindest einer Höhenschicht in der Stratosphäre eine Ozonkonzentration von Null geherrscht hatte, war dies laut den Wetterballons in diesem Jahr nicht der Fall. Als Ursache für diese geringe Ausdehnung nannte die NASA natürliche Schwankungen durch unüblich hohe Stratosphärentemperaturen über der Antarktis. Dadurch wurde die Wolkenbildung über der Antarktis vermindert, welche die Ausdünnung der Ozonschicht begünstigt. Diese Wolken sind nämlich ein wichtiger Ausgangspunkt für chemische Reaktionen, bei denen dann mit Hilfe der als Katalysatoren dienenden Stoffe Chlor und Brom die Zerstörung des Ozons erfolgt. Das schwächer ausgeprägte Ozonloch sei hingegen kein Signal für eine erhoffte schnellere Erholung. Wissenschaftler erwarten die weitgehende Erholung des UV-Schutzes bis etwa 2070; derzeit sei die Konzentration an ozonschädlichen Substanzen in der Atmosphäre noch zu hoch.[14][15][16]
Außerhalb der Antarktis und Arktis (zwischen dem 60. Breitengrad Nord und dem 60. Breitengrad Süd) ist eine Erholung der Ozonkonzentration bislang nicht zu beobachten. Während dort die Ozonkonzentration in der oberen Stratosphäre seit 1998 wieder steigt, nimmt sie in der unteren Stratosphäre kontinuierlich weiter ab. In der unteren Stratosphäre befindet sich der größte Teil der Ozonschicht. In Summe wurde daher die Ozonschicht dünner. Die Ursachen für dieses Phänomen sind bisher noch nicht erforscht.[17]
Forschungsgeschichte des Ozonabbaus
Dass in der oberen Atmosphäre mehr Ozon vorhanden sein muss, als am Boden chemisch nachzuweisen war, schloss Walter Noel Hartley 1881 aus dem Vergleich des Absorptionsspektrums des Ozons im UV-B-Bereich (Hartley-Bande) mit dem dort steil abfallenden Sonnenspektrum. Quantitative Messungen wurden um 1930 mit den Dobson-Spektrophotometer Routine. Zeitgleich entwickelte Sydney Chapman einen ersten Reaktionsmechanismus, der die relative Stabilität der Ozonschicht erklärte, den Ozon-Sauerstoff-Zyklus.
Demnach wird das Ozon der Stratosphäre durch Ultraviolettstrahlung der Sonne sowohl gebildet als auch gespalten. Das abgespaltene Sauerstoffatom verbindet sich meist wieder mit einem Sauerstoffmolekül zu Ozon, wobei ein Verlust durch gelegentliche Reaktionen zwischen Sauerstoffatomen und Ozon auftritt, der das Anwachsen der Ozonkonzentration begrenzt.
Dieses Modell sagte korrekt vorher, dass im Höhenbereich der UV-C-Absorption (30–60 km) die Ozonkonzentration mit der Luftdichte abnimmt, was Anfang der 1970er Jahre mit Höhenforschungsraketen bestätigt wurde. Die Ursache ist, dass die Reaktion des Sauerstoffatoms, welche zurück zu Ozon führt,
- O + O2 → O3,
eigentlich eine trimolekulare Reaktion ist: Es ist ein dritter Stoßpartner M nötig, der die Bindungsenergie als kinetische Energie abführt:
- O + O2 + M → O3 + M (M = N2 oder O2)
Je kleiner (mit zunehmender Höhe) die Konzentration von M, desto länger ist das Sauerstoffatom Verlustreaktionen ausgesetzt.
Bereits 1930 wurde aber der Makel dieses Modells offensichtlich: Es geht von einer Ozonschicht aus, die etwa dreimal so dick sein sollte, wie sie tatsächlich ist. Daher wurde nach weiteren Verlustprozessen gesucht. Zunächst vermutete man HOx (HO, HO2), wobei das H-Atom aus Verbindungen stammt, die in der Troposphäre genügend langsam abgebaut werden, so dass sie bis in die Stratosphäre gelangen: H2, H2O und CH4. In der unteren Stratosphäre, wo UV-C nicht hinreicht, werden sie durch O(1D) aufgespalten, z. B.
- H2O + O(1D) → 2 HO•.
O(1D) ist das elektrisch angeregte Sauerstoffatom, das bei der Photolyse von Ozon entsteht,
- O3 + UV-B → O2 + O(1D),
das aber bei jedem Stoß Gefahr läuft, zu einem O-Atom im elektronischen Grundzustand abgeregt zu werden, z. B.
- O(1D) + O2 → O(3P) + O2.
Die Anregungsenergie wird dabei in kinetische Energie der Reaktionsprodukte umgesetzt, also in Wärme.
In der oberen Stratosphäre werden diese Verbindungen von UV-C gespalten, z. B.
- CH4 + UV-C → H• + •CH3
und dann in rascher Folge
- •CH3 + O2 → CH3OO•
- CH3OO• + O3 → CH3O• + 2 O2
- CH3O• + O2 → HCHO + HOO•
- HCHO + UV-A → H• + HCO• (alternativ → H2 + CO)
- HCO• + O2 → HOO• + CO
- H• + O2 → HOO•
Die entstehenden Hydroperoxyl-Radikale, HOO•, fangen fortan O-Atome ab, die sonst Ozon bilden würden:
- HOO• + O → HO• + O2,
ohne sich dabei zu verbrauchen, denn HO• bildet unter weiterem Ozonabbau wieder HOO•:
- HO• + O3 → HOO• + O2.
Dieser katalytische Kreisprozess erklärt zu einem guten Teil die geringeren beobachteten Ozon-Säulenhöhen.
Ein weiterer Stoff, der in die Stratosphäre gelangen kann und dort Radikale bildet, ist Lachgas, N2O. Auch dieses wird durch UV-C photolysiert oder reagiert mit O(1D). Es bilden sich die Stickoxide NO und NO2, die miteinander im Gleichgewicht stehen:
- NO + O3 → NO2 + O2
- NO2 + sichtbares Licht → NO + O.
Dieses Reaktionspaar stellt quasi eine beschleunigte Version der Ozonphotolyse dar, denn das sichtbare Licht der Sonne ist viel intensiver als das UV-B-Licht, das für die Photolyse von Ozon nötig ist. Zum Ozonabbau tragen Stickoxide indirekt bei, da ja die O-Atome nicht vollständig Ozon zurückbilden (siehe oben).
Crutzen warnte 1970 vor dem Eintrag von Stickoxiden durch Überschallflugzeuge, wie die Concorde (damals in großen Stückzahlen geplant), die in der unteren Stratosphäre fliegen.
Im Januar 2020 zeigten Forscher, dass ozonabbauende Substanzen (ODS) den Großteil der arktischen Erwärmung zwischen 1955 und 2005 verursacht haben. Dazu nutzten sie ein Klimamodell, mit welchem sie zwei Szenarien untersuchten: in eines wurden ODS, sowie alle natürlichen und menschenverursachten Emissionen eingespeist, in das andere nur letztere. ODS verursachten demnach etwa die Hälfte des arktischen Eisverlusts. ODS werden seit 1989 durch das Montreal-Protokoll verboten, wodurch sich das Ozonloch zurückbildet.[18][19]
Der chemische Ablauf des Ozonabbaus
Chloratome und andere Radikale X• führen zu zusätzlichen Verlusten, meist nach folgendem katalytischen Kreisprozess:
- X• + O3 → XO• + O2
- XO• + O → X• + O2
Dabei ist die zweite Reaktion geschwindigkeitsbestimmend, denn O-Atome sind selbst tagsüber vergleichsweise knapp. Daher findet sich z. B. Chlor in der Stratosphäre überwiegend nicht als Cl•, sondern als ClO•. Insbesondere in der Dämmerung reagieren die (ggf. verschiedenen) Radikale XO• untereinander, z. B.
- ClO• + BrO• → Cl• + Br• + O2
Auch in diesem Fall werden die beiden Radikale X• wieder freigesetzt. Für manche andere Kombinationen von XO• ist das nicht so, wichtige Beispiele sind
- ClO• + ClO• → Cl2 + O2 und
- ClO• + NO2• → ClONO2
Die dabei entstehenden Reaktionsprodukte werden Reservoirspezies genannt, denn in ihnen sind die Radikale nur vorübergehend gebunden, hauptsächlich nachts, während sie tagsüber mehr oder weniger schnell photolysiert werden. Während der langen Dämmerung der Polarnacht entsteht eher das langlebigere Chlornitrat ClONO2, denn es ist UV-C nötig, um es zu spalten, während für Chlor Cl2 das bei niedrigem Sonnenstand viel intensivere UV-A ausreicht.
Für das ausgeprägte Ozonloch gerade im Frühjahr ist die nächtliche Bildung von Polar Stratospheric Clouds (PSC, polaren Stratosphärenwolken) verantwortlich. Normalerweise gibt es in der Stratosphäre keine Wolken, da sie zu trocken ist. Bei den besonders tiefen Temperaturen der Polarnacht, insbesondere der südlichen, bis unter −80 °C, können jedoch Reste von Wasserdampf H2O zusammen mit Salpetersäure HNO3 ausfrieren. Die Salpetersäure entsteht aus Nitraten, wie obigem Chlornitrat:
- ClONO2 + H2O → HClO + HNO3,
wobei Halogenverbindungen, wie hier die Hypochlorige Säure HClO, in der Gasphase bleiben und beim Sonnenaufgang schnell gespalten werden. Plötzlich gibt es sehr viele Ozon zerstörende Radikale. Erst nach und nach verdampfen die PSC und bringen die Stickstoffverbindungen zurück in die Luft, die mit den Chlorradikalen Reservoirspezies bilden und so den Ozonabbau dämpfen. Laut Forschungsergebnissen der NASA kann der Ozonabbau durch FCKW nur unzureichend mit einer Freisetzung von Chlorradikalen erklärt werden.[20][21]
Erscheinungsbild an Süd- und Nordpol
Die regelmäßig starke Ausprägung des antarktischen Polarwirbels ist die Hauptursache für die dort mit bis unter 190 K (ca. −80 °C) sehr niedrigen Temperaturen in seinem Zentrum.
Der arktische Polarwirbel hingegen wird meist nicht kalt genug für Stratosphärenwolken, sodass sich dort in der Regel bislang kein deutliches Ozonloch bildet; das im März 2020 vom Alfred-Wegener-Institut über der Arktis auf 20 Mio. Quadratkilometern für zwei Wochen festgestellte Ozonloch sei auf einen in dieser Saison dort besonders kräftigen Polarwirbel und niedrige Temperaturen in der Stratosphäre zurückzuführen.[2]
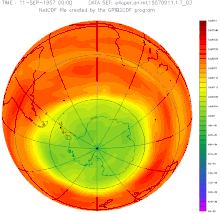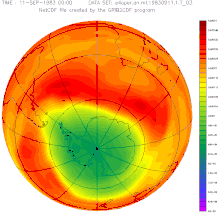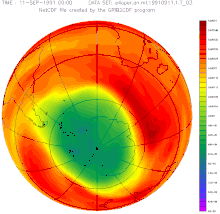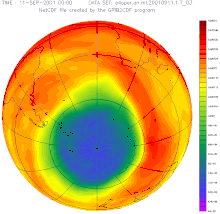
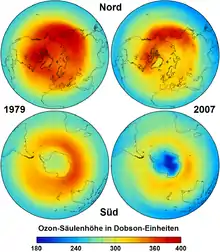
Die nebenstehenden vier Abbildungen zeigen oben jeweils die Nordhalbkugel, unten die Südhalbkugel, links die farbkodierten Jahresmittel der Ozon-Säulenhöhe für 1979 (vor der Entdeckung des Ozonlochs), rechts für 2007.
Natürliche Halogenverbindungen
Meersalz (NaCl) ist wasserlöslich und wird aus der Atmosphäre ausgewaschen, bevor es die Stratosphäre erreicht.
Pflanzen liefern dagegen einen messbaren Beitrag an ozonschädigenden Verbindungen. Kreuzblütengewächse produzieren Methylbromid, das ca. 80-mal schädlicher[22] als FCKW ist. Allein der Raps erzeugt 6600 Tonnen im Jahr, das sind 15 Prozent der Menge, die immer noch industriell hergestellt wird. Daneben wird Methylbromid, das ehemals von Bauern auch zur Schädlingsbekämpfung auf Feldern unter Planen eingesetzt wurde, auch zur Begasung von internationalen Obst-Transporten und Möbeltransporten gegen Schädlinge verwendet. Immergrüne Bäume und Kartoffeln synthetisieren dagegen Methylchlorid.[23]
Auch bei Vulkanausbrüchen entweichen Halogenverbindungen: Während Chlorwasserstoff größtenteils wie Meersalz ausgewaschen wird, können Bromverbindungen die Ozonschicht zumindest lokal beeinträchtigen. Bei einem Ausbruch eines Supervulkans kommt es zu einer massiven Schädigung der Ozonschicht.[24] Der letzte solche Ausbruch fand vor 74.000 Jahren statt.
Aufgrund von Forschungsergebnissen der Umweltphysiker der Universität Heidelberg vermuten Wissenschaftler, dass die Ozonschicht eventuell durch natürliche Chlor-, Brom- und möglicherweise Iodverbindungen geschädigt wird, die vor allem in den Küstenbereichen der Ozeane von Wasserpflanzen und Mikroorganismen gebildet werden. Ein Forschungsprojekt soll die natürlichen Quellen halogenierter Kohlenwasserstoffe und den atmosphärischen Transport und Abbau dieser ozonschädlichen Verbindungen untersuchen.[25] Inzwischen erhärteten Untersuchungen in Küstengewässern und in der Atmosphäre über den Gewässern im Rahmen eines Forschungsprojektes diese Vermutungen.[26]
Distickstoffmonoxid („Lachgas“) hat mittlerweile die Fluorchlorkohlenwasserstoffe (FCKW) als bedeutendste Quelle ozonschädlicher Emissionen des 21. Jahrhunderts abgelöst.[27]
Literatur
- Joe C. Farman et al.: Large losses of total ozone in Antarctica reveal seasonal ClOx/NOx interaction. In: Nature, Band 315, 1985, S. 207–210, doi:10.1038/315207a0.
- Martin Dameris, Thomas Peter, Ulrich Schmidt, Reinhard Zellner: Das Ozonloch und seine Ursachen, in: Chemie in unserer Zeit 2007, 41, 152–168; doi:10.1002/ciuz.200700418.
- M. Z. Jacobson: Atmospheric Pollution: History, Science and Regulation, Cambridge Univ. Press, 2012, ISBN 978-1-107-02161-7, Kap. 11: Global Stratospheric Ozone Reduction (ppt-Präsentation).
- Marcel Nicolet: Stratospheric Ozone: An Introduction to its Study, Reviews of Geophysics and Space Physics, Vol. 13, 1975, doi:10.1029/RG013i005p00593 – eine Zusammenfassung des Wissensstandes zur Ozonschicht zu der Zeit der FCKW-Warnung durch Molina und Rowland.
- Reiner Grundmann: Transnationale Umweltpolitik zum Schutz der Ozonschicht. USA und Deutschland im Vergleich. Campus Verlag, Frankfurt a. M. 1999, ISBN 3-593-36222-8.
- World Meteorological Organization: Scientific assessment of ozone depletion 2002, Global Ozone Research and Monitoring Project – Report No. 47, WMO, Genf 2003, ISBN 92-807-2261-1.
- NASA Panel for Data Evaluation: Chemical Kinetics and Photochemical Data for Use in Atmospheric Studies, Evaluation No. 14, JPL Publication 02-25, 2003, online (PDF; 3,2 MB).
- Konrad Mauersberger: Das Ozonloch über dem Südpol. In: Die Geowissenschaften. Band 9, Heft 11, 1991, doi:10.2312/geowissenschaften.1991.9.352. S. 352–356.
- Wolf-Andreas Liebert: Wissenstransformationen: Handlungssemantische Analysen von Wissenschafts- und Vermittlungstexten. Walter de Gruyter, Berlin 2002, ISBN 978-3-11-017276-8, Online-Auszug – Das Buch gibt die Ozonlochdebatte der 1980er Jahre wieder und analysiert die Veränderung, welche Wissen bei der Vermittlung aus dem wissenschaftlichen in den populärwissenschaftlichen Raum erfährt.
- Greenpeace : Ozonschicht und Ozonloch, 1996.
Siehe auch
Weblinks
- Centre for Atmospheric Science, Universität Cambridge, GB: Ozonloch – Geschichte und Wissenschaft
- Datenarchiv der NASA zum Ozonloch (englisch)
- Täglich aktualisierte Karten der Ozonverteilung auf der nördlichen Halbkugel, vom „Ozone Mapping Centre“ der World Meteorological Organization (englisch)
- Presseerklärung zur Nobelpreisverleihung an Mario J. Molina, Frank Sherwood Rowland und Paul J. Crutzen
Einzelnachweise
- Ross J. Salawitch, David W. Fahey, Michaela I. Hegglin, Laura A. McBride, Walter R. Tribett, Sarah J. Doherty: Twenty questions and answers about the ozone layer, 2018 update : Scientific assessment of ozone depletion, 2018. Hrsg.: World Meteorological Organization. Genf, Schweiz 2019, ISBN 978-1-73293-172-5, S. 9 (englisch, noaa.gov).
- Nordpol – Alfred-Wegener-Institut berichtet von großem Ozonloch über der Arktis. Abgerufen am 28. März 2020 (deutsch).
- Bernhard Pötter: In letzter Minute. Artikel vom 6. September 2007 im Portal zeit.de (abgerufen am 17. April 2018)
- Mario J. Molina und F. S. Rowland: Stratospheric sink for chlorofluoromethanes: chlorine atom-catalysed destruction of ozone. In: Nature. Band 249, Nr. 5460, 1974, S. 810–812, doi:10.1038/249810a0.
- Spektrum der Wissenschaft: Mechanismen des Ozonschwunds in der Stratosphäre, Dez. 1995 (Monatsspektrum).
- Interview mit Nobelpreisträger Paul Crutzen, geführt von Astrid Gräslund im Juni 2000 (ab 16:30).
- Richard L. McKenzie et al.: Ozone Depletion and Climate Change: Impacts on UV Radiation, Photochem Photobiol Sci, 2011, S. 182–198, doi:10.1039/c0pp90034f: In mittleren bis hohen Breiten wird UV-B noch gegen Ende des Jahrhunderts um 5 bis 20 % niedriger sein als 1980.
- sueddeutsche.de, 13. Juni 2013: Das Ozonloch schließt sich.
- Hessischer Rundfunk:Liebling, wir haben das Ozonloch geschrumpft, Vom Ende einer Bedrohung (Memento vom 26. Februar 2015 im Internet Archive).
- Badische-zeitung.de, 24. Oktober 2015: Das Ozonloch wächst wieder (26. Oktober 2015).
- Zeit.de, 26. Oktober 2015, Interview Dagny Lüdemann mit Michael Bittner (DLR): „So ein gigantisches Ozonloch hat uns überrascht“ (26. Oktober 2015).
- Entscheidender Beweis: Das Ozonloch schließt sich. In: spiegel.de, 30. Juni 2016.
- Susan Solomon, Diane J. Ivy, Doug Kinnison, Michael J. Mills, Ryan R. Neely: Emergence of healing in the Antarctic ozone layer. In: Science. Band 353, Nr. 6296, 15. Juli 2016, S. 269–274.
- NASA: Ozone hole smallest it's been since 1988. In: CNET. (cnet.com [abgerufen am 3. November 2017]).
- Sara Blumberg: Warm Air Helped Make 2017 Ozone Hole Smallest Since 1988. In: NASA. 2. November 2017 (nasa.gov [abgerufen am 3. November 2017]).
- Ozonloch so klein wie seit Jahrzehnten nicht mehr. In: Spektrum der Wissenschaft, 4. November 2017. Abgerufen am 4. November 2017.
- William T. Ball et al.: Evidence for a continuous decline in lower stratospheric ozone offsetting ozone layer recovery. In: Atmospheric Chemistry and Physics. Band 18, 2018, S. 1379–1394, doi:10.5194/acp-18-1379-2018.
- Closing the Ozone Hole Helped Slow Arctic Warming (en). In: Scientific American. Abgerufen am 1. Juli 2020.
- L. M. Polvani, M. Previdi, M. R. England, G. Chiodo, K. L. Smith: Substantial twentieth-century Arctic warming caused by ozone-depleting substances. In: Nature Climate Change. 10, Nr. 2, Februar 2020, S. 130–133. bibcode:2020NatCC..10..130P. doi:10.1038/s41558-019-0677-4.
- Francis D. Pope, Jaron C. Hansen, Kyle D. Bayes, Randall R. Friedl, Stanley P. Sander: Ultraviolet Absorption Spectrum of Chlorine Peroxide, ClOOCl. In: The Journal of Physical Chemistry A. 111, 2007, S. 4322, doi:10.1021/jp067660w.
- Quirin Schiermeier: Chemists poke holes in ozone theory. 26. September 2007, abgerufen am 15. Dezember 2018 (englisch).
- https://www.deutschlandfunk.de/ausstieg-aus-dem-methylbromid.697.de.html?dram:article_id=71795
- Spektrum der Wissenschaft: Umweltgifte vom Gabentisch der Natur, Juni 2005.
- Spektrum der Wissenschaft: Die Urgewalt der Supervulkane, August 2006.
- Schädigen Halogenverbindungen aus natürlichen Quellen die Ozonschicht? IDW-Online 4. November 2011.
- Küstengewässer produzieren ozonschädliche Halogenverbindungen IDW-Online 1. Februar 2012.
- A. R. Ravishankara et al.: Nitrous Oxide (N2O): The Dominant Ozone-Depleting Substance Emitted in the 21st Century. In: Science. Epub, 2009. PMID 19713491.