Hypochlorite
Ein Hypochlorit ist ein Salz (zum Beispiel als Natriumhypochlorit) der Hypochlorigen Säure HClO (auch Unterchlorige Säure). Es enthält das Ion ClO−. Chlor liegt hierbei in der Oxidationsstufe +1 vor.
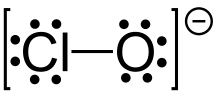
Die organischen Hypochlorite R–OCl sind sehr instabil.[1]
Gewinnung und Darstellung
Hypochlorit entsteht neben Chlorid bei der Einleitung von Chlor in wässrige Alkalihydroxidlösungen:
Eigenschaften
Hypochlorite sind unbeständig. Beispiel: Durch alkalische Katalyse zerfällt Natriumhypochlorit zu Natriumchlorid und Singulett-Sauerstoff (rote Phosphoreszenz):
In Lösung disproportioniert Hypochlorit nach und nach zu Chlorat und Chlorid:
Verwendung
Hypochlorite werden zum Bleichen und Desinfizieren verwendet, siehe auch Javelwasser („Eau de Javel“, eine wässrige Lösung von Kaliumhypochlorit) und „Eau de Labarraque“ (wässrige Lösung von Natriumhypochlorit).[2] Hypochlorit-Lösungen werden auch zum Desodorieren von Abwässern chemischer Produktionsprozesse benutzt.[3] Weiterhin sind sie Bestandteil des „respiratory burst“ im Rahmen der zellulären Abwehr von Mikroorganismen. Dort werden sie zum Beispiel von der neutrophilen Myeloperoxidase gebildet und ins Phagosom abgegeben.[4]
Im Labor kann Hypochlorit dazu genutzt werden, durch die Haloform-Reaktion Chloroform herzustellen.
Warnhinweis
Reinigungs- und Desinfektionsmittel, die Hypochlorite und Chloride enthalten, sollten niemals zusammen mit sauren Reinigern (z. B. Bioreiniger, die Essigsäure enthalten) eingesetzt werden, weil dann giftiges Chlorgas (Cl2) frei wird:[5]
Weblinks
Einzelnachweise
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 3: H–L. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1983, ISBN 3-440-04513-7, S. 1820.
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 569.
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 2: Cm–G. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1981, ISBN 3-440-04512-9, S. 898–899.
- G. Löffler, P. Petrides (Herausgeber): Biochemie und Pathobiochemie, Springer Medizinverlag Heidelberg 2007, S. 974.
- Versuchsprotokoll: Reaktion von Sanitätsreinigern