Rhodamine
Rhodamine sind fluoreszierende Farbstoffe aus der Gruppe der kationischen Farbstoffe. Die Struktur der Rhodamine leiten sich von Xanthen ab. Sie sind sowohl eine Untergruppe der Xanthenfarbstoffe, als auch der Triphenylmethanfarbstoffe. Die bekanntesten Vertreter sind u. a. Rhodamin 6G, Rhodamin B, Rhodamin 123, Texas Red (Sulforhodamin 110), 5-TAMRA, 5-TAMRA-SE und TMRM+. Je nach Struktur fluoreszieren Rhodamine vom gelb-grünen bis in den orange-roten Spektralbereich.
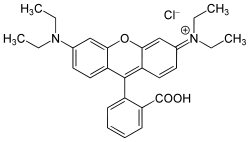
(9-(2-Carboxyphenyl)-3,6-bis(diethylamino)xanthyliumchlorid)
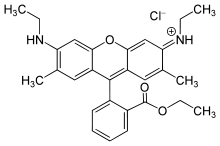
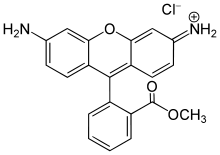
Die meisten Rhodamine haben wie viele Laserfarbstoffe eine Quantenausbeute nahe 100 %. Die Quantenausbeute ist stark vom Lösungsmittel abhängig und beträgt z. B. 95 % für Rhodamin 6G in Ethanol[1], d. h. von 100 absorbierten Photonen werden 95 in Fluoreszenzphotonen umgewandelt. Des Weiteren ist die Wahrscheinlichkeit eines Spin-Flips (vom Singulettzustand in den Triplettzustand) sehr gering, so dass Rhodamine sich nur selten im langlebigen Triplettzustand befinden, in dem sie nicht fluoreszieren.
Verwendung
Rhodamine werden u. a. eingesetzt als Farbstoffe für Papier und Textilien, in Leuchtpigmenten, in Farbstofflasern, sowie in der Zell- und Molekularbiologie (TRITC), wo sie z. B. als Marker bzw. Label für die Fluoreszenzmikroskopie und die Einzelmolekülfluoreszenzspektroskopie dienen.[2] Rhodamine wurden früher auch als Farbstoffe für hydrogeologische Färbeversuche genutzt.[3] Heutzutage wird darauf jedoch verzichtet, da Rhodamine als potentiell karzinogen, mutagen und ökotoxisch eingestuft werden: Rhodamin B wirkt auf tierische Wasserorganismen wie Daphnien bei Konzentrationen von 100 mg/l akut giftig.[4][5] Rhodamin B, insbesondere wenn chemisch rein, ist jedoch etwas weniger mutagen und erbgutschädigend als Rhodamin 6G.[6]
Einzelnachweise
- Douglas Magde, Roger Wong, Paul G. Seybold: Fluorescence Quantum Yields and Their Relation to Lifetimes of Rhodamine 6G and Fluorescein in Nine Solvents: Improved Absolute Standards for Quantum Yields. In: Photochemistry and Photobiology. Volume 75, Issue 4, 2002, S. 327–334.
- Alexander P. Demchenko (Hrsg.): Advanced Fluorescence Reporters in Chemistry and Biology I: Fundamentals and Molecular Design (Springer Series on Fluorescence). Springer, Berlin, Heidelberg 2010, ISBN 978-3-642-04700-8, S. 49 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- Werner Käß, Horst Behrens: Tracing technique in geohydrology. A. A. Balkema Publishers, Rotterdam 1998, ISBN 978-90-5410-444-5, S. 18 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- A. Kranjc (Hrsg.): Tracer Hydrology 97: Proceedings of the 7th International Symposium on Water Tracing. A. A. Balkema Publishers, Rotterdam 1997, ISBN 978-90-5410-875-7, S. 71 ff. (eingeschränkte Vorschau in der Google-Buchsuche).
- P. Brandt: Berichte zur Lebensmittelsicherheit. Bundesamt für Verbraucherschutz und Lebensmittelsicherheit 2005, Seite 8.
- E. R. Nestmann, G. R. Douglas, T. I. Matula, C. E. Grant, D. J. Kowbel: Mutagenic activity of rhodamine dyes and their impurities as detected by mutation induction in Salmonella and DNA damage in Chinese hamster ovary cells. In: Cancer Research. Band 39, Nummer 11, November 1979, S. 4412–4417, PMID 387214. (PDF).
Weblinks
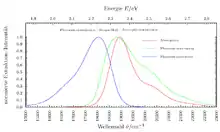
Absorptions- und Emissionsspektrum (Lösungsmittel Ethanol) von: