Amidosulfonsäure
Amidosulfonsäure ist eine farblose kristalline Substanz, die in Analogie zum Sulfamid – dem Diamid der Schwefelsäure – als das Monoamid der Schwefelsäure aufgefasst werden kann. Die Salze der Amidosulfonsäure werden Amidosulfonate oder Sulfamate genannt.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
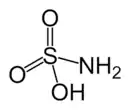 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Amidosulfonsäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | H2NSO3H[1] | |||||||||||||||
| Kurzbeschreibung |
farb- und geruchlose, orthorhombische Kristalle[2] oder Pulver[3] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 97,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
2,13 g·cm−3[4] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| pKS-Wert |
~1[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Herstellung
Die Herstellung von Amidosulfonsäure erfolgt aus Harnstoff, Schwefelsäure und Dischwefelsäure:[1]
Eigenschaften
Amidosulfonsäure bildet farblose bis weißlich gelbe Kristalle, die bei 205 °C unter beginnender Zersetzung und heftiger Rauchentwicklung schmelzen und sich gut in Wasser lösen. Die Lösung reagiert sauer. Aufgrund der Säureeigenschaften wirkt sie bei Direktkontakt reizend und ätzend auf Augen und Haut. Amidosulfonsäure ist nicht hygroskopisch und daher als Urtitersubstanz einsetzbar.
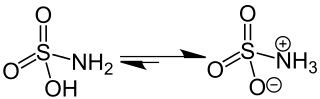
Die Struktur der Amidosulfonsäure kann durch die Formel +H3N-SO3− beschrieben werden. Sie liegt somit als Zwitterion vor. Die tautomere Form H2N-SO2(OH) existiert im Festkörper nicht.
Verwendung
Amidosulfonsäure in Konzentrationen von 10–15 %, oft 14 %, ist (meist neben Phosphorsäure oder Citronensäure) ein Bestandteil von Entkalkern und Sanitärreinigern, im Labor wird sie als Urtitersubstanz und zum Zerstören von Nitrit verwendet:
In der Galvanotechnik dient Amidosulfonsäure zum Einstellen des pH-Wertes von Nickelsulfamatbädern auf pH 3,9 bis 4,2. Auch wird eine Lösung aus Amidosulfonsäure mit Natriumlaurylsulfat bei 35 bis 40 °C zum Aktivieren einer Nickelschicht benutzt.
Durch Reaktion von Amidosulfonsäure mit Cyclohexylamin wird Natriumcyclamat, ein künstlicher Süßstoff, hergestellt.
Das Ammoniumsulfamat ist ein wichtiges Flammschutzmittel.
Bestimmung
Der Gehalt einer wässrigen Amidosulfonsäurelösung kann mittels Titrationsanalyse bestimmt werden. Die Reaktionsgleichung dieser Säure-Base-Titration lautet:
Einzelnachweise
- Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 487.
- Eintrag zu Sulfamidsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Mai 2014.
- Eintrag zu Sulfamidsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Datenblatt Amidosulfonsäure (PDF) bei Merck, abgerufen am 19. Januar 2011.
- Eintrag zu Sulphamidic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
