Chlorsäure
Chlorsäure ist eine der Sauerstoffsäuren des Chlors, dazu gehören außerdem Perchlorsäure, Hypochlorige Säure und Chlorige Säure. Chlorsäure ist als Reinstoff nicht beständig und existiert nur in verdünnter Form. Die farblose Lösung findet als starkes Oxidationsmittel Verwendung. Die Salze der Chlorsäure, die Chlorate, besitzen zum Teil große technische Bedeutung.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
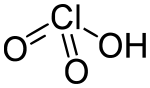 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Chlorsäure | |||||||||||||||||||||
| Andere Namen |
Chlor(V)-säure | |||||||||||||||||||||
| Summenformel | HClO3 | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchlose, nur als wässrige Lösung existierende Säure[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 84,46 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
nur in wässriger Lösung bis maximal 40 % existent[2] | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
40 °C (Zersetzung der 18%igen Lösung)[2] | |||||||||||||||||||||
| pKS-Wert |
−2,7[3] | |||||||||||||||||||||
| Löslichkeit |
sehr gut in Wasser[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Eigenschaften
Physikalische Eigenschaften
Chlorsäure besitzt gemäß dem VSEPR-Modell eine trigonal-pyramidale Struktur.
Chemische Eigenschaften
Chlorsäure ist eine starke Säure (pKS = ca. −2,7[3]), die in Wasser vollständig in Ionen dissoziiert vorliegt. Umgekehrt besitzen die Chlorationen nur eine geringe Neigung, Protonen anzulagern, so dass sie sich in Wasser mit annähernd neutralem pH-Wert lösen.
Das Chloratom der Chlorsäure besitzt die Oxidationsstufe +V. Es hat als typisches Nichtmetall eine starke Tendenz, in chemischen Reaktionen Elektronen aufzunehmen und in eine niedrigere, stabile Oxidationszahl (−I, 0, +I oder +III) überzugehen. Somit ist Chlorsäure ein starkes Oxidationsmittel mit einem hohen Redoxpotential. Allerdings kann Chlorsäure auch zur Perchlorsäure (Oxidationszahl: +VII) oxidiert werden. Allgemein steht die Chlorsäure mit anderen Sauerstoffsäuren des Chlors, sowie Chlordioxid und Chlor über Disproportionierungs- und Komproportionierungsreaktionen im Gleichgewicht. Die Oxidationswirkung ist im Sauren ausgeprägter als im Alkalischen, was sich in einem höheren Redoxpotential äußert. Für die einzelnen Zahlenwerte ergeben sich[4]:
| Redox-Paar | Oxidationsstufe | Normalpotential bei pH = 0 | Normalpotential bei pH = 14 |
|---|---|---|---|
| HClO4 /HClO3 | (+VII)/(+V) | +1,19 V | +0,36 V |
| HClO3 /ClO2 | (+V)/(+IV) | +1,18 V | ? |
| HClO3 /HClO2 | (+V)/(+III) | ? | ? |
| HClO3 /HClO | (+V)/(+I) | +1,43 V | +0,50 V |
| HClO3 /Cl2 | (+V)/(0) | +1,47 V | +0,48 V |
| HClO3 /Cl− | (+V)/(-I) | +1,45 V | +0,62 V |
Gewinnung und Darstellung
Die Darstellung von Chlorsäure geht von Chlor aus, das zunächst in Chlorat überführt wird. Die Chlorationen werden anschließend zur Chlorsäure protoniert. Chlor wird zuerst in heiße Natronlauge eingeleitet. Dabei disproportioniert es in einer Gleichgewichtsreaktion in Chloridionen und Hypochloritionen (1). Anschließend wird die Lösung teilweise angesäuert, so dass ein Anteil der Hypochloritionen in Hypochlorige Säure übergeht (2). Die Hypochlorige Säure kann als starkes Oxidationsmittel Hypochlorite zu Chloraten oxidieren (3). Da im 3. Schritt die Protonen regeneriert werden, müssen beim 2. Schritt nur sehr wenig Protonen zum Ansäuern eingesetzt werden. Die Reaktionsgleichungen für die einzelnen Schritte lauten:
- (1)
- (2)
- (3)
Brutto:
Technisch erfolgt die Herstellung von Natriumchlorat durch die Elektrolyse einer wässerigen Kochsalzlösung. Dabei entsteht gasförmiger Wasserstoff, Chlor und Natronlauge. Leitet man das Chlorgas wieder zurück in die Lösung bzw. lässt es gar nicht erst gasförmig entweichen, kann es wie oben gezeigt zu einer Natriumchloratlösung reagieren.
Die Herstellung von Chlorsäure erfolgt durch Ansäuern von Lösungen, die Chlorationen enthalten. Geht man von einer Bariumchloratlösung aus und versetzt sie mit verdünnter Schwefelsäure, so fällt das schwerlösliche Bariumsulfat aus. In Lösung verbleibt nur die Chlorsäure.[5]
Durch wasserentziehende Mittel kann Chlorsäure bis zu einer Konzentration von 40 % aufkonzentriert werden. Höher konzentrierte Lösungen zersetzen sich unter Bildung von Chlor, Chlordioxid und Perchlorsäure:
Verwendung
Eine handelsübliche Mischung von 40%iger Chlorsäure mit rauchender (38%iger) Salzsäure nennt man Euchlorin (nicht zu verwechseln mit dem gleichnamigen Mineral). Die Kombination aus starken sauren und oxidierenden Eigenschaften kann dem Aufschluss von ansonsten unlöslichen Mineralien und der Zerstörung organischer Stoffe dienen. Dabei geht die Oxidationswirkung nicht nur von der Chlorsäure selbst aus, sondern auch von Chlor und Chlordioxid, die bei der Reaktion mit HCl entstehen:
Sicherheitshinweise
Auch verdünnte Chlorsäure besitzt brandfördernden Charakter und darf nicht mit organischen Materialien in Kontakt gebracht werden.
Einzelnachweise
- Eintrag zu Chlorsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. Juli 2014.
- Eintrag zu Chlorsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 227.
- G. Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry 2. Ausgabe, Vol. 1, Academic Press 1963, S. 312–313.

