Atomhülle
Die Atomhülle oder Elektronenhülle besteht aus den Elektronen, die von einem Atomkern gebunden sind und ihn gewöhnlich bis zu einem Abstand von der Größenordnung 10−10 m umgeben (Atomradius). Atomkern und Atomhülle zusammen bilden das Atom, wobei der Kern einen je nach chemischem Element 20.000- bis 150.000-mal kleineren Durchmesser hat als die Hülle, aber 99,95 % bis 99,98 % der gesamten Atommasse enthält. Die von außen zugänglichen Eigenschaften des Atoms sind daher, abgesehen von der Masse, fast ausschließlich von der Hülle bestimmt. Dazu gehören neben der Größe des Atoms seine verschiedenen möglichen Arten einer chemischen Bindung, die Möglichkeiten zur Bildung eines Moleküls oder eines kristallinen Festkörpers, die Emission und Absorption von elektromagnetischer Strahlung bestimmter Wellenlängen in den Bereichen Infrarot, sichtbares Licht, Ultraviolett und Röntgenstrahlen. Die Atomphysik, die sich zum großen Teil mit diesen Phänomenen beschäftigt, ist daher weitgehend eine Physik der Atomhülle.

Die Anzahl der Elektronen in der Atomhülle eines neutralen Atoms ist durch die Größe der positiven elektrischen Ladung des Atomkerns gegeben. ist auch die chemische Ordnungszahl des Elements, zu dem das Atom gehört. Atome mit mehr oder weniger als Elektronen sind negativ bzw. positiv geladen und werden als Ionen bezeichnet.
Für den Aufbau der Elektronenhülle wurden verschiedene Atommodelle entwickelt. Das erste in Teilen sehr erfolgreiche Modell war 1913 das Bohrsche Atommodell (nach Niels Bohr), das auch heute noch vielen populären Darstellungen zugrunde liegt. Es wurde ab 1925 durch die wesentlich umfassenderen und genaueren quantenmechanischen Atommodelle abgelöst, die bis heute die theoretische Grundlage der Atomphysik bilden.
Eigenschaften der gesamten Hülle
Bindungsenergie
Die Atomhülle besteht aus Elektronen, die aufgrund ihrer negativen elektrischen Ladung an den positiven Atomkern gebunden sind. Die gesamte Bindungsenergie der Elektronen der Hülle beträgt bei einem neutralen Atom etwa (eine genauere Näherung ist ).[1] Die durchschnittliche Bindungsenergie pro Elektron nimmt daher mit steigender Teilchenzahl etwa gemäß zu, sie steigt von bei auf bei . Dies Verhalten kontrastiert zur Situation im Kern, wo die durchschnittliche Bindungsenergie pro Nukleon nur bei kleinen Teilchenzahlen bis etwa 16 Nukleonen () stark anwächst, im weiteren aber nahe bei 8 MeV bleibt. Diese Unterschiede werden durch die Eigenschaften der jeweils vorherrschenden Wechselwirkung erklärt. Im Kern beruht sowohl die Stärke als auch die effektive Sättigung der Bindungsenergie auf der Starken Wechselwirkung zwischen je zwei Nukleonen, die zwar eine vergleichsweise sehr feste Bindung erzeugt, aber auch von sehr kurzer Reichweite ist, so dass sie kaum über die direkt benachbarten Nukleonen hinaus auch die weiteren Nukleonen anziehen kann. Demgegenüber ist die Hülle durch die elektrostatische Anziehungskraft des Kerns gebunden, die proportional zu ansteigt, vergleichsweise viel schwächer ist als die Kernkräfte, aber aufgrund ihrer langen Reichweite alle Elektronen im ganzen Atom erreicht.
Im einfachsten Modell der Atomhülle wäre ein etwas stärkeres Anwachsen der Bindungsenergie pro Elektron wie zu erwarten, wenn man vom Bohrschen Atommodell ausgeht und annimmt, dass erstens jedes Elektron auf seine Quantenzahlen behält, wenn mit steigendem weitere Elektronen dazukommen, und zweitens, dass keine gegenseitige elektrostatische Abstoßung wirkt. Denn jedes der Elektronen hätte dann eine mit anwachsende Bindungsenergie, weil nicht nur die Kernladung wie ansteigt, sondern seine Bahn dem Kern auch -fach näher ist. Das schwächere Anwachsen mit anstatt mit erklärt sich dann in etwa daraus, dass bei ansteigender Elektronenzahl die fester gebundenen Bahnen nach dem Pauli-Prinzip schon voll besetzt sind und die neu hinzukommenden Elektronen die weniger fest gebundenen besetzen müssen.[2] Ihre gegenseitige elektrostatische Abstoßung fällt demgegenüber weniger ins Gewicht. Ein Anwachsen der Bindungsenergie pro Elektron mit ergibt sich aus der Behandlung der Elektronenhülle als eines Fermi-Gases aus Elektronen, die in einem ausgedehnten Potentialtopf gebunden sind (Thomas-Fermi-Modell), und bis auf eine pauschale elektrostatische Abstoßung nicht untereinander wechselwirken. Der zusätzliche Korrekturfaktor der angegebenen genaueren Näherung geht wesentlich darauf zurück, dass zusätzlich die Bindung der innersten Elektronen extra behandelt wird. Sie befinden sich nahe dem spitzen Potentialminimum am Kernort, das im Thomas-Fermi-Modell nur unzureichend berücksichtigt wird.
Form und Größe
Die Atomhülle hat keine scharf definierte Oberfläche, sondern zeigt im Außenbereich einen etwa exponentiellen Abfall der Elektronendichte. Größe und Form des Atoms werden üblicherweise durch eine möglichst kleine Oberfläche definiert, die einen Großteil (z. B. 90 %) der gesamten Elektronendichte enthält. Diese Fläche ist in den meisten Fällen annähernd kugelförmig, außer bei Atomen, die in einem Molekül oder manchen Kristallgittern chemisch gebunden sind, oder nach spezieller Präparation in Form eines Rydberg-Atoms. Die gesamte Hülle kann gegen den Kern schwingen, wobei die Frequenz z. B. beim Xenon-Atom mit 54 Elektronen um 1017Hz (bzw. Anregungsenergie um 100 eV) liegt.[3]
Aufgrund des unscharfen Randes der Atomhülle liegt die Größe der Atome nicht eindeutig fest (siehe Atomradius). Die tabellierten Werte sind aus der Bindungslänge gewonnen, das ist der energetisch günstigste Abstand zwischen den Atomkernen in einer chemischen Bindung. Insgesamt zeigt sich mit steigender Ordnungszahl eine in etwa periodische Variation der Atomgröße, die mit der periodischen Variation des chemischen Verhaltens gut übereinstimmt. Im Periodensystem der Elemente gilt allgemein, dass innerhalb einer Periode, also einer Zeile des Systems, eine bestimmte Schale aufgefüllt wird. Von links nach rechts nimmt die Größe der Atome dabei ab, weil die Kernladung anwächst und daher alle Schalen stärker angezogen werden. Wenn eine bestimmte Schale mit den stark gebundenen Elektronen gefüllt ist, gehört das Atom zu den Edelgasen. Mit dem nächsten Elektron beginnt die Besetzung der Schale mit nächstgrößerer Energie, was mit einem größeren Radius verbunden ist. Innerhalb einer Gruppe, also einer Spalte des Periodensystems, nimmt die Größe daher von oben nach unten zu. Dementsprechend ist das kleinste Atom das Heliumatom am Ende der ersten Periode mit einem Radius von 32 pm, während eines der größten Atome das Caesiumatom ist, das erste Atom der 5. Periode. Es hat einen Radius von 225 pm.[4]
Dichte
Entgegen vielen populären Darstellungen ist die Atomhülle keineswegs ein im Wesentlichen leerer Raum. Vielmehr variiert die mittlere Elektronendichte der Hülle je nach Element zwischen 0,01 und 0,1 kg/m3. Zum Vergleich: Luft hat diese Dichte bei einem Druck zwischen 10 und 100 mbar. Die Vorstellung der Hülle als eines (fast) leeren Raums würde sich ergeben, wenn zu jedem Zeitpunkt die Elektronen als nahezu perfekte Massenpunkte an bestimmten Stellen im Raum wären. Die Vorstellung von derart lokalisierten Elektronen im Atom ist aber nach der Quantenmechanik unzulässig.
Drehimpuls
Die Atomhülle eines freien Atoms besitzt in jedem Energieniveau einen bestimmten Drehimpuls. Er wird meist durch bezeichnet, sein Betrag durch die Quantenzahl und die Komponente zu einer frei gewählten z-Achse durch die magnetische Quantenzahl mit . In Elektronenhüllen mit einer geraden Anzahl Elektronen ist eine ganze Zahl , bei ungerader Elektronenzahl ist halbzahlig. Der Betrag des Drehimpulses ist durch gegeben, die z-Komponente durch . Dabei ist das reduzierte Plancksche Wirkungsquantum.[1]
Experimentelle Methoden zur Untersuchung der Atomhülle
Die Größe der Atomhülle wird vor allem im Rahmen der kinetischen Gastheorie und der Kristallstrukturanalyse bestimmt (siehe Atomradius). Methoden zur Aufklärung der Struktur der Atomhülle werden unter dem Begriff Methoden der Atomphysik zusammengefasst. Sie werden detailliert in den jeweils eigenen Artikeln dargestellt. Als typische Beispiele sind zu nennen (wobei die Liste keineswegs erschöpfend ist):
- Röntgenphotoelektronenspektroskopie (XPS): Die Absorption eines Quants hochenergetischer Röntgenstrahlung im photoelektrischen Effekt erzeugt ein freies Elektron mit einer kinetischen Energie, die sich aus der Differenz zwischen der Energie des absorbierten Quants und der Bindungsenergie ergibt, die das Elektron vorher in der Hülle hatte. Elektronen mit der geringsten kinetischen Energie hatten die höchste Bindungsenergie und stammen aus der K-Schale. Danach kommen bei einer Bindungsenergie von etwa die drei eng benachbarten Bindungsenergien der L-Schale usw. Es zeigt sich deutlich die energetische Schalenstruktur der Hülle, ab etwa einschließlich der Aufspaltung gemäß der Struktur nach jj-Kopplung.
- Atomemissionsspektrometrie und Atomabsorptionsspektrometrie: Die spektrale Untersuchung der von der von Atomhüllen emittierten bzw. absorbierten elektromagnetischen Strahlung hinsichtlich ihrer Wellenlänge, vor allem in den Bereichen sichtbares Licht, Ultraviolett, Infrarot, gibt Aufschluss über die Energieabstände der verschiedenen Energieniveaus des Atoms. In vielen Fällen lassen sich diese Energien mit dem Wechsel nur eines einzigen Elektrons von einem Orbital in ein anderes deuten (Leuchtelektron). Dies hat wesentlich zur Erforschung der Atomhülle und damit zur Entdeckung der Quantenmechanik beigetragen. Emissions- und Absorptionsspektren sind charakteristisch für das betreffende Element und werden zu chemischen Analyse eingesetzt. Daher ist die optische Spektroskopie die älteste der hier genannten Methode. Weitere wichtige Ergebnisse der Messungen sind die die Intensität (vor allem im Verhältnis verschiedener Spektrallinien) und Polarisation der Strahlung.
- Röntgenspektroskopie: Wie die optische Spektroskopie oben, aber im Energiebereich der Röntgenstrahlen und daher anders gebauten Spektrometern. Die Stärke der Absorption steigt bei wachsender Energie der Röntgenquanten jedes Mal sprunghaft an, wenn die Bindungsenergie eines Orbitals überschritten wird (Absorptionskante). Dies war der erste experimentelle Beweis für die Größe und die Quantelung der Bindungsenergien der inneren Elektronen im Atom. Die von der Absorption ausgelöste Emission von Röntgenstrahlung zeigt ein einfaches Linienspektrum, das für jedes Element charakteristisch ist (charakteristische Röntgenstrahlung, Röntgenfluoreszenzanalyse). Dass es erst entsteht, wenn vorher ein inneres Elektronen herausgeschlagen worden ist, war der erste Hinweis darauf, dass ein schwächer gebundenes Elektronen nur dann in ein tieferes Niveau springen kann, wenn dort ein Platz frei ist („Lochzustand“).
- Augerelektronenspektroskopie (AES): Ein angeregtes Atom kann anstelle eines Photons ein Elektron emittieren (Auger-Effekt), wenn die Anregungsenergie das möglich macht. Dann ist der Auger-Effekt im Allgemeinen sogar der häufigere. Denn im Einzelnen beruht er darauf, dass in einem Niveau mit hoher Bindungsenergie ein Elektron fehlt (Lochzustand) und dass zwei schwächer gebundene Elektronen der Hülle vermittels ihrer elektrostatischen Abstoßung einen Stoß machen, so dass eins von ihnen den Lochzustand füllt und die gewonnene Energie für das andere ausreicht, das Atom zu verlassen. Gemessen wird die Energie und Intensität der emittierten Elektronen. Auch diese sind elementspezifisch und werden zur chemischen Analyse dünnster Schichten eingesetzt.
- Elektronenstreuung: Untersuchung der von Atomhüllen nach dem Stoß eines energiereichen Elektrons emittierten Elektronen hinsichtlich ihrer Energie und Intensität.
Modellvorstellungen zur Atomhülle
(Siehe auch Liste der Atommodelle sowie Wasserstoffatom)
Die Unterteilung eines Atoms in Atomkern und Atomhülle geht auf Ernest Rutherford zurück, der 1911 in Streuexperimenten zeigte, dass Atome aus einem winzigen, kompakten Kern umgeben von einer viel leichteren Hülle bestehen.[5] Dies Bild stand in vollständigem Gegensatz zu allen anderen bis dahin diskutierten Atommodellen. Nach dem Erfolg des Bohrschen Atommodells ab 1913 wurde unter Atommodell ein Modell der Atomhülle verstanden.
Bohrsches Atommodell und Verfeinerungen bis 1925

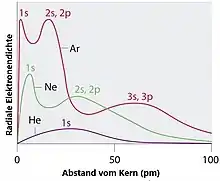
1913 konnte Niels Bohr, aufbauend auf Rutherfords Atommodell aus Kern und Hülle, erstmals erklären, wie es in den optischen Spektren reiner Elemente zu den Spektrallinien kommt, die für das jeweilige Element absolut charakteristisch sind (Spektralanalyse nach Robert Wilhelm Bunsen und Gustav Robert Kirchhoff 1859). Bohr nahm an, dass die Elektronen sich nur auf bestimmten quantisierten Kreisbahnen aufhalten können, die mit steigendem Radius durch die Hauptquantenzahl durchnummeriert werden. Die Elektronen können auch von einer zur anderen dieser Bahnen „springen“, sich jedoch nicht dazwischen aufhalten.[7] Beim Quantensprung von einer äußeren zu einer weiter innen liegenden Bahn muss das Elektron eine bestimmte Menge an Energie abgeben, die als Lichtquant bestimmter Wellenlänge erscheint. Im Franck-Hertz-Versuch konnte 1914 an Quecksilberatomen die quantisierte Energieaufnahme und -abgabe experimentell bestätigt werden. Doch ergab das Bohrsche Atommodell nur für Systeme mit lediglich einem Elektron (Wasserstoff und ionisiertes Helium) quantitativ richtige Resultate. Obwohl es bei Atomhüllen mit mehreren Elektronen grundsätzlich versagte, bildete es das Fundament für eine Reihe von Verfeinerungen, die im Laufe des folgenden Jahrzehnts zu einem qualitativen Verständnis des Aufbaus der Elektronenhüllen aller Elemente führten. Damit wurde das Bohrsche Atommodell zur Grundlage des populären Bildes vom Atom als einem kleinen Planetensystem.[8]
1915 wurde das Bohrsche Atommodell durch Arnold Sommerfeld zum Bohr-Sommerfeldschen Atommodell erweitert. Es berücksichtigte die Spezielle Relativitätstheorie, ließ auch elliptische Keplerbahnen zu und führte zwei neue Quantenzahlen ein: die Nebenquantenzahl für die Unterscheidung von Elektronenbahnen mit gleicher Hauptquantenzahl aber unterschiedlicher elliptischer Form, sowie die magnetische Quantenzahl , die für die Bahnen zu gegebener Haupt- und Nebenquantenzahl die endliche Anzahl möglicher räumlicher Orientierungen durchnummeriert. Da die Energie nur schwach von den beiden neuen Quantenzahlen abhängt, wurde hierdurch die Aufspaltung der Spektrallinien erklärt, die im Bohrschen Modell noch durch eine einzige Energie bestimmt waren. Zugleich entstand das Bild, dass die Bahnen zu gleicher Hauptquantenzahl eine „Schale“ bilden, wobei verschiedene Schalen sich aber räumlich durchdringen.
1916 versuchte Gilbert Newton Lewis, die chemische Bindung zu erklären, indem er im Rahmen des Bohrschen Atommodells die elektrische Wechselwirkung der Elektronen zweier Atome betrachtete.[9] Aus den Beobachtungen der charakteristischen Röntgenstrahlung leitete Walther Kossel ab, dass es in jedem Atom nur eine bestimmte Anzahl von Plätzen für die inneren Elektronen gibt, um zu erklären, warum Elektronen von weiter außen nur dann in eine innere Bahn springen, wenn dort ein Elektron herausgeschlagen worden war. Aufgrund der periodischen chemischen Eigenschaften der Elemente vermutete er 1916 weiter, dass es „Elektronenschalen“ gibt, die nach der Aufnahme von 8 Elektronen „abgeschlossen“ sind und dann ein Edelgas bilden.[10] Diese Anzahl entspricht gerade der verdoppelten Anzahl verschiedener Kombinationen von und zur gleichen Hauptquantenzahl . Dies wurde bis 1921 von Niels Bohr zum „Aufbauprinzip“ weiterentwickelt, wonach mit zunehmender Kernladungszahl jedes weitere Elektron in die jeweils energetisch niedrigste Elektronenschale der Atomhülle, die noch Plätze frei hat, aufgenommen wird, ohne dass die schon vorhandenen Elektronen sich wesentlich umordnen.[11] Das führte Wolfgang Pauli 1925 zur Entdeckung des Paulischen Ausschließungsprinzips, dem zufolge jede durch die drei Quantenzahlen charakterisierte Bahn von maximal zwei Elektronen besetzt werden darf. Nach der Entdeckung des Elektronenspins, für den eine vierte Quantenzahl mit nur zwei möglichen Werten eingeführt wurde, wurde das Pauli-Prinzip so präzisiert, dass jeder durch die vier Quantenzahlen definierte Zustand nur von einem Elektron besetzt werden kann.
Quantenmechanische Modelle der Atomhülle
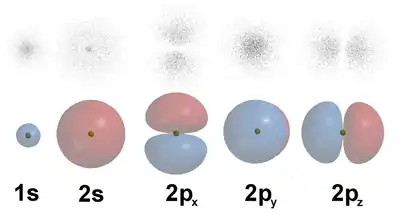
Aufbauend auf der von Louis de Broglie 1924 postulierten Materiewelle entwickelte Erwin Schrödinger 1926 die Wellenmechanik. Sie beschreibt die Elektronen nicht als Massenpunkte auf bestimmten Bahnen, sondern als dreidimensionale Wellen, die durch Kraftfelder, zum Beispiel das elektrostatische Potential eines Atomkerns, verformt werden. Als Folge dieser Beschreibung ist es unter anderem unzulässig, einem Elektron in einem gegebenen Moment gleichzeitig Ort und Impuls mit genauen Werten zuzuschreiben. Dieser Sachverhalt wurde 1927 von Werner Heisenberg in der Unschärferelation formuliert. Demnach können statt der Bewegung auf bestimmten Bahnen nur Wahrscheinlichkeitsverteilungen für Wertebereiche von Ort und Impuls angegeben werden, eine Vorstellung, die nur schwer zu veranschaulichen ist. Einer quantisierten Umlaufbahn des Bohrschen Modells entspricht hier eine stehende Welle oder „Atomorbital“, die in der Nähe des Atomkerns konzentriert ist und die Verteilung der Materie beschreibt. Ein Atomorbital gibt unter anderem genau an, welche Form die Aufenthaltswahrscheinlichkeit des Elektrons im Raum hat.
Das Modell wurde zunächst für eine Atomhülle mit nur einem Elektron im Feld einer Punktladung entwickelt (Wasserstoffproblem). Es lieferte die Energien der Bohrschen Bahnen je nach Hauptquantenzahl und auch die von Sommerfeld eingeführten Quantenzahlen für den Drehimpuls, letztere mit der korrekten Zählung von Null an aufwärts (statt wie bei Bohr mit 1 beginnend). Anders als das Bohr-Sommerfeld-Modell konnte das wellenmechanische Modell in eindeutiger Weise und erfolgreich auf Atomhüllen mit mehreren Elektronen ausgedehnt werden, indem das Pauli-Verbot zu einer Vorschrift über die Antisymmetrie der Wellenfunktion bei Vertauschung zweier Elektronen umformuliert worden wurde. Die Beschreibung der Eigenschaften der Atome gelang hiermit sehr viel besser als mit den Vorläufermodellen. Die Elektronen werden zunächst unter Vernachlässigung ihrer elektrostatischen Abstoßung nacheinander in die Orbitale eingeordnet, für den Grundzustand der Atomhülle in die mit den niedrigsten Energien, für angeregte Zustände eins oder mehrere Elektronen in höher liegende. Die Abstoßung, obwohl eine Kraft zwischen je zwei Elektronen, wird pauschal angenähert, indem die Abschirmung durch die Elektronenwolke durch ein entsprechend abgeschirmtes elektrostatisches Potential berücksichtigt wird. Dadurch werden die Orbitale umso schwächer gebunden, je höher ihr Bahndrehimpuls ist. Resultat ist eine Energieaufspaltung innerhalb jeder Hauptschale ab n=2: Die Energie der Orbitale steigt mit der Nebenquantenzahl an. Zum Beispiel liegt bei gefüllter 3p-Schale (Z=18, Argon) die 3d-Schale energetisch schon über der 4s-Schale und wird daher erst nach dieser (ab Z=21, Scandium) mit Elektronen gefüllt (3d-Übergangsmetalle). Das Modell liefert damit nicht nur eine detaillierte Erklärung des Periodensystems, sondern auch ein schon recht wirklichkeitsgetreues Bild der räumlichen und energetischen Verteilung der Elektronen in der Hülle. Die Schalen sind aber, mit Ausnahme der beiden innersten, weder im räumlichen noch im energetischen Sinn deutlich voneinander getrennt, sondern zeigen starke Überschneidungen (siehe Abbildung). Die Beschreibung der Struktur der Atomhülle in räumlicher und energetischer Hinsicht legt auch die genauen Möglichkeiten fest, mit den Atomhüllen anderer Atome gebundene Zustände zu bilden. Daher wird das Orbitalmodell in der Chemie vielfach zur Beschreibung genutzt.[12][13] Alle Grund- und die meisten Anregungszustände der Hülle sind gut darzustellen, das Modell kann also auch die optischen Spektren, die Röntgenspektren und die Augerspektren erklären.
Das Orbitalmodell ist bei einem Atom mit mehr als einem Elektron physikalisch als eine Näherung zu bezeichnen, weil jedem einzelnen Elektron ein bestimmtes Orbital zugeschrieben wird. Ein so gebildeter Zustand der Atomhülle wird als reine Konfiguration bezeichnet. Er gehört in der Quantenmechanik zu der einfachsten Art von Mehrteilchenzuständen. Genauere Modelle berücksichtigen, dass die Hülle auch in einem Zustand sein kann, der aus der Superposition verschiedener Konfigurationen besteht, wo also mit verschiedenen Wahrscheinlichkeitsamplituden gleichzeitig verschiedene Elektronenkonfigurationen vorliegen, genannt Konfigurationsmischung. Dies Modell ermöglicht die genauesten Berechnungen von Energieniveaus und Reaktionsweisen der Atome. Weitere Verfeinerungen betreffen die relativistische Behandlung des Elektrons (Dirac-Gleichung) und die genaue Berücksichtigung des endlichen Durchmessers des Kerns und seiner magnetischen und elektrischen Kernmomente sowie die Strahlungskorrekturen nach der Quantenelektrodynamik (Lambshift). Wegen des dazu nötigen mathematischen Aufwands werden jedoch, wo es möglich ist, auch weiterhin einfachere Atommodelle genutzt. Zu nennen ist hier das Thomas-Fermi-Modell, in dem die Elektronenhülle pauschal wie ein im Potentialtopf gebundenes ideales Elektronengas (Fermigas) behandelt wird, dessen Dichte wiederum die Form des Potentialtopfs bestimmt.
Den einfachsten Ansatz für die Wellenfunktion einer reinen Konfiguration zu einer bestimmten Anzahl von Elektronen gewinnt man mit der Hartree-Fock-Methode. Sie bleibt bei der Einzelteilchen-Näherung, bei der jedem Elektron ein bestimmtes Orbital zugewiesen wird, wobei aber die Form der Orbitale aufgrund der Anwesenheit aller übrigen Elektronen geeignet abgeändert wird. Dazu sucht man diejenigen Formen für die Orbitale, mit denen die Energie der gesamten Konfiguration unter Berücksichtigung der Abstoßungskräfte, die ja von der Form der besetzten Orbitale abhängen, ein Minimum erreicht. Damit werden die Orbitale in selbstkonsistenter Weise so bestimmt, dass sich eine zeitlich stabile Konfiguration ergibt. Das Ergebnis ist also immer noch eine reine Konfiguration, nur dass die darin vorkommenden Zustände der einzelnen Elektronen gegenüber den aus dem Wasserstoffproblem bekannten Orbitalen abgewandelt sind.
Zum selben Typ von selbstkonsistenter Näherungslösung führt die Dichtefunktionaltheorie. Hier geht man von einer ortsabhängigen Verteilung der Gesamtdichte der Elektronen aus und bildet daraus eine Schrödingergleichung für ein einziges Elektron, in der die Auswirkungen der Antisymmetrie der Vielteilchen-Wellenfunktion und der Elektron-Elektron-Abstoßung durch einen Zusatzterm, der nur von der Gesamtdichte abhängt, angenähert pauschal berücksichtigt werden. Aus den damit bestimmten Orbitalen der einzelnen Elektronen wird wieder eine Gesamtdichte berechnet. Stimmt sie mit der anfangs angesetzten Gesamtdichte nicht zufriedenstellend überein, wird diese variiert, um bessere Übereinstimmung zu erzielen.
Interpretation einiger grundlegender Eigenschaften der Atome im Rahmen des Schalenmodells
Das Schalenmodell wird hier in seiner einfachsten, kugelsymmetrischen Form betrachtet, während eine Richtungsabhängigkeit der Elektronendichte erst im Orbitalmodell hinzukommt. Dann lässt das Schalenmodell Stärke und Abstandsabhängigkeit der Kräfte zwischen zwei Atomen verstehen. Sie werden praktisch ausschließlich durch die beiden Hüllen bestimmt. Darauf beruht unter anderem die chemische Bindung, sowie der Wechsel des Aggregatzustands und die mechanische Stabilität und viele weitere Eigenschaften der makroskopischen Materialien.
Anziehung
Bei größeren Abständen, mehr als ein Atomdurchmesser, entstehen schwach anziehende Van-der-Waals-Kräfte dadurch, dass die beiden Atomhüllen sich gegenseitig polarisieren. Das heißt, Hüllen und Kerne verschieben sich minimal gegeneinander, so dass die beiden Atome zu schwachen elektrischen Dipolen werden, die sich bei richtiger Orientierung elektrostatisch anziehen. Diese anziehenden Kräfte bewirken im gasförmigen Zustand meist nur geringe Abweichungen vom Verhalten des Ideales Gas, verursachen aber auch die Kondensation eines Gases zu einer Flüssigkeit, also einen Wechsel des Aggregatzustands.
Abstoßung
Bei starker Annäherung, sobald sich die Hüllen zweier Atome im Raum merklich überschneiden, entsteht eine starke abstoßende Kraft. Sie beruht vor allem auf dem Pauli-Prinzip, das die Elektronen eines Atoms von der Aufnahme in die besetzten Orbitale des anderen Atoms ausschließt, soweit sie schon von einem Elektronenpaar besetzt sind. Sie müssen daher in energetisch höheren Orbitalen untergebracht werden, was einen Energieaufwand erfordert. Demgegenüber spielt die elektrostatische Abstoßung der beiden negativen Elektronenwolken und der beiden positiven Kerne fast keine Rolle. Mit dieser Abstoßungskraft lässt sich die äußerst geringe Kompressibilität von kondensierter Materie (Flüssigkeiten und Festkörper) weitgehend erklären.
Chemische Bindung
In dem wohldefinierten Abstand, bei dem sich Anziehung und Abstoßung zweier Atome gerade die Waage halten, liegt das Minimum ihrer gegenseitigen potentiellen Energie (vgl Abbildung 1 hier). Dies erklärt die homöopolare Chemische Bindung, die zwischen den Atomen desselben Elements typisch ist (z. B. im 2-atomigen Gas). Im Fall von Atomen verschiedener Elemente, die leicht positive bzw. negative Ionen bilden, gilt eine ähnliche Potentialkurve zwischen den beiden entgegengesetzt geladenen Ionen. Dann wird die anziehende Kraft durch die elektrostatische Anziehung der Ionen verstärkt, gleichzeitig wird die Kurve aber angehoben um die Differenz von Ionisierungsenergie beim positiven Ion und Elektronenaffinität beim negativen. Bleibt das Minimum der potentiellen Energie dabei negativ, ergibt sich eine Ionenbindung (z. B. Na+Cl-). Zur Erklärung weiterer Feinheiten der chemischen Bindungen reicht das einfache Schalenmodell nicht aus. Es muss dann das Orbitalmodell herangezogen werden (z. B. bei der räumlichen Anordnung der Atome in mehratomigen Molekülen), wenn nicht sogar eine eigene quantenmechanische Berechnung vonnöten ist (z. B. bei Metallen)
Vermittelt über die Hüllen ihrer Atome ziehen auch Moleküle einander an. Ein fester Körper entsteht, wenn viele Moleküle sich aneinander binden und dabei, weil es energetisch günstig ist, eine feste Anordnung einhalten. Ist diese Anordnung regelmäßig, bildet sich ein Kristallgitter. Infolge dieser Bindung ist der feste Körper nicht nur weitgehend inkompressibel wie eine Flüssigkeit, sondern im Unterschied zu dieser deutlich weniger leicht verformbar und daher auch auf Zug belastbar. Die Besonderheiten von metallischen Festkörpern, insbesondere ihre leichtere Verformbarkeit, große elektrische Leitfähigkeit und Wärmeleitfähigkeit, metallischer Glanz, lassen sich nur durch die Metallische Bindung erklären.
Erklärung der Atomeigenschaften im Rahmen des Orbitalmodells
Die dem Schalenmodell zugrundeliegenden Elektronenschalen ergeben sich durch die Quantisierung der Energie eines einzelnen Elektrons im Kraftfeld des Atomkerns nach den Regeln der Quantenmechanik. Um den Kern herum bilden sich verschiedene Atomorbitale, das sind unscharf begrenzte Wahrscheinlichkeitsverteilungen für mögliche räumliche Zustände der Elektronen. Jedes Orbital kann aufgrund des Pauli-Prinzips mit maximal zwei Elektronen besetzt werden, dem Elektronenpaar. Die Orbitale, die unter Vernachlässigung der gegenseitigen Abstoßung der Elektronen und der Feinstruktur theoretisch die gleiche Energie hätten, bilden eine Schale. Die Schalen werden mit der Hauptquantenzahl durchnummeriert oder fortlaufend mit den Buchstaben K, L, M,… bezeichnet. Genauere Messungen zeigen, dass ab der zweiten Schale nicht alle Elektronen einer Schale die gleiche Energie besitzen. In diesem Fall wird durch die Nebenquantenzahl oder Drehimpulsquantenzahl eine bestimmte Unterschale identifiziert.
Sind die Orbitale, angefangen vom energetisch niedrigsten, so weit mit Elektronen besetzt, dass die gesamte Elektronenzahl gleich der Protonenzahl des Kerns ist, ist das Atom neutral und befindet sich im Grundzustand. Werden in einem Atom ein oder mehrere Elektronen in energetisch höherliegende Orbitale versetzt, ist das Atom in einem angeregten Zustand. Die Energien der angeregten Zustände haben für jedes Atom wohlbestimmte Werte, die sein Termschema bilden. Ein angeregtes Atom kann seine Überschussenergie abgeben durch Stöße mit anderen Atomen, durch Emission eines der Elektronen (Auger-Effekt) oder durch Emission eines Photons, also durch Erzeugung von Licht oder Röntgenstrahlung. Bei sehr hoher Temperatur oder in Gasentladungen können die Atome durch Stöße Elektronen verlieren (siehe Ionisationsenergie), es entsteht ein Plasma, so z. B. in einer heißen Flamme oder in einem Stern.
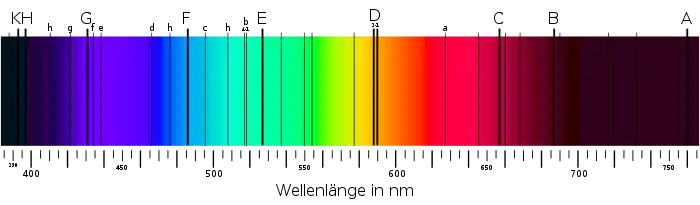
Da die Energien der Quanten der emittierten Strahlung je nach Atom bzw. Molekül und den beiden beteiligten Zuständen verschieden sind, lässt sich durch Spektroskopie dieser Strahlung die Art der Quelle im Allgemeinen eindeutig identifizieren. Beispielsweise zeigen in Gasen die einzelnen Atome ihr elementspezifisches optisches Linienspektrum. Bekannt ist etwa die Natrium-D-Linie, eine Doppellinie im gelben Spektralbereich bei 588,99 nm und 589,59 nm,[14]. Ihr Aufleuchten zeigt die Anwesenheit von angeregten Natrium-Atomen an, sei es auf der Sonne oder über der Herdflamme bei Anwesenheit von Natrium oder seinen Salzen. Da diese Strahlung einem Atom auch durch Absorption dieselbe Energie zuführen kann, lassen sich die Spektrallinien der Elemente sowohl in Absorptions- als auch in Emissionsspektren beobachten. In der nebenstehenden Abbildung ist dieses Dublett mit D-1 bezeichnet und zeigt die Anwesenheit von Natriumatomen in der äußeren Photosphäre der Sonne an. Diese Spektrallinien lassen sich auch verwenden, um Frequenzen sehr präzise zu vermessen, beispielsweise für Atomuhren.
Obwohl Elektronen sich untereinander elektrostatisch abstoßen, können zusätzlich bis zu zwei weitere Elektronen gebunden werden, wenn es bei der höchsten besetzten Elektronenenergie noch Orbitale mit weiteren freien Plätzen gibt (siehe Elektronenaffinität). Chemische Reaktionen, d. h. die Verbindung mehrerer Atome zu einem Molekül oder sehr vieler Atome zu einem Festkörper, werden dadurch erklärt, dass ein oder zwei Elektronen aus einem der äußeren Orbitale eines Atoms (Valenzelektronen) unter Energiegewinn auf einen freien Platz in einem Orbital eines benachbarten Atoms ganz hinüberwechseln (Ionenbindung) oder sich mit einer gewissen Wahrscheinlichkeit dort aufhalten (kovalente Bindung durch ein bindendes Elektronenpaar). Dabei bestimmt die Elektronegativität der Elemente, bei welchem Atom sich die Elektronen wahrscheinlicher aufhalten. In der Regel werden chemische Bindungen so gebildet, dass die Atome die Elektronenkonfiguration eines Edelgases erhalten (Edelgasregel). Für das chemische Verhalten des Atoms sind also Form und Besetzung seiner Orbitale entscheidend. Da diese allein von der Protonenzahl bestimmt werden, zeigen alle Atome mit gleicher Protonenzahl, also die Isotope eines Elements, nahezu das gleiche chemische Verhalten.
Nähern sich zwei Atome über die chemische Bindung hinaus noch stärker an, müssen die Elektronen eines Atoms wegen des Pauli-Prinzips auf freie, aber energetisch ungünstige Orbitale des anderen Atoms ausweichen, was einen erhöhten Energiebedarf und damit eine abstoßende Kraft nach sich zieht.
Literatur
Die Elektronenhülle eines Atoms wird in vielen einführenden Büchern zur Atomphysik ausführlich erklärt. Beispielhaft seien hier genannt:
- Wolfgang Demtröder: Experimentalphysik 3 - Atome, Moleküle und Festkörper. 4. Auflage. Springer, 2010, ISBN 978-3-642-03910-2, doi:10.1007/978-3-642-03911-9.
- Hermann Haken und Hans C. Wolf: Atom- und Quantenphysik. 8. Auflage. Springer, 2004, ISBN 3-540-02621-5.
Weblinks
Einzelnachweise
[15] [16] [17] [18] [19] [20] [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33] [34] [7] [8] [9] [10] [11] [12] [13] [35] [36] [37] [38] [39] [40] [41] [42] [43] [44] [45] [46] [47] [48] [49] [50] [51] [52] [53] [54] [55] [56] [57] [58] [59] [60] [61] [1] [4] [14] [62] [63] [64] [65] [66] [67]
- Julian Schwinger: Thomas-Fermi model: The leading correction. In: Phys. Rev. A. Band 22, 1980, S. 1827–1832, doi:10.1103/PhysRevA.22.1827.
- Jörn Bleck-Neuhaus: Elementare Teilchen. Von den Atomen über das Standard-Modell bis zum Higgs-Boson. 2., überarbeitete Auflage. Springer, 2013, ISBN 978-3-642-32578-6, ISSN 0937-7433, doi:10.1007/978-3-642-32579-3. S. 99
- S. Lundqvist, G. Mukhopadhyay: Collective Aspects of Atomic Dynamics. In: Physica Scripta. Nr. 21, 1980, S. 503–509, doi:10.1088/0031-8949/21/3-4/043.
- Mark Winter: Covalent radius. Abgerufen am 12. März 2014 (englisch).
- Atomhülle. In: Spektrum.de. Abgerufen am 13. Mai 2020.
- LibreTexts: radial density distribution. LibreTexts, abgerufen am 31. Oktober 2020.
- David P. Stern: The Atomic Nucleus and Bohr's Early Model of the Atom. NASA Goddard Space Flight Center, 16. Mai 2005, abgerufen am 2. März 2014 (englisch).
- Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture. The Nobel Foundation, 11. Dezember 1922, abgerufen am 2. März 2014 (englisch).
- Gilbert N. Lewis: The Atom and the Molecule. In: Journal of the American Chemical Society. Band 38, Nr. 4, April 1916, S. 762–786, doi:10.1021/ja02261a002.
- Walther Kossel: Über Molekülbildung als Frage des Atombaus. Annalen der Physik Bd. 49, 1916, S. 229–362, doi:10.1002/andp.19163540302.
- Niels Bohr: Atomic structure. In: Nature. Band 107, 1921, S. 104–107, doi:10.1038/107104a0.
- Kevin Brown: The Hydrogen Atom. MathPages, 2007, abgerufen am 2. März 2014 (englisch).
- David M. Harrison: The Development of Quantum Mechanics. University of Toronto, März 2000, abgerufen am 2. März 2014 (englisch).
- Yu. Ralchenko, A. E. Kramida, J. Reader: NIST Atomic Spectra Database. National Institute of Standards and Technology, Gaithersburg, MD, 2008, abgerufen am 2. März 2014 (Version 5).
- Leonid I. Ponomarev: The Quantum Dice. 2. Auflage. Inst. of Physics Pub, 1993, ISBN 0-7503-0251-8, S. 14–15.
- Jörn Bleck-Neuhaus: Elementare Teilchen. Von den Atomen über das Standard-Modell bis zum Higgs-Boson. 2., überarbeitete Auflage. Springer, 2013, ISBN 978-3-642-32578-6, ISSN 0937-7433, Kapitel 1, doi:10.1007/978-3-642-32579-3.
- Dick Teresi: Lost Discoveries: The Ancient Roots of Modern Science--from the Babylonians to the Maya. Simon & Schuster, 2003, ISBN 0-7432-4379-X, S. 213–214.
- Robert Siegfried: From Elements to Atoms: A History of Chemical Composition. In: Transactions of the Americal Philosophical Society. Band 92, Nr. 4. American Philosophical Society, 2002, ISBN 0-87169-924-9, S. 42–55.
- Charles Kittel: Einführung in die Festkörperphysik. 7. Auflage 1988, Verlag R. Oldenbourg (München), S. 16.
- Lavoisier's Elements of Chemistry. In: Elements and Atoms. Le Moyne College, Department of Chemistry, abgerufen am 2. März 2014 (englisch).
- Charles Adolphe Wurtz: The Atomic Theory. D. Appleton and company, New York 1881, S. 1–2.
- J. Dalton: A New System of Chemical Philosophy, Part 1. S. Russell, London/Manchester 1808.
- F. Dannemann: Die Naturwissenschaften in ihrer Entwicklung und in ihrem Zusammenhange. Bd. 3, Verlag W. Engelmann 1922, S. 198.
- Loschmidt: Zur Grösse der Luftmoleküle. In: Sitzungsberichte der kaiserlichen Akademie der Wissenschaften Wien. Band 52, 1866, Abt. II, S. 395–413.
- Albert Einstein: Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen. In: Annalen der Physik. Band 322, Nr. 8, 1905, S. 549–560, doi:10.1002/andp.19053220806 (PDF (Memento vom 18. März 2006 im Internet Archive) [abgerufen am 4. Februar 2007]). Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen (Memento vom 18. März 2006 im Internet Archive)
- Robert M. Mazo: Brownian Motion: Flucuations, Dynamics, and Applications. In: The International Series of Monographs on Physics. Band 112. Oxford University Press, 2002, ISBN 0-19-851567-7, S. 1–7.
- Y. K. Lee, Kelvin Hoon: Brownian Motion. (Nicht mehr online verfügbar.) Imperial College, London, 1995, archiviert vom Original am 18. Dezember 2007; abgerufen am 2. März 2014 (englisch).
- G. Patterson: Jean Perrin and the triumph of the atomic doctrine. In: Endeavour. Band 31, Nr. 2, 2007, S. 50–53, doi:10.1016/j.endeavour.2007.05.003.
- The Nobel Foundation: J.J. Thomson. Nobelprize.org, 1906, abgerufen am 2. März 2014 (englisch).
- E. Rutherford: The Scattering of α and β Particles by Matter and the Structure of the Atom. In: Philosophical Magazine. Band 21, 1911, S. 669–688 (Scans [abgerufen am 2. März 2014]).
- Frederick Soddy, The Nobel Prize in Chemistry 1921. Nobel Foundation, abgerufen am 2. März 2014 (englisch).
- Joseph John Thomson: Bakerian Lecture: Rays of Positive Electricity. In: Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character. Band 89, Nr. 607, 1913, S. 1–20 (royalsocietypublishing.org [PDF; abgerufen am 2. März 2014]).
- Francis W. Aston: The constitution of atmospheric neon. In: Philosophical Magazine. Band 39, Nr. 6, 1920, S. 449–455.
- James Chadwick: Nobel Lecture: The Neutron and Its Properties. Nobel Foundation, 12. Dezember 1935, abgerufen am 2. März 2014 (englisch).
- Lise Meitner, Otto Robert Frisch: Disintegration of uranium by neutrons: a new type of nuclear reaction. In: Nature. Band 143, 1939, S. 239.
- Manfred Schroeder: Lise Meitner – Zur 125. Wiederkehr Ihres Geburtstages. (Online [abgerufen am 2. März 2014]). Online (Memento vom 19. Juli 2011 im Internet Archive)
- Sven Kullander: Accelerators and Nobel Laureates. The Nobel Foundation, 28. August 2001, abgerufen am 2. März 2014 (englisch).
- Staff: The Nobel Prize in Physics 1990. The Nobel Foundation, 17. Oktober 1990, abgerufen am 2. März 2014 (englisch).
- P. Domokos, J. Janszky, P. Adam: Single-atom interference method for generating Fock states. In: Physical Review. Band 50, 1994, S. 3340–3344, doi:10.1103/PhysRevA.50.3340.
- The Nobel Prize in Physics 1997. Nobel Foundation, 15. Oktober 1997, abgerufen am 2. März 2014 (englisch).
- Marilyn Jacox, J. William Gadzuk: Scanning Tunneling Microscope. National Institute of Standards and Technology, November 1997, abgerufen am 2. März 2014 (englisch).
- The Nobel Prize in Physics 1986. The Nobel Foundation, abgerufen am 11. Januar 2008 (englisch, insbesondere der Nobel-Preis-Vortrag von G. Binnig und H. Rohrer).
- Jiwoong Park, et al.: Coulomb blockade and the Kondo effect in single-atom transistors. In: Nature. Band 417, Nr. 6890, 2002, S. 722–725, doi:10.1038/nature00791.
- G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. A 729, 2003, S. 3–128, doi:10.1016/j.nuclphysa.2003.11.001 (englisch, in2p3.fr [PDF; abgerufen am 2. März 2014]).
- Eintrag zu Isotope. In: Römpp Online. Georg Thieme Verlag, abgerufen am 2. Februar 2014.
- Roger Barrett, Daphne Jackson, Habatwa Mweene: The Strange World of the Exotic Atom. In: New Scientist. Nr. 1728, 1990, S. 77–115 (Online [abgerufen am 2. März 2014]).
- Paul Indelicato: Exotic Atoms. In: Physica Scripta. T112, 2004, S. 20–26, doi:10.1238/Physica.Topical.112a00020.
- Barrett H. Ripin: Recent Experiments on Exotic Atoms. American Physical Society, Juli 1998 (Online [abgerufen am 2. März 2014]).
- Craig J. Copi, David N. Schramm, Michael S Turner: Big-Bang Nucleosynthesis and the Baryon Density of the Universe. In: Science. Band 267, 1995, S. 192–199, doi:10.1126/science.7809624, PMID 7809624.
- Brian Abbott: Microwave (WMAP) All-Sky Survey. (Nicht mehr online verfügbar.) Hayden Planetarium, 30. Mai 2007, archiviert vom Original am 5. September 2008; abgerufen am 2. März 2014 (englisch).
- D. C. Knauth, S. R. Federman, David L. Lambert, P. Crane: Newly synthesized lithium in the interstellar medium. In: Nature. Band 405, 2000, S. 656–658, doi:10.1038/35015028.
- Michael Banks: Planck reveals 'almost perfect' universe. 21. März 2013, abgerufen am 20. Januar 2014 (englisch).
- Masataka Fukugita, James Peebles: The Cosmic Energy Inventory. 18. August 2004, arxiv:astro-ph/0406095 (englisch).
- Michael Richmond: The Interstellar Medium: Gas. Abgerufen am 12. März 2014.
- Arthur F. Davidsen: Far-Ultraviolet Astronomy on the Astro-1 Space Shuttle Mission. In: Science. Band 259, Nr. 5093, 1993, S. 327–334, doi:10.1126/science.259.5093.327, PMID 17832344.
- A. G. W. Cameron: Abundances of the elements in the solar system. In: Space Science Reviews. Band 15, 1970, S. 121–146.
- Jeremy I. Pfeffer: Modern Physics: An Introductory Text. Imperial College Press, 2000, ISBN 1-86094-250-4, S. 330–336.
- Tatjana Jevremovic: Nuclear Principles in Engineering. Springer, 2005, ISBN 0-387-23284-2, S. 63.
- E.R. Cohen, et al.: Quantities, Units and Symbols in Physical Chemistry. 3. Auflage. IUPAC & RSC Publishing, 2008, ISBN 978-0-85404-433-7, S. 88, 92 (englisch, Online [PDF; abgerufen am 28. April 2014]). Online (Memento vom 11. Februar 2014 im Internet Archive)
- G. Audi, A. H. Wapstra, C. Thibault: The Ame2003 atomic mass evaluation (II). In: Nuclear Physics. A729, 2003, S. 337–676 (englisch, Online [abgerufen am 2. März 2014]).
- Wolfgang Demtröder: Experimentalphysik Bd. 4: Kern-,Teilchen- und Astrophysik. 3. Auflage. Springer, 2010, ISBN 978-3-642-01597-7, ISSN 0937-7433, S. 366–367, doi:10.1007/978-3-642-01598-4.
- Erwin W. Müller, John A. Panitz, S. Brooks McLane: The Atom-Probe Field Ion Microscope. In: Review of Scientific Instruments. Band 39, Nr. 1, 1968, ISSN 0034-6748, S. 83–86, doi:10.1063/1.1683116.
- Jim Lochner, Meredith Gibb, Phil Newman: What Do Spectra Tell Us? NASA/Goddard Space Flight Center, 30. April 2007, abgerufen am 2. März 2014 (englisch).
- Mark Winter: Helium. WebElements, 2007, abgerufen am 2. März 2014 (englisch).
- Albert Einstein: Eine neue Bestimmung der Moleküldimensionen. Bern 1905 (Online [PDF; abgerufen am 25. März 2014]).
- Christian Wiener: Erklärung des atomistischen Wesens des tropfbar flüssigen Körperzustandes und Bestätigung desselben durch die sogenannten Molekularbewegungen. In: Poggendorffs Annalen. Band 118, 1863, S. 79–94.
- G. Baur et al.: Production of antihydrogen. In: Physics Letters B. 368, Nr. 3, 1996, S. 251–258, doi:10.1016/0370-2693(96)00005-6; Preprint online.