Termschema
Ein Termschema, auch Niveauschema oder Grotrian-Diagramm (nach seinem Erfinder Walter Grotrian), ist die Zusammenstellung aller Energieniveaus (Terme) eines Atoms, Ions, Moleküls oder Atomkerns in übersichtlicher zeichnerischer Darstellung.
Aufbau
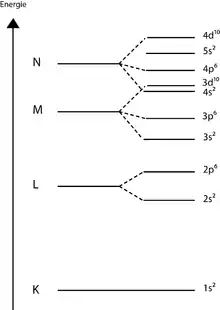
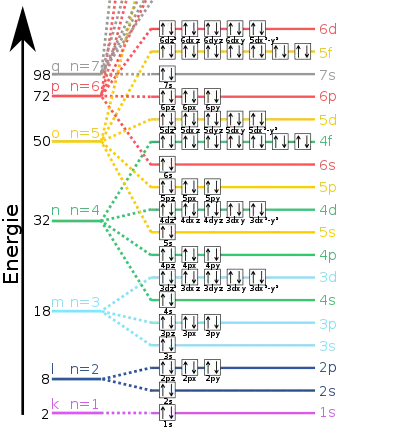
Auf der Ordinate (y-Achse) sind die Haupt- und Nebenschalen des Systems als energetische Plattformen aufgetragen und auf der Abszisse (x-Achse) die Anzahl der Elektronen. Die Hauptschalen werden bei 1 beginnend vom Kern weg gezählt (alternativ können die Schalen auch mit Buchstaben bezeichnet werden). Die höchste Schale eines Energieniveauschemas entspricht der Periode des jeweiligen Elementes. Jedes Atom besitzt dabei eine eigene Elektronenkonfiguration. Je weiter eine Schale vom Kern entfernt ist, desto höher ist das Energieniveau eines Elektrons, welches sich auf dieser befindet.
Das Termschema ist nur für ein sehr einfaches System mit nur einem Elektron durch eine einzige „Sprossenleiter“ darstellbar. Bei komplizierteren Systemen müssen mehrere Leitern in- oder nebeneinander gestellt werden.
Regeln
Die Energien der einzelnen Terme werden maßstäblich als waagerechte Striche so aufgetragen, dass der den energetisch günstigsten oder Grundzustand darstellende Strich am weitesten unten liegt. Bei der Besetzung der Orbitale ist die Hundsche Regel zu befolgen, gemäß der mehrere Orbitale mit gleicher Energie erst mit Elektronen des gleichen Spins belegt werden müssen, bevor Elektronen mit entgegengesetztem Spin verteilt werden.
Atome, deren zuletzt besetztes Elektron sich auf dem P-Niveau befindet und die eine vollbesetzte S- und P-Schale haben, gehören zu den Edelgasen. Atome, die ihre Außenelektronen auf dem 4f-Niveau besitzen, gehören zur Gruppe der Lanthanoide, wohingegen sie bei 5f zu den Actinoiden gehören.
Übergänge
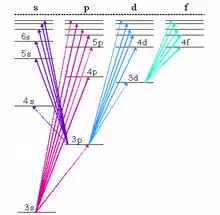
Bei einem Übergang von einem höheren zu einem niedrigeren Term entspricht der Abstand zwischen dem Ausgangs- und dem Endterm der Energie des emittierten Photons; dieser Vorgang erzeugt daher eine entsprechende Spektrallinie. Es sind aber nicht alle Übergänge erlaubt, einige sind aus quantenmechanischen Gründen verboten und werden daher im Spektrum nicht beobachtet (siehe Auswahlregeln).
Siehe auch
Weblinks
- Energiestufen im Atom erklärt auf Schülerniveau (LEIFI)
- Energieniveauschema der Elemente – automatische Anzeige beliebiger Schemata nach Eingabe der Ordnungszahl