Rutherfordsches Atommodell
Das rutherfordsche Atommodell ist ein Atommodell, das 1909 bis 1911 von Ernest Rutherford aufgestellt wurde. Es bildet die Grundlage für das heutige Bild vom Atom, indem es den Atomkern einführte, der als außerordentlich kleine, positiv geladene Kugel im Zentrum des Atoms fast dessen ganze Masse besitzt. Damit überwand das rutherfordsche Atommodell das 1904 aufgestellte thomsonsche Atommodell und diente seinerseits 1913 als Ausgangspunkt des bohrschen Atommodells, mit dem die Energiestufen der Atomhülle erstmals erfolgreich beschrieben werden konnten.
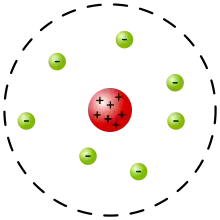
Überblick
Bis zum rutherfordschen Streuversuch (1909) von Hans Geiger, Ernest Marsden und Ernest Rutherford war lediglich bekannt, dass Atome negativ geladene Elektronen und die gleiche Menge positiver Ladungen enthalten. Einen dazu passenden Erklärungsversuch für den Atomaufbau stellte das thomsonsche Atommodell dar, wonach jedes Atom aus einer gleichmäßig verteilten positiven Ladung bestünde, in der sich unter der Wirkung elektrostatischer Kräfte die Elektronen bewegten. Der rutherfordsche Streuversuch zeigte, dass dieses Modell nicht die Realität abbildet. Die Gesamtheit der positiven Ladungen des Atoms und praktisch seine gesamte Masse müssen in einem Atomkern vereinigt sein, dessen Größe nur einen winzigen Bruchteil des gesamten Atoms ausmacht.
Der Versuch

Rutherfords Mitarbeiter Hans Geiger und Ernest Marsden führten Versuche mit energiereichen Alpha-Teilchen der natürlichen Radioaktivität von Wismut-214 durch. Zunächst wurde beobachtet, dass einige wenige der Alpha-Teilchen von einer Platinplatte zurückgeworfen wurden.[1] Das war völlig unerwartet, denn bisher hatte man lediglich Ablenkungen der Alpha-Teilchen um wenige Grad festgestellt, und es war mit bisherigen Vorstellungen vom Atom auch nicht zu erklären.
In einem verfeinerten Versuchsaufbau wurde im Vakuum mit dünnen Folien verschiedener Metalle, darunter Gold, die Häufigkeitsverteilung von Ablenkwinkeln zwischen 15° und 170° untersucht.[2] Auch hier zeigte sich, dass wesentlich größere Ablenkwinkel auftraten, als durch den Zusammenstoß der Alphateilchen mit den vergleichsweise sehr leichten Elektronen erklärbar sind, und dass etwa eines von 8000 Alphateilchen ganz zurückgeworfen wurde.
“It was almost as incredible as if you fired a 15-inch shell at a piece of tissue paper and it came back and hit you.”
„Es war beinahe so unglaublich, als ob man mit einem 15-Zoll-Geschoss auf ein Stück Seidenpapier schießt und das Geschoss zurückkommt und einen selbst trifft.“
Das Modell von Rutherford
Aus der neu konzipierten Vorstellung, im Atom gäbe es einen kleinen, schweren, elektrisch geladenen Kern, leitete Rutherford die nach ihm benannte Streuformel her. Damit konnte die beobachtete Häufigkeit großer Ablenkwinkel erklärt werden, wenn der Kern nicht größer als 1/3000 des Atomradius ist und seine elektrische Ladung (in Einheiten der Elementarladung) in etwa der chemischen Ordnungszahl des Atoms entspricht.[4]
Zur Erklärung der elektrischen Neutralität von Atomen ging Rutherford davon aus, dass der Atomkern positiv geladen ist und von Elektronen umgeben wird, deren Anzahl der Kernladungszahl entspricht. Über die räumliche Verteilung der Elektronen ließen sich keine weiteren Informationen ableiten, da die Elektronen aufgrund ihrer geringen Masse nicht zur Ablenkung der Alphateilchen um große Winkel beitragen. Entgegen häufig zu findenden Darstellungen in Lehrbüchern und anderen Sekundärquellen entwickelte Rutherford kein eigenes Modell der Elektronenstruktur von Atomen. Er zitierte lediglich im Februar 1911 bei der Vorstellung seines Modells vor der Manchester Literary and Philosophical Society[4] das „planetarische Modell“ von Nagaoka[5], um seine Abschätzung der Kernladungszahl von Gold zu plausibilisieren.
Grenzen des Modells
Nach dem Modell von Rutherford würden die Elektronen den Kern auf Keplerbahnen umkreisen, die wie beim Planetensystem beliebige Ausdehnung, Exzentrizität und Orientierung haben könnten. Diese Bahnen könnten aber nicht stabil sein, weil eine kreisende und damit beschleunigte Ladung nach den Gesetzen der Elektrodynamik ständig Energie abstrahlt. Dabei würde ein in den Kern stürzendes Elektron elektromagnetische Wellen jeder beliebigen Frequenz erzeugen, was aber der Beobachtung von Spektrallinien mit je nach Atomart spezifischen Frequenzen widerspricht.
Einzelnachweise
- Jörn Bleck-Neuhaus: Elementare Teilchen. Von den Atomen über das Standard-Modell bis zum Higgs-Boson. 2., überarbeitete Auflage. Springer, 2013, ISBN 978-3-642-32578-6, ISSN 0937-7433, S. 49, doi:10.1007/978-3-642-32579-3.
- Hans Geiger, Ernest Marsden: On a Diffuse Reflection of the α-Particles. In: Proceedings of the Royal Society. 82A, 1909, S. 495–500. Abgerufen im 25. Oktober 2010.
- Edward Andrade: Rutherford and the Nature of the Atom. Doubleday New York 1964. Zitiert nach: Laylin K. James: Nobel Laureates in chemistry, 1901–1992, S. 57
- E. Rutherford, The Scattering of α and β Particles by Matter and the Structure of the Atom, Phil. Mag. 6, vol. 21, 669–688 (1911). Rutherfords Artikel im Philosophical Magazine (englisch, PDF; 233 kB)
- Hantarō Nagaoka: Kinetics of a system of particles illustrating the line and the band spectrum and the phenomena of radioactivity. In: Philosophical Magazine. 7, 1904, S. 445–455. Abgerufen am 28. Februar 2010.