Massendefekt
Als Massendefekt (auch Massenverlust) bezeichnet man in der Kernphysik das Massenäquivalent der Bindungsenergie des Atomkerns.[1][2] Er äußert sich als Differenz zwischen der Summe der Massen aller Nukleonen (Protonen und Neutronen) und der tatsächlich gemessenen (stets kleineren) Masse des Kerns.
Der beobachtbare Massendefekt widerlegt die Annahme der klassischen Physik, die Masse bleibe bei allen Vorgängen erhalten.
Der Begriff Massendefekt wurde von Francis William Aston 1927 eingeführt,[3] der ab 1919 als erster festgestellt hatte, dass Atomkerne leichter sind als ihre vermutlichen Bausteine zusammen genommen. Die Arbeit Maßeinheiten für Atomgewichte und Nuklidenmassen[4] von Josef Mattauch enthält u. a. auch Details zur Geschichte des Begriffs Massendefekt und verwandter Größen. Zur Einigung der Chemiker und Physiker auf eine gemeinsame Atomare Masseneinheit im Jahr 1960 hat diese Arbeit wesentlich beigetragen.
Der Massendefekt (englisch Mass defect, Mass deficiency) wird manchmal irrtümlich mit dem Massenexzess (englisch Mass excess), auch Massenüberschuss, gleich gesetzt.[5][6] Es handelt sich aber um zwei verschieden definierte Größen mit deutlich verschiedenen Wertebereichen. Der Massendefekt ist stets positiv (darin drückt sich aus, dass die Materie gegen spontane Zerlegung in die betreffenden Bestandteile stabil ist); der Massenexzess, eine Hilfsgröße zur Erleichterung von Berechnungen, kann negativ oder positiv sein.
Auch die gemessene Atommasse eines neutralen Atoms ist kleiner als die Summe von Kernmasse und den Massen der Elektronen in der Atomhülle. Dieser Massendefekt ist jedoch wesentlich geringer als der Massendefekt von Atomkernen und wird meist vernachlässigt.
Noch geringer ist der Massendefekt, der entsteht, wenn Atome eine chemische Verbindung eingehen.[7] Daher kann man bei chemischen Reaktionen in der Praxis davon ausgehen, dass die Masse erhalten bleibt.
Zusammenhang mit Bindungsenergie
Der Massendefekt lässt sich erklären mit der Erkenntnis der relativistischen Physik, dass man an der Masse die Energie des ruhenden Teilchens ablesen kann: die Bindungsenergie der Nukleonen vermindert die Gesamtmasse, die sich als Summe der Massen der einzelnen Kernbausteine ergeben würde. Somit ist die beim Bau eines Atomkerns freigesetzte Bindungsenergie der Nukleonen nach der Gleichung gleich dem Massendefekt multipliziert mit dem Quadrat der Lichtgeschwindigkeit. Je größer der Massendefekt pro Nukleon ist, desto stabiler ist der Atomkern, da mehr Energie zu seiner Zerlegung aufgewendet werden muss.
Massendefekt bei verschiedenen Massenzahlen
Der gesamte Massendefekt eines Kerns steigt mit der Nukleonenzahl, d. h. der Anzahl der enthaltenen Nukleonen. Gemessen wird er z. B. mittels Massenspektrometern. Wenn man daraus den durchschnittlichen Massendefekt pro Nukleon und damit die Bindungsenergie pro Nukleon (in der Einheit keV) berechnet, ergibt sich der im Bild gezeigte Zusammenhang mit der Massenzahl.
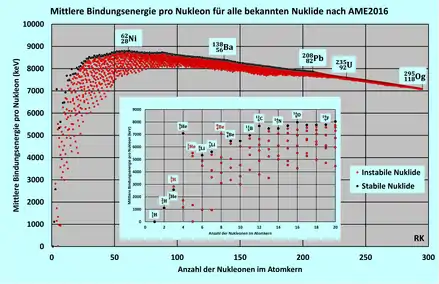
Die höchsten Massendefekte pro Nukleon finden sich bei Nukliden, deren Atomkern aus ungefähr 60 Nukleonen besteht. Eine ganze Reihe von Nukliden haben hier fast identische Werte. Das Nuklid mit dem höchsten durchschnittlichen Massendefekt pro Nukleon ist 62Ni, gefolgt von den Eisenisotopen 58Fe und 56Fe.[8]
Energiefreisetzung bei Kernreaktionen
Wenn leichte Nuklide (in der Abbildung links vom Bindungsenergie-Maximum gelegen) durch Kernfusion (Kernverschmelzung) eine höhere Nukleonenzahl erreichen, dann erhöht sich der Massendefekt pro Nukleon; diese nun zusätzlich fehlende Masse wird in Energie umgewandelt, die genutzt werden kann. Umgekehrt setzen schwere Kerne (rechts vom Bindungsenergie-Maximum gelegen) Energie frei, wenn sie durch Kernspaltung in zwei Kerne mittlerer Masse zerlegt werden. Eine Energie freisetzende Umwandlung erfolgt somit immer „in Richtung zum Maximum des Massendefektes bzw. der Bindungsenergie“, also mit ansteigender Kurve.
Die in der Energietechnologie wichtigen Fusionsreaktionen nutzen allerdings nicht die Region der höchsten Massendefekte bei Massenzahlen um 60, sondern das starke lokale Maximum beim Helium-Isotop 4He aus, denn die relative Massendefekt-Zunahme von den Reaktionspartnern Deuterium und Tritium zum Helium ist besonders groß, und zugleich ist die Coulombbarriere, die für die Verschmelzung der Kerne überwunden werden muss, vergleichsweise gering.
Definition
Der Massendefekt eines Kerns der Masse ist definiert[1][2] als
Dabei ist die Ordnungszahl (Anzahl der Protonen), die Anzahl der Neutronen, die Masse eines Protons und die Masse eines Neutrons.
In guter Näherung kann der Massendefekt auf halbempirischer Basis mittels der – auf dem Tröpfchenmodell beruhenden – Bethe-Weizsäcker-Formel berechnet werden.
In der Praxis wird der Massendefekt nicht für den isolierten Atomkern, sondern für das gesamte, ungeladene Atom des jeweiligen Nuklids, also die Atommasse, angegeben. Dies hat experimentelle Gründe: Vollständig ionisierte, also „nackte“ Atomkerne lassen sich nur schwer gewinnen und handhaben, weil sie mit ihrer hohen positiven elektrischen Ladung sofort Elektronen aus der Umgebung einfangen. Die genaue Messung ihrer Masse wäre daher kaum möglich, besonders bei schweren Elementen (Elementen hoher Ordnungszahl) mit ihrer entsprechend besonders hohen Ladung.
Deshalb wird der Massendefekt eines neutralen Atoms im nuklearen und elektronischen Grundzustand mit einer Masse verwendet und definiert durch
Dabei bedeutet die Masse eines neutralen Atoms des leichten Wasserstoffatoms. Diese Definition des Massendefekts über Bindungsenergien (“Total binding energy in keV”[9]), ist heute (2018) maßgeblich.
Mit der Elektronenmasse kann die Masse eines neutralen Atoms des leichten Wasserstoffatoms ausgedrückt werden als
- .
Dabei ist das Massenäquivalent der Bindungsenergie des Elektrons im Wasserstoffatom. Diese Bindungsenergie, auch Ionisierungsenergie genannt, ist genau bekannt (s. Rydberg-Energie = 13,605 eV bzw. Ionisierungsenergie vom Wasserstoff = 13,598 eV). Eine nukleare Bindungsenergie gibt es bei leichtem Wasserstoff als einem Element mit nur einem Nukleon, dem Proton, nicht.
Die Masse eines neutralen Atoms ist
- ,
mit dem Massendefekt der Elektronenhülle, dem Massenäquivalent der Bindungsenergien aller Elektronen im Atom. Dieser ist, worauf eingangs schon hingewiesen wurde, sehr viel kleiner als der Massendefekt durch die nukleare Bindung und wird oft vernachlässigt oder von der Messgenauigkeit noch nicht erfasst.[4]
Da sich die Massen der Elektronen wegheben, ergibt sich daraus der Zusammenhang zwischen dem Massendefekt des Atoms und dem Massendefekt des Atomkerns zu
- .
Wird der nukleare Massendefekt explizit benötigt, kann der Massendefekt der elektronischen Bindung aus der im Artikel Kernmasse angegebenen Formel 2 näherungsweise berechnet werden. Der Index wird beim Massendefekt meist weggelassen, so auch im folgenden Abschnitt. Wenn von Massendefekt ohne erläuternden Zusatz gesprochen wird, ist meist diese Größe gemeint.
Wie man zu aktuellen Massendefekten kommt
Ähnlich wie CODATA die Zuverlässigkeit und Zugänglichkeit grundlegender physikalischer Konstanten sicherstellt, leistet das Atomic Mass Data Center (AMDC)[10][11][12] dies für Atommassen und verwandte Größen. Aktualisierte, eingeschätzte Daten wurden vom AMDC in zeitlichen Intervallen von etwa 10 Jahren veröffentlicht. Die letzte Aktualisierung Atomic Mass Evaluation 2016 (AME2016)[13][14] wurde im Frühjahr 2017 veröffentlicht. Explizit werden nicht eingeschätzte Werte der Massendefekte, sondern der Bindungsenergien pro Nukleon (Binding energy per nucleon) veröffentlicht, die aus der zitierten Atomic Mass Evaluation entnommen werden können. Für die kernphysikalische Praxis werden parallel dazu mehrere computerlesbare ASCII-Dateien veröffentlicht, von denen die Datei mass16[15] die Werte der Größe unter der Überschrift BINDING ENERGY/A für die nuklearen und elektronischen Grundzustände aller bekannten Nuklide enthält. Aus der Bindungsenergie pro Nukleon erhält man den Massendefekt durch Multiplikation mit der Anzahl der Nukleonen und Division durch das Quadrat der Lichtgeschwindigkeit :
mit[13]
- .
Die Einheit Elektronenvolt (eV) (und damit auch keV) bei aktuellen eingeschätzten Massenexzessen, Bindungsenergien, Q-Werten etc. basiert dabei nicht mehr auf der Einheit Volt des internationalen Einheitensystems, sondern auf der geringfügig modifizierten und genauer messbaren Einheit Maintained Volt V90 (Reproduzierbare Referenz). Seit 1990 wird die Spannungseinheit Volt in dieser Definition mittels des Josephson-Effekts und der Josephson-Konstante festgelegt.[13]
Um konsistent zu bleiben, sollte die CODATA-Empfehlung[16]
deren Standardunsicherheit vielfach größer ist, in diesem Zusammenhang nicht verwendet werden, was allerdings nur bei hohen Ansprüchen an die Genauigkeit eine Rolle spielt.
Beispiele
Die CODATA-Tabelle enthält vier Kernmassen, die von Proton, Deuteron, Triton und Alpha-Teilchen. Für den Atomkern 4He, das Alpha-Teilchen, kann der Massendefekt mit diesen Daten berechnet werden.
Massendefekt des Atomkerns von 4He
Nach CODATA2014[16] beträgt die Masse eines Neutrons 1,008665 u, die eines Protons 1,007276 u. Der Kern des Heliumisotops 4He, besteht aus zwei Protonen und zwei Neutronen. Die Summe der Massen der vier freien Nukleonen ist 4.031883 u, die Massen des Kerns 4He jedoch nur 4,001506 u. Daraus ergibt sich ein Massendefekt von 0,030377 u. Die Masse des Kerns ist also um 0,75 % geringer als die Summe der Massen seiner (freien) Teile.
| Teilchen / Kern | Kernmasse (u) | |||
|---|---|---|---|---|
| n | 2 × | 1,00866491588 | ± | 0,00000000049 |
| p | + 2 × | 1,00727646688 | ± | 0,00000000009 |
| α | - | 4,00150617913 | ± | 0,00000000006 |
| Massendefekt Kern | = | 0,03037658639 | ± | 0,00000000071 |
In der Tabelle sind auch die Standardunsicherheiten der Kernmassen und des Massendefekts enthalten.
Massendefekt des Atoms 4He
Berechnen wir nun analog den Massendefekt, aber mit den Atommassen. Die Datei mass16[15] enthält nicht nur Massendefekte und Bindungsenergien, sondern auch Atommassen explizit, und zwar in der Einheit µu, die hier in der Einheit u wiedergegeben werden. Die Masse des Neutrons nach CODATA 2014 und AME2016 unterscheidet sich nur in der 11. Nachkommastelle, die Masse des leichten Wasserstoffatoms ist 1,007825 u. Die Massen nach der obigen Formel mit N=2 bzw. Z=2 multipliziert und addiert ergibt eine Masse von 4,032980 u. Die Masse des Atoms von 4He ist 4,002603 u. Damit erhalten wir für den Massendefekt des Atoms 0,030377 u, der in der Genauigkeit von 6 Nachkommastellen mit dem des Atomkerns übereinstimmt.
| n / Atom | Atommasse (u) | |||
|---|---|---|---|---|
| n | 2 × | 1,00866491582 | ± | 0,00000000049 |
| 1H | + 2 × | 1,00782503224 | ± | 0,00000000009 |
| 4He | - | 4,0026032541 3 | ± | 0,00000000006 |
| Massendefekt Atom | = | 0,03037664199 | ± | 0,00000000071 |
Bedeutend schneller gelangen wir mit der in der Tabelle[15] enthaltenen Bindungsenergie pro Nukleon von 7073,915 keV zum gesuchten (atomaren) Massendefekt, . Das Ergebnis ist ein erwarteter Massendefekt von 0,030377 u.
Massendefekt beim Aufbau des Nukleons aus Quarks
Vereinzelt wird der Begriff des Massendefekts auch auf den Aufbau des Nukleons aus Quarks bezogen, wo er jedoch nicht in gleicher Weise anwendbar ist. Der Begriff Massendefekt setzt voraus, dass ein Gebilde aus einer zahlenmäßig genau bestimmten Anzahl von Teilen besteht und deren Massen einzeln wohlbestimmte Größen sind. Diese Vorstellung ist in der klassischen Physik begründet und gilt auch in der nichtrelativistischen Quantenmechanik noch in guter Näherung. So wurde der Massendefekt an der Bindung der Nukleonen zu einem Atomkern entdeckt, sobald sich um 1920 die Vorstellung entwickelte, Kerne seien aus Bausteinen aufgebaut.
In der relativistischen Quantenmechanik und Quantenfeldtheorie gilt diese Voraussetzung wohlbestimmter Teilchenzahlen jedoch nicht per se, allenfalls in guter Näherung im nichtrelativistischen Grenzfall. Der Grund ist die ständige Präsenz virtueller Paare von Teilchen und Antiteilchen in unbestimmbarer Anzahl, wie schon gegen 1930 kurz nach der Entdeckung der hier gültigen Dirac-Gleichung festgestellt wurde.[17] Die Verhältnisse innerhalb des Nukleons fallen in den hochrelativistischen Bereich, wo diese Paarerzeugung den wichtigsten Prozess darstellt und nicht nur äußerst kleine Korrekturen an den mit nicht-relativistischen Gleichungen berechneten Größen verursacht (siehe zum Beispiel Lamb-Verschiebung). Was feststeht, ist nicht die Gesamtzahl der Quarks und Antiquarks, sondern nur, dass die Quarks in einer Überzahl von 3 vorhanden sind. Die Ermittlung eines Massendefekts ist also unmöglich.
Einzelnachweise
- Klaus Bethge, Gertrud Walter, Bernhard Wiedemann: Kernphysik. 2., aktualisierte und erw. Auflage. Springer, Berlin / Heidelberg 2001, ISBN 3-540-41444-4, S. 47 (XX, 402 S., eingeschränkte Vorschau in der Google-Buchsuche).
- Wolfgang Demtröder: Experimentalphysik 4: Kern-, Teilchen- und Astrophysik. 4. Auflage. Springer Spektrum, Berlin/Heidelberg 2014, ISBN 978-3-642-21476-9, S. 26 (XX, 534 S., eingeschränkte Vorschau in der Google-Buchsuche).
- Francis William Aston: Bakerian Lecture. A New Mass-Spectrograph and the Whole Number Rule. In: Proc. Roy. Soc. A 115, 1927, S. 487–518, doi:10.1098/rspa.1927.0106.
- Josef Mattauch: Maßeinheiten für Atomgewichte und Nuklidenmassen. In: Zeitschrift für Naturforschung A. 13, 1958, S. 572–596 (online). (PDF)
- Eric B. Paul: Nuclear and particle physics. North-Holland, Amsterdam 1969, ISBN 0-7204-0146-1, S. 5 (englisch, XIV, 494 S., eingeschränkte Vorschau in der Google-Buchsuche). “The difference between the exact atomic mass of an isotope and its mass number is called the mass excess or the mass defect .”
- Harry Friedmann: Einführung in die Kernphysik. Wiley-VCH, Weinheim, Bergstr 2014, ISBN 978-3-527-41248-8, S. 97 (XII, 481 S., eingeschränkte Vorschau in der Google-Buchsuche).
- Douglas C. Giancoli, Oliver Eibl: Physik: Lehr- und Übungsbuch. 3. Auflage. Pearson Studium, München 2010, ISBN 978-3-86894-023-7, S. 1251 (XXV, 1610 S., eingeschränkte Vorschau in der Google-Buchsuche).
- M. P. Fewell: The atomic nuclide with the highest mean binding energy. In: American Journal of Physics. Band 63, Nr. 7, 1995, S. 653–658, doi:10.1119/1.17828, bibcode:1995AmJPh..63..653F (englisch).
- G. Audi, A. H. Wapstra: The 1993 atomic mass evaluation: (I) Atomic mass table. In: Nuclear Physics A. Band 565, Nr. 1, 1993, S. 1–65, doi:10.1016/0375-9474(93)90024-R (in2p3.fr [PDF; abgerufen am 30. September 2018] Definition von Total binding energy auf S. 17).
- Homepage of the Atomic Mass Data Center. (Nicht mehr online verfügbar.) Archiviert vom Original am 13. August 2018; abgerufen am 30. September 2018. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Mirror-homepage of the Atomic Mass Data Center, the historical Web-site of the AMDC. Abgerufen am 30. September 2018.
- Mirror-homepage of the Atomic Mass Data Center, International Atomic Energy Agency, IAEA. Abgerufen am 30. September 2018.
- W. J. Huang et al.: The AME2016 atomic mass evaluation (I). Evaluation of input data; and adjustment procedures. In: Chinese Physics C. Band 41, Nr. 3, 2017, S. 30002 (iaea.org [PDF; abgerufen am 30. September 2018]).
- M. Wang et al.: The AME2016 atomic mass evaluation (II). Tables, graphs and references. In: Chinese Physics C. Band 41, Nr. 3, 2017, S. 30003 (iaea.org [PDF; abgerufen am 30. September 2018]).
- AME2016: Atomic Mass Adjustment, File mass16.txt. (ASCII; 418937 Byte) Abgerufen am 30. September 2018.
- CODATA2014: Fundamental Physical Constants – Complete Listing. (ASCII; 38896 Byte) Abgerufen am 30. September 2018.
- Abraham Pais: Inward Bound: Of Matter and Forces in the Physical World. Clarendon Press, Oxford 1986, S. 350.