Diazotierung
Die Diazotierung ist eine Reaktion der Organischen Chemie und beschreibt die Umsetzung von aromatischen Aminen mit Reagenzien, die ein Nitrosylkation (NO+) als reaktive Spezies enthalten oder freisetzen können, zu Aryldiazoniumsalzen.
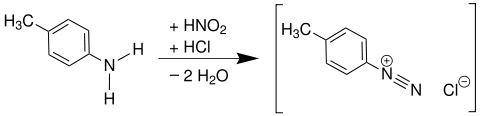
Die Diazotierung bifunktioneller aromatischer Amine wird auch als Tetrazotierung bezeichnet (z. B. p-Phenylendiamin oder Benzidin).
Reaktionsmechanismus
Wenn in wässriger Lösung gearbeitet werden soll, wird Salpetrige Säure (HNO2) als Quelle des Nitrosylkations eingesetzt; in der Praxis wird sie oft erst im Reaktionsgemisch aus Natriumnitrit (NaNO2) und einer Mineralsäure gebildet. Wird die Reaktion in organischer Phase durchgeführt, etwa weil das Amin in Wasser schwer- bzw. unlöslich ist, kann die Salpetrige Säure auch aus ihren organischen Estern (v. a. "Amylnitrit"), freigesetzt werden, was gelegentlich als Knoevenagel-Diazotierung bezeichnet wird.[1] Alternativ kann auch direkt ein Nitrosylsalz verwendet werden, beispielsweise Nitrosyltetrafluoroborat (NOBF4).
Im ersten Schritt der eigentlichen Diazotierung wird die Salpetrige Säure 1 protoniert. Unter Abspaltung von Wasser bildet sich das elektrophile Nitrosylkation 3.

Anschließend greift das freie Elektronenpaar des Stickstoffatoms am Arylamin 4 das positiv geladene Stickstoffatom des Nitrosylkations an. Unter Deprotonierung und Umlagerung entsteht ein Diazohydroxid 7. Diese Verbindung wird am Sauerstoffatom protoniert und unter Abspaltung eines Wassermoleküls entsteht ein Aryldiazonium-Kation 9.[2]

Aryldiazoniumsalze sind sehr reaktionsfähig und werden in der Synthese vielseitig verwendet, insbesondere zur Darstellung von Azofarbstoffen durch Azokupplung. Die Diazotierung ist eine Standardmethode zur Gehaltsbestimmung primärer aromatischer Amine. Die Synthese von Aryldiazoniumsalzen wird bei Temperaturen unter 5 °C durchgeführt. Die hochreaktiven Diazoniumsalze würden sich bei höheren Temperaturen schnell zersetzen. Deshalb wird die Reaktion in situ, also ohne Isolierung der Zwischenprodukte, weitergeführt. Aryldiazoniumchloride sind im festen, trockenen Zustand hochexplosiv. Die Tetrafluoroborate [BF4]− oder Hexafluorophosphate [PF6]− sind beständiger und als Feststoffe handhabbar.
Reaktionen von Aryldiazonium-Salzen
- Verkochung zu Phenolen
- Azokupplung
- Reduktion zum Aromaten (Dediazonierung)
- Schiemann-Reaktion (Umsetzung zum Arylfluorid)
- Sandmeyer-Reaktion (Umsetzung zum Arylcyanid, zu Arylhalogeniden)
- Reduktion zu Arylhydrazinen
- Gomberg-Bachmann-Reaktion
Literatur
- Rainer Beckert (Bearb.): Organikum. 22. Auflage, Wiley-VCH, Weinheim 2004, ISBN 3-527-31148-3.
Einzelnachweise
- Knoevenagel Diazotization Method. In: Comprehensive Organic Name Reactions and Reagents. American Cancer Society, 2010, ISBN 978-0-470-63885-9, S. 1627–1630, doi:10.1002/9780470638859.conrr362.
- T. Laue, A. Plagens: Namens- und Schlagwortreaktionen der Organischen Chemie. Teubner Verlag, 2006, ISBN 3-8351-0091-2, S. 94.