Methämoglobin
Methämoglobin (Met-Hb, auch Hämiglobin oder Ferrihämoglobin) ist ein Derivat des Hämoglobins, des Blutfarbstoffs in den roten Blutkörperchen der Wirbeltiere. Es entsteht, wenn das zweiwertige Eisen im Hämoglobin (Hb) zu dreiwertigem oxidiert wird (Fe2+ → Fe3+). Dies geschieht in den Erythrozyten unter physiologischen Bedingungen durch Anlagerung von Sauerstoff im Sinne einer Autooxidation.[1][2]
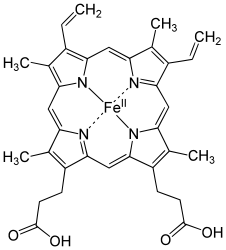
Methämoglobin hat statt Sauerstoff nun den Liganden Wasser. Jedoch sorgt es dafür, dass Hämoglobin in seiner Umgebung Sauerstoff zwar noch aufnehmen, aber nicht mehr abgeben kann. Methämoglobin wird u. a. bei Vergiftungen durch Oxidationsmittel wie Nitrite und Wasserstoffperoxid oder durch aromatische Amino- und Nitroverbindungen wie Anilin und Nitrobenzol gebildet. Ebenso zählt eine Reihe von Arzneimitteln zu den potenziellen Methämoglobinbildnern: Dapson, Prilocain, Sulfonamide, Nitroglycerin, Nitroprussid und Stickstoffmonoxid (NO).
Das Enzym Methämoglobin-Reduktase reduziert Methämoglobin wieder zu Hämoglobin, daher überschreitet der Methämoglobinanteil im Blut des Menschen im Allgemeinen 1,5 % nicht. Eine besondere Empfindlichkeit gegenüber Methämoglobinbildnern besteht bei Säuglingen, da bis zur Mitte des ersten Lebensjahres die Aktivität der Methämoglobin-Reduktase noch nicht voll ausgeprägt ist.
Ab einem Methämoglobinanteil von 15 % ist eine Zyanose zu beobachten, ab 30 bis 40 % zeigen sich Anzeichen des Sauerstoffmangels im Gewebe, insbesondere im Gehirn (Verwirrtheit, Schwindel, Bewusstseinsstörung). Werte zwischen 60 und 80 % sind tödlich. Zu beachten ist, dass die pulsoxymetrisch gemessene Sauerstoffsättigung selbst bei sehr hohen Methämoglobinkonzentrationen 80 bis 85 % nicht unterschreitet.
Die Therapie erfolgt durch die intravenöse Verabreichung von Methylenblau. Diese Substanz ist selbst ein Methämoglobinbildner, kann jedoch die enzymatische Rückbildung hoher Methämoglobinkonzentrationen beschleunigen, wobei sich ein Gleichgewicht bei rund 10 % Methämoglobinanteil einstellt. Ein weiteres Antidot ist Toluidinblau, das auch als Toloniumchlorid bezeichnet wird. Die Austauschtransfusion ist eine Therapiemöglichkeit in sehr ausgeprägten Fällen.
Bei einer Cyanid-Vergiftung werden neben Natriumthiosulfat und Hydroxycobalamin auch Methämoglobinbildner (4-Dimethylaminophenol, abgekürzt DMAP) gegeben. Cyanid hat eine hohe Affinität zu Eisen-III-Ionen. Diese Ionen sind in der Cytochromoxidase (Enzym der Atmungskette der Zellen, lokalisiert in den Mitochondrien) vorhanden. Kommt es zur Komplexierung des Eisen-III-Ions durch Cyanid, wird diese reversibel gehemmt, sodass keine Stoffwechselenergie (ATP) mehr bereitgestellt wird. Durch Bildung von Methämoglobin wird das Cyanid durch Komplexbildung mit dessen Eisen(III)-Ionen im Blut gehalten, sodass der Übertritt ins Gewebe und damit die Hemmung der Cytochromoxidase verhindert wird. Die eigentliche Entgiftung verläuft über die Rhodanase zu Thiocyanat, welche durch die therapeutische Gabe von Schwefelverbindungen (Natriumthiosulfat) beschleunigt wird.
Bedside-Test
Beim Bedside-Test auf Methämoglobinämie wird je ein Tropfen normales und auffälliges Blut auf ein Filterpapier gegeben und nach einer Minute verglichen. Das Methämoglobin-Blut behält eine braune Farbe.[3]
Literatur
- Georg Löffler, Petro E. Petrides (Hrsg.): Biochemie und Pathobiochemie. 7. Auflage. Springer Medizin Verlag, Heidelberg 2003, ISBN 3-540-42295-1.
- Rolf Rossaint, Christian Werner, Bernhard Zwißler (Hrsg.): Die Anästhesiologie. Springer-Verlag, Berlin 2004, ISBN 3-540-00077-1.
Einzelnachweise
- Joachim Rassow u. a.: Biochemie. 1. Auflage. Thieme Verlag Stuttgart 2006, ISBN 3-13-125351-7.
- Saralyn R. Williams: Methemoglobin. In: Luis Ling u. a.: Toxicology Secrets. Hanley & Belfus, Philadelphia 2001, ISBN 1-56053-410-9, S. 181.
- K. A. Evelyn, H. T. Malloy: Micro determination of methaemoglobin and sulphaemoglobin in a sample of blood. In: British Journal of Haematology. vol. 126 (1938), S. 555–652.