Benzaldehyd
Benzaldehyd [ˈbɛnt͡s|aldehyːt], die Hauptkomponente in Bittermandelöl,[5] ist eine farblose bis gelbliche Flüssigkeit mit bittermandelartigem Geruch. Benzaldehyd ist der einfachste aromatische Aldehyd, der in vielen ätherischen Ölen vorkommt.[5] Er leitet sich vom Benzol ab und ist chemisch und strukturell eng mit der Benzoesäure verwandt, die aus ihm durch Oxidation gewonnen werden kann. Er ist eine wichtige Grundchemikalie.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
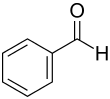 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Benzaldehyd | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C7H6O | ||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit mit bittermandelartigem Geruch[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 106,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,05 g·cm−3 (20 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
179 °C[2] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
schwer in Wasser (6,95 g·l−1 bei 25 °C)[2] | ||||||||||||||||||
| Brechungsindex |
1,5446 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Darstellung
Durch radikalische Chlorierung von Toluol erhält man Benzalchlorid (Dichlormethylbenzol), das mit Wasser zu Benzaldehyd (und HCl) umgesetzt werden kann. Entsprechend erhält man Benzaldehyd auch durch radikalische Bromierung von Toluol und anschließende Hydrolyse. In beiden Fällen tritt beim letzten Reaktionsschritt eine nukleophile Substitution von Halogenid auf.
Auch eine 'direkte' Oxidation von Toluol zu Benzaldehyd ist möglich. Da Benzaldehyd aber leicht zu Benzoesäure oxidiert wird, müssen dabei aber entweder selektive Oxidationsmittel verwendet werden oder es muss der entstehende Benzaldehyd mit einer schnellen Reaktion 'abgefangen' und so vor weiterer Oxidation geschützt werden.
Eigenschaften
Benzaldehyd ist gesundheitsschädlich, wobei eine echte Gesundheitsgefährdung für gewöhnlich nur bei vergleichsweise großen aufgenommenen Mengen zu erwarten ist. Er riecht angenehm süßlich nach Marzipan. Der Geschmack des Benzaldehyds wird allgemein als charakteristisch marzipanartig, jedoch im Reinzustand auch als unangenehm brennend empfunden. In großer Verdünnung, hierbei vor allem mit Ethanol, tritt in zunehmendem Maße eine Wildkirschnote zum Aroma hinzu. Benzaldehyd gehört auch zu den Aromen im Wein. Mit einem Geruchsschwellenwert von 3 Milligramm/l in Weißwein ist es eine wichtige Komponente des Wein-Bouquets.[6] Benzaldehyd besitzt einen Flammpunkt von 64 °C und eine Zündtemperatur von 190 °C.[2] Das Aroma von Marzipan ergibt sich zum größten Teil aus Aromen der verwendeten Mandeln bzw. deren Röstaromen. Ein wichtiger Bestandteil des Aromas ist Benzaldehyd.[7]
Reaktionen
- Benzaldehyd C6H5–CHO wird leicht zu Benzoesäure C6H5–COOH oxidiert. Diese Reaktion erfolgt – wenn auch sehr langsam – auch bei Raumtemperatur und mit Luftsauerstoff (Autoxidation), so dass Benzaldehyd oft mit Benzoesäure verunreinigt ist (bei größeren Mengen als weißer Feststoff im flüssigen Aldehyd). Als Zwischenstufe wird hierbei Peroxybenzoesäure gebildet.
- Benzaldehyd geht für Aldehyde typische Reaktionen ein, die auch zum Nachweis geeignet sind. Er reagiert beispielsweise mit Hydrazin H2N–NH2 und seinen Derivaten (beispielsweise mit Phenylhydrazin C6H5–NH–NH2 unter Bildung eines Phenylhydrazons).
- Die für die Aromaten typische elektrophile Substitution ist beim Benzaldehyd ebenfalls möglich. Bei der Nitrierung müssen die Reaktionsbedingungen sorgfältig gewählt werden, da die Oxidation zu Benzoesäure als Nebenreaktion auftritt. Aus diesem Grund liegt die Ausbeute an Nitrobenzaldehyd meist unter 50 %.
- Benzoin-Addition: Zwei Moleküle Benzaldehyd können sich in Gegenwart von Cyanid als Katalysator zu Benzoin vereinigen. Allgemein versteht man unter der Benzoin-Addition die entsprechende Reaktion aromatischer Aldehyde (mit Benzaldehyd als einfachstem Vertreter).
- Aldol-Kondensation: Darunter versteht man allgemein die Addition von Carbonylen an Aldehyden. So lässt sich zum Beispiel Dibenzalaceton darstellen. Dabei reagiert ein Keton (Aceton) erst einmal allgemein im basischen zu einer sog. Methylenkomponente. Dieses reagiert nach Zugabe von Benzaldehyd (Carbonylkomponente) zu Benzalaceton (Benzylidenaceton). Führt man eine weitere Addition durch Benzaldehyd durch, so reagiert das Benzalaceton diesmal zur Methylenkomponente im basischen Milieu. Durch die Zweitaddition oder auch doppelte Aldolkondensation sind komplexe Moleküle synthetisierbar, wie beispielsweise das Dibenzalaceton (1,5-Diphenylpenta-1,4-dien-3-on).
- Bei der Hydrat-Bildung findet eine Addition von Wasser an die Aldehydgruppe der Carbonylverbindung unter nukleophilem Angriff statt. Ein Nachteil dieser Reaktion ist die Instabilität von Hydraten allgemein.
- Bei der Reaktion mit primären Aminen (R–NH2) bilden sich ebenfalls unter nukleophilem Angriff am zentralen C-Atom der Carbonylgruppe und nachfolgender Abspaltung von Wasser (Kondensation) aus dem Zwischenprodukt ein Azomethin.
Verwendung
Benzaldehyd wird als Aromastoff für eine Bittermandelnote verwendet und ist Ausgangsstoff zur Herstellung einer Reihe anderer aromatischer Geruchs- und Geschmacksstoffe.[5]
Sicherheitshinweise
Benzaldehyd wurde 2016 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Benzaldehyd waren die Besorgnisse bezüglich Verbraucherverwendung, Exposition von Arbeitnehmern und weit verbreiteter Verwendung sowie der möglichen Gefahr durch mutagene Eigenschaften. Die Neubewertung soll ab 2020 von Frankreich durchgeführt werden.[8]
Einzelnachweise
- Eintrag zu BENZALDEHYDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Eintrag zu Benzaldehyd in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- Autorengemeinschaft: Organikum. 22. Auflage. Wiley-VCH, 2004, ISBN 3-527-31148-3, S. 236.
- Eintrag zu Benzaldehyde im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Karl‐Georg Fahlbusch, Franz‐Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg: Flavors and Fragrances. In: Ullmann's Encyclopedia of Industrial Chemistry. Band 15, 2012, S. 73–198, doi:10.1002/14356007.a11_141.
- Rainer Amann: Wie kommt eigentlich die schwarze Johannisbeere in die Scheurebe? (PDF; 2,1 MB) In: Der Badische Winzer. Oktober 2002.
- Mitchell, Alyson E.: Beyond benzaldehyde: The chemistry of raw, roasted and rancid almonds. In: Abstracts of Papers, 253rd ACS National Meeting & Exposition, San Francisco, CA, United States, April 2-6, 2017. Band 253, 2017, S. AGFD-170.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Benzaldehyde, abgerufen am 26. März 2019.
