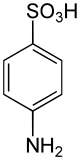
Sulfanilsäure
Sulfanilsäure ist der Trivialname für 4-Aminobenzolsulfonsäure. Aminobenzolsulfonsäuren sind wichtige industrielle Zwischenprodukte zur Synthese von organischen, wasserlöslichen Farbstoffen. Aufgrund der hohen Acidität der Sulfonsäurefunktion liegt, im Gegensatz zu Aminocarbonsäuren, ihr isoelektrischer Punkt (IEP) im Sauren.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Sulfanilsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H7NO3S | ||||||||||||||||||
| Kurzbeschreibung |
weißer, kristalliner Feststoff [1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 173,19 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,485 g·cm−3 (25 °C)[1] | ||||||||||||||||||
| Schmelzpunkt |
Zersetzung bei 288 °C[1] | ||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser: 10 g·l−1 (20 °C) [1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Synthese
Sie wird gewonnen, indem man Schwefelsäure mit Anilin auf 190 °C erhitzt. Damit wird eine Sulfonsäurefunktion in einer elektrophilen Substitution in p-Stellung zur Aminogruppe an den Benzolring gebunden.
Durch ein vorgelagertes Gleichgewicht der Autoprotolyse von Schwefelsäure entstehen H3SO4+-Ionen:
Diese können Wasser abspalten und es bildet sich HSO3+ als Elektrophil, das den Ring in ortho- bzw. para-Stellung zur protonierten Aminogruppe angreifen kann.
Physikalische Eigenschaften
Der Flammpunkt liegt bei >200 °C, die Zündtemperatur bei >400 °C.[1]
Verwendung
Sulfanilsäure wird zur Herstellung von Lunges Reagenz für den Nitrit- bzw. Nitratnachweis benötigt.
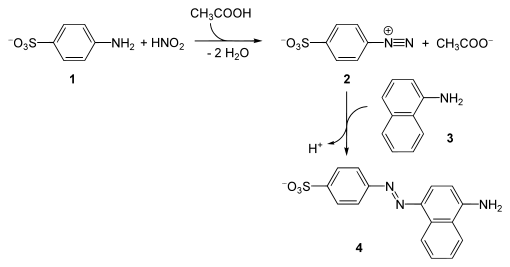
Zudem findet es Verwendung bei der Synthese von Azofarbstoffen wie beispielsweise Methylorange oder Orange II. Sie ist ferner eine Urtitersubstanz nach Arzneibuch.
Besondere Bedeutung hat Sulfanilsäure als Ausgangsstoff für die Herstellung von Chemotherapeutika aus der Gruppe der Sulfonamide. Sulfanilsäure selbst hat keinen nennenswerten Effekt gegen Bakterien, da sie die Membran der Mikroorganismen wegen ihrer hohen Polarität kaum durchdringen kann.[3]
Einzelnachweise
- Eintrag zu Sulfanilsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Dezember 2019. (JavaScript erforderlich)
- Eintrag zu Sulphanilic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- S. Y. Hwang, D. A. Berges, J. J. Taggart, C. Gilvarg: Portage transport of sulfanilamide and sulfanilic acid. In: Journal of medicinal chemistry. Band 32, Nummer 3, März 1989, S. 694–698, PMID 2645404.
