Béchamp-Reduktion
Die Béchamp-Reduktion ist die älteste Reaktion in der industriellen organischen Chemie zur Herstellung primärer aromatischer Amine aus Nitroaromaten durch Reduktion mit Eisen und Mineralsäuren. Die Béchamp-Reduktion ist heute weitgehend durch die katalytische Hydrierung verdrängt worden, wird jedoch noch insbesondere in der Farbstoffindustrie und zur Produktion von Eisenoxidpigmenten eingesetzt.[1]

Übersichtsreaktion
Im einfachsten Fall wird Nitrobenzol zu Anilin reduziert durch die Einwirkung des Reduktionsmittels Salzsäure/Eisen:

Allgemeines
Die Reduktion aromatischer Nitroverbindungen zu den entsprechenden Aminen mit Eisen oder Eisen(II)-Salzen in wässriger Salzsäure wurde 1854 von Antoine J. Béchamp als Spezialfall der Reduktion mit unedlen Metallen in Säuren entdeckt.[2] Neben Eisen können auch Zink und Zinn als Reduktionsmitteln verwendet werden. Zudem werden bei dieser Reaktion einige Nebenprodukte produziert, wie Hydroxylamin, Hydrazin, Hydrazobenzol und Azobenzol mit dem Azofarbstoffe hergestellt werden können.[3] Aus diesen Bestandteilen wurde auch der mögliche Reaktionsmechanismus hergeleitet. Übliche Reaktionstemperaturen sind zwischen 80 °C und 89 °C, wobei Ausbeuten von bis zu 57 % erreicht werden. Des Weiteren wurde herausgefunden, dass in neutralen organischen Lösungsmitteln wie Acetonitril oder Propylencarbonat höhere Ausbeuten erreicht werden.[4]
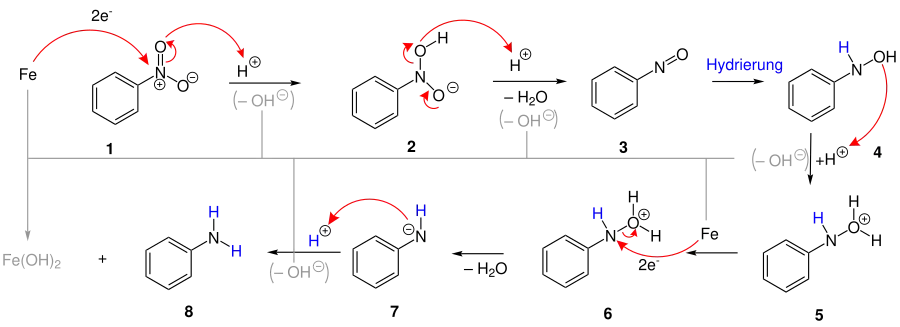
Vorgeschlagener Reaktionsmechanismus
Zunächst findet am Nitroaromaten 1 (im Beispiel Nitrobenzol) ein durch Säure katalysierter Elektronentransfer vom Eisen auf den Stickstoff statt. Durch die Aufnahme eines weiteren Protons spaltet sich Wasser ab, die zur Verschiebung von Elektronen des Sauerstoffs zum positiv geladenen Stickstoff führt 3. Es folgt eine Hydrierung der Doppelbindung, woraufhin sich erneut ein Äquivalent Wasser abspaltet 6. Durch einen gleichzeitigen Elektronentransfer ist der Stickstoff nach der Abspaltung negativ geladen und kann ein weiteres Proton aufnehmen 7. Bei der Hydrierung und dem Elektronentransfer wird vom Eisen eine Hydroxidion aufgenommen und Eisenhydroxid [Fe(OH2) bzw. Fe(OH3)] entstehen, welches sich schließlich in Eisen(II,III)-oxid umwandelt. Als Endprodukt entsteht Anilin 8.[5]
Stöchiometrie
- Nitroaromat, Eisen und Wasser reagieren zu Aminoaromaten und Eisen(II,III)-oxid.
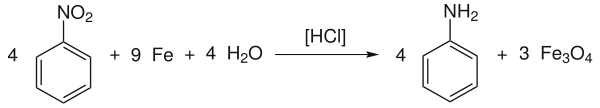
Beispiel: Reduktion von Nitrobenzol zu Anilin
Die angegebene Reaktionsgleichung gibt den Gesamtprozess wieder, welcher sich in folgende Reaktionsschritte aufbaut:[6][1]
Das Eisen(II)-chlorid (FeCl2) entsteht fortlaufend aus der Salzsäure und Eisen.
Vor- und Nachteile
Der wichtigste Vorteil sind die niedrigen Verfahrenskosten. Eisen ist billig, das anfallende Eisen(II,III)-oxid kann als Farbpigment weiterverkauft werden und ist somit nicht als Abfall, sondern als Wertprodukt anzusehen.[7] Die Reaktion erfordert eine genaue Einhaltung sorgfältig ausgearbeiteter Reaktionsparameter, was mit dem Laux-Prozess gelungen ist und in großem Umfang angewandt wird. In großtechnischen Anlagen ist dies in der Regel besser zu kontrollieren als im Labormaßstab. Auch ist die genaue Ausarbeitung des Verfahrens zeitintensiv. Im Labor reduziert man deshalb häufig katalytisch oder mit anderen unedlen Metallen wie beispielsweise Zink.
Ein weiterer Vorteil der Methode ist, dass Aromaten und Doppelbindungen nicht hydriert werden.
Im industriellen Maßstab wird heute jedoch auch häufig katalytische Hydrierungen zur Reduktion von Nitroaromaten zu Anilinen benutzt.[8]
Literatur
- Organikum. 23. Auflage, Wiley-VCH Verlag GmbH und Co. KGaA, 2000, S. 633–636, ISBN 978-3-527-32292-3
- Zerong Wang: Comprehensive Organic Name Reactions and Reagents. Volume 1, Wiley 2009, S. 284–287, ISBN 978-0-471-70450-8
- Bradford P. Mundy, Michael G. Ellerd, Frank G. Favaloro Jr.: Name Reactions and Reagents in Organic Syntheses. Second Edition, Wiley-Interscience 2005, S. 384–385, ISBN 0-471-22854-0
Einzelnachweise
- Anthony R. Cartolano et al.: Amines by Reduction. In: Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley and Sons, New York 2004, 476–498.
- Antoine Béchamp: De l'action des protosels de fer sur la nitronaphtaline et la nitrobenzine. Nouvelle méthode de formation des bases organiques artificielles de Zinin. In: Annales de chimie et de physique. 4, 1854, S. 186–196 (Digitalisat auf Gallica).
- Kouichi Ohe, Sakae Uemura, Nobuyuki Sugita, Hideki Masuda, Toru Taga: The Journal of Organic Chemistry. Band 54, 1989, S. 4169–4174, doi:10.1021/jo00278a034.
- Alexander G. Kolchinski und Nathaniel W. Alcock: The Journal of organic chemistry. Band 63, 1998, S. 4515–4517, doi:10.1021/jo980057s.
- Zerong Wang: Comprehensic Organic Name Reactions and Reagents, Volume 1, Wiley, 2009, S. 284, ISBN 978-0-471-70450-8.
- P. H. Groggins: Unit Processes in Organic Synthesis. 5th ed. McGraw-Hill, New York, 1958, S. 143.
- Thomas Kahl, Kai-Wilfrid Schröder, F. R. Lawrence, W. J. Marshall, Hartmut Höke, Rudolf Jäckh: Aniline. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, 2000, ISBN 3-527-30673-0, doi:10.1002/14356007.a02_303.
- John J. McKetta: Nitrobenzene and Nitrotoluene. In: Encyclopedia of Chemical Processing and Design: Volume 31 - Natural Gas Liquids and Natural Gasoline to Offshore Process Piping: High Performance Alloys. CRC Press, 1989, ISBN 0-8247-2481-X.