Sudan I
Sudan I ist ein synthetisch hergestellter Azofarbstoff aus der Gruppe der Sudanfarbstoffe.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
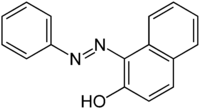 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Sudan I | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C16H12N2O | |||||||||||||||
| Kurzbeschreibung |
braun-oranges bis rotes Pulver[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 248,28 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Darstellung
Sudan I kann durch Azokupplung von diazotiertem Anilin mit 2-Naphthol dargestellt werden.[3]
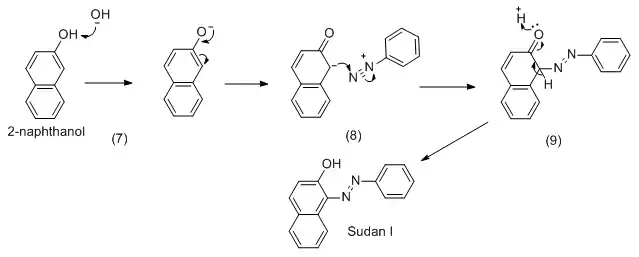
Eigenschaften
Sudan I besteht aus β-Naphthol mit einer Arylazo-Gruppe, die an die α-Position von Naphthol gebunden ist. Weil sie die funktionelle Gruppe R–N=N–R' enthält, gehört es zu den Azoverbindungen.[4] Es zeigt sich, dass Sudan I an oxidativem Photoabbau durch zwei verschiedene Mechanismen, dem Singulett-Sauerstoffabbau und dem Abbau der freien Radikale leidet, wodurch die Echtheit der Materialien verringert wird. Dieser Effekt kann durch die Einführung radikalischer Quenching-Substituenten reduziert werden.[5]
Metabolismus
Während der Metabolismus von Sudan I beim Menschen noch nicht verstanden wird, ist sein Metabolismus bei Kaninchen bekannt. Dort wird Sudan I hauptsächlich durch die Leber durch oxidative oder reduktive Reaktionen metabolisiert.[6]
Azo-Reduktion von Sudan I produziert Anilin und 1-Amino-2-naphthol, und diese Reaktion scheint für die Entgiftung verantwortlich zu sein. In vivo werden nach Oxidation des Sudan I C-hydroxylierte Metabolite als Hauptoxidationsprodukte gebildet und im Urin ausgeschieden. Diese Metaboliten werden auch nach Oxidation mit rattenhepatischen Mikrosomen in vitro gefunden.
Die C-hydroxylierten Metabolite können als Entgiftungsprodukte betrachtet werden, während das durch mikrosomenkatalysierte enzymatische Aufspaltung der Azogruppe des aus Sudan I gebildeten Benzindiazoniumion (BDI) mit der DNA in vitro reagiert. Das bei dieser Reaktion gebildete Haupt-DNA-Addukt wurde als 8-(Phenylazo)guanin identifiziert, das auch in der Leber-DNA von Ratten gefunden wurde, die dem Sudan I ausgesetzt waren.[7][8]
Verwendung

Sudan I wird unter anderem für gelbe Semtex-Färbungen verwendet.[9] Es findet industrielle Verwendung zum Färben von Heizöl, Schuhcremes, Bohnerwachs und zur Herstellung von Schreibfarben.[10]
In der Europäischen Union sind die Farbstoffe Sudan I bis IV seit 1995 nicht mehr als Lebensmittelzusatzstoffe zugelassen, da sie im Körper in Amine aufgespalten werden können, von denen einige karzinogen sind.[11] Seit den Mitte 2003 eingeführten EU-weiten Kontrollen werden Sudanfarbstoffe immer wieder in importierten Produkten nachgewiesen. Konzentrierten sich die Kontrollen bisher auf Chilipulver, sind jetzt auch Kurkuma und natives Palmöl im Visier. Die Stoffe finden sich jedoch auch in tomaten- und paprikahaltigen Produkten wie beispielsweise Pesto.[12]
Sicherheitshinweise
Sudan I kann allergische Hautreaktionen und Reizungen der Haut verursachen, was vor allem bei Textilarbeitern oder dem Tragen von eng anliegenden Textilien, die mit diesem Farbstoff gefärbt werden, auftreten kann. Allergische Reaktionen werden induziert, wenn der Azofarbstoff an das menschliche Serumalbumin (HSA) bindet und ein Farbstoff-HSA-Konjugat mit bildet, was eine Freisetzung von Histamin bewirkt. Bei Sudan I vermutet man auch, dass es genetische Defekte auslösen kann. Die Mutagenität und die genetische Gefährdung wurden mit dem Ames-Test und Tierversuchen beurteilt. Darüber hinaus besteht der Verdacht auf kanzerogene Wirkung.[13][14][15]
Einzelnachweise
- Eintrag zu 1-Phenylazo-2-naphthol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. November 2016. (JavaScript erforderlich)
- Eintrag zu 1-phenylazo-2-naphthol im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Synthesis of Sudan‐I
- Clayden, J. G., N. Warren, S. Wothers, P., Organic Chemistry 1st ed.; Oxford University Press: 2001.
- Griffiths, J.; Hawkins, C., Synthesis and photochemical stability of 1-phenylazo-2-naphthol dyes containing insulated singlet oxygen quenching groups. Journal of Applied Chemistry and Biotechnology 1977, 27 (4), 558–564; doi:10.1002/jctb.5020270410.
- Childs, J. J.; Clayson, D. B., The metabolism of 1-phenylazo-2-naphthol in the rabbit. Biochemical Pharmacology 1966, 15 (9), 1247–1258; doi:10.1016/0006-2952(66)90034-7.
- Stiborova, M.; Asfaw, B.; Anzenbacher, P.; Hodek, P., A New Way To Carcinogenicity Of Azo Dyes: The Benzenediazonium Ion Formed From A Non-Aminoazo Dye: 1-Phenylazo-2-Hydroxynaphthalene (Sudan-I) By Microsomal-Enzymes Binds To Deoxyguanosine Residues Of DNA. Cancer Letters 1988, 40 (3), 327–333; doi:10.1016/0304-3835(88)90092-4.
- Stiborova, M.; Asfaw, B.; Frei, E., Peroxidase-Activated Carcinogenic Azo-Dye Sudan-I (Solvent Yellow-14) Binds To Guanosine In Transfer-Ribonucleic-Acid. General Physiology and Biophysics 1995, 14 (1), 39–49; PMID 8529865.
- Alexander Beveridge: Forensic Investigation of Explosions, CRC Press, 1998, ISBN 0-7484-0565-8, S. 297 (eingeschränkte Vorschau in der Google-Buchsuche).
- Landeslabor Berlin: Jahresbericht 2010 - Landeslabor Berlin-Brandenburg.
- Bundesinstitut für Risikobewertung: Farbstoffe Sudan I bis IV in Lebensmitteln (PDF; 158 kB), Stellungnahme des BfR vom 19. November 2003.
- lgl.bayern.de: Lebensmittel: Sudan 1 in Gewürzen und Gewürzzubereitungen - Ergebnisse der Untersuchungen zwischen Juli 2003 und Dezember 2004 – Internetangebot, abgerufen am 10. November 2016.
- Hunger, K., Toxicology and toxicological testing of colorants. Review of Progress in Coloration and Related Topics 2005, 35 (1), 76–89; doi:10.1111/j.1478-4408.2005.tb00161.x.
- Maronpot, R.; Boorman, G., Interpretation of rodent hepatocellular proliferative alterations and hepatocellular tumors in chemical safety assessment. Toxicologic Pathology 1982, 10 (2), 71–78; doi:10.1177/019262338201000210.
- Matsumura, S.; Ikeda, N.; Hamada, S.; Ohyama, W.; Wako, Y.; Kawasako, K.; Kasamatsu, T.; Nishiyama, N., Repeated-dose liver and gastrointestinal tract micronucleus assays with CI Solvent Yellow 14 (Sudan I) using young adult rats. Mutation research. Genetic toxicology and environmental mutagenesis 2015, 780–781, 76–80; doi:10.1016/j.mrgentox.2014.09.002.


