Spektrochemische Reihe
Die spektrochemische Reihe ist ein Begriff aus der Ligandenfeldtheorie. Sie ordnet verschiedene Liganden nach ihrer Fähigkeit, die d-Orbitale eines Metallatoms energetisch aufzuspalten. Die spektrochemische Reihe der Liganden wurde 1938 vom japanischen Chemiker R. Tsuchida aufgestellt.[1]
Spektrochemische Reihe der Liganden
- O22− < I− < Br− < S2− < SCN− < Cl− < N3− < F− < NCO− < OH− < ONO− < ox2− < H2O < NCS− < NC− < py < NH3 < en < bipy < phen < NO2− < CNO− < CN− < CO
Die in der Reihe links stehenden Liganden erzeugen eine schwache Ligandenfeldaufspaltung und Synchronisation und können als starke Lewis-Base bzw. starke π-Donoren angesehen werden. Sie begünstigen eher die Entstehung von high-spin-Komplexen.
Je weiter rechts die Liganden stehen, desto größer ist ihre erzeugte Ligandenfeldaufspaltung, was tendenziell eher zur Ausbildung eines low-spin-Komplexes führt.
Dementsprechend können die Liganden auf der rechten Seite im Verhältnis zu den links stehenden als starke Lewis-Säuren bzw. starke π-Akzeptoren gesehen werden.
Kriterien für die Einordnung der Liganden in die Reihe
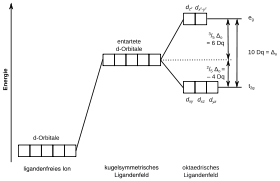
- Elektronegative Liganden bewirken eine geringere Aufspaltung, da sie die Elektronendichte vom Zentralteilchen nehmen und somit die Wechselwirkung zwischen den Elektronen geringer wird. Ebenfalls bewirken größere Liganden eine geringere Aufspaltung des Ligandenfelds, da ihre Elektronen auf ein größeres Volumen verteilt sind.
- Aus der Molekülorbitaltheorie lässt sich ein Zusammenhang mit der Befähigung eines Liganden, eine pi-Rückbindung aufzubauen und der Aufspaltung der d-Orbitale im Komplex ableiten.
Spektrochemische Reihe der Metallionen
- Mn2+ < Ni2+ < Co2+ < Fe2+ < V2+ < Fe3+ < Cr3+ < V3+ < Co3+ < Mn4+ < Mo3+ < Rh3+ < Pd4+ < Ir3+ < Re4+ < Pt4+
Die Ligandenfeldaufspaltung hängt auch vom Metallkation ab. Je höher die Ladung des Metallkations, desto höher ist auch die Aufspaltung und desto eher bilden sich low-spin-Komplexe. Die in dieser Reihe links stehenden Metallionen bewirken eine geringe Ligandenfeldaufspaltung und bilden daher eher high-spin-Komplexe. Die rechts stehenden bewirken eine hohe Aufspaltung und bilden daher eher low-spin-Komplexe.
Kriterien für die Einordnung der Metalle in die Reihe
Eine höhere Oxidationsstufe des Zentralteilchens hat direkten Einfluss auf die Liganden, die hierdurch dem Zentralteilchen näher kommen. Die elektrostatische Abstoßung zwischen den Liganden-Elektronen und den d-Elektronen des Zentralteilchens wird erhöht.
4.svg.png.webp)
4.svg.png.webp)
Beispiel: Nickel-Komplexe
Ein Kriterium für die Stärke der Aufspaltung stellt die Geometrie bei vierfach koordinierten Komplexen dar. Hier sind sowohl tetraedrische als auch quadratisch-planare Geometrie möglich:
- Bei Nickel(II)-Komplexen bilden sich bei stark aufspaltenden Liganden quadratisch-planare und bei weniger stark aufspaltenden Liganden tetraedrische Koordinationspolyeder aus.
- Betrachtet man hingegen Nickeltetracarbonyl, so stellt man trotz des stark aufspaltenden Carbonyl-Liganden eine tetraedrische Geometrie fest: Nickel(0) enthält im Valenzzustand 10 Valenzelektronen, was eine quadratisch-planare Geometrie energetisch ungünstig macht, da energetisch höher liegende MOs befüllt werden. Eine Betrachtung mit der Ligandenfeldtheorie ist hierbei unnötig und es wird das VSEPR-Modell verwendet.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
Literaturstellen
- R. Tsuchida, in: Bull. Chem. Soc. Jpn. 1938, 13, 388 und 436.