Natrium-Ionen-Akkumulator
Der Natrium-Ionen-Akkumulator, englisch sodium-ion battery (abgekürzt SIB), dient – wie alle Akkumulatoren – der Speicherung elektrischer Energie und nutzt dabei Ionen des Alkalimetalls Natrium.
2017 spielten Natrium-Ionen-Akkumulatoren wirtschaftlich nur eine geringe Rolle, waren aber in verschiedenen Formen und Variationen Gegenstand von intensiven Forschungsarbeiten. 2018 hatte sich die Position der Natrium-Ionen-Akkumulatoren etwas verbessert, da die Herstellungskosten gegenüber Lithium-Akkus gesunken und eine weitere Rationalisierung durch einfachere Bauweise bei höheren Stückzahlen zu erwarten war.[1] Ende 2021 verkündete der Akku-Hersteller CATL, bis 2023 in die Massenproduktion von Natrium-Ionen-Akkumulatoren einsteigen zu wollen.[2]
Begriff
Der Begriff Natrium-Ionen-Akkumulator kann unterschiedlich definiert werden, umfassender oder enger gefasst.
Natrium-Ionen-Akkumulator im weiteren Sinn
Man kann unter Natrium-Ionen-Akkumulator alle Akkumulatoren zusammenfassen, die Natriumionen zum Ladungstransport im Elektrolyten nutzen.
Die technisch wichtigsten Umsetzungen, die unter diese weite Definition fallen, sind Thermalbatterien (Hochtemperatur-Batterien), die flüssiges Natrium und einen festen Elektrolyten nutzen. Die aufgrund ihrer kommerziellen Nutzung bedeutenden Beispiele dazu sind die Zebra-Batterie und der Natrium-Schwefel-Akkumulator.

Natrium-Ionen-Akkumulator im engeren Sinn
Analog zur engen Definition des Begriffs Lithiumionenakkumulator, der Lithiumbatterien mit Lithiummetallelektroden ausschließt, kann man Natrium-Ionen-Akkumulatoren so definieren, dass dort Natriumionen zur Ladungsspeicherung in den Elektroden genutzt werden. Dadurch werden die oben genannten Zellen mit flüssigem Natrium ausgeschlossen, da in dieser Natriummetallelektrode keine Natriumionen vorliegen.
Es gibt eine sehr intensive Forschung, die versucht, aufbauend auf den großen Erfolg der Lithiumionenakkumulatoren, Natriumionenbatterien mit organischen Elektrolyten zu entwickeln. Ein großer Vorteil von organischen Elektrolyten ist, dass sie größere Zellspannungen als wässrige Lösungen erlauben. Natriumionenbatterien dieses Typs werden bei Umgebungstemperatur betrieben.
Es gibt auch Natriumionenbatterien mit wässrigen Elektrolyten. Diese werden Salzwasserbatterie genannt, vor allem wenn der wässrige Elektrolyt ungiftig ist. Wässrige Lösungen sind deutlich preiswerter als organische Elektrolyte. Sie sind unbrennbar und daher sicherer als die meisten Lithiumionenakkumulatoren – thermisches Durchgehen ist nicht möglich. Sie erlauben aber nur kleine Spannungen. Die Energiedichte solcher Natrium-Ionen-Akkumulatoren ist daher klein, und sie eignen sich nicht für den mobilen Einsatz. Solche Akkus werden im kleinen Maßstab kommerziell als stationäre Akkus, z. B. als Heimspeicher für Solarenergie, verkauft.
Vor- und Nachteile von Natriumionenakkumulatoren
Natrium ist wesentlich preiswerter als Lithium und weltweit leicht und praktisch unbegrenzt verfügbar.[3] Daraus ergibt sich ein Kostenvorteil bei den Rohmaterialien der Batterieherstellung.[3] Bedeutsamer ist jedoch, dass Natrium-Ionen-Akkumulatoren ohne Kupfer, Cobalt und Nickel auskommen können.[4] Beispielsweise ergab eine erste Abschätzung, dass die Natrium-Ionen-Technik günstiger ist als die Lithium-Ionen-Technik.[5] Auch hinsichtlich der Nachhaltigkeit und der Handhabung (siehe: Gefahren beim Umgang mit Lithium-Ionen-Akkus) sind Natriumzellen eine vorteilhafte Alternative. Hinzu kommt, dass sich die Zellen auf denselben Anlagen wie Lithium-Ionen-Akkumulator fertigen lassen.[6] Aufgrund der Verwendung im Überfluss vorkommender und damit günstiger Materialien gelten sie als vielversprechende Akkumulatorbauform für Energiespeicher, bei denen es nicht auf das Gewicht des Akkumulators ankommt, beispielsweise stationäre Batterie-Speicherkraftwerke für Windenergie und Solarenergie.[7]
Die britische Firma Faradion, in Partnerschaft mit dem größten britischen Akkuhersteller AMTE, und die chinesische Firma CATL, Tesla-Zulieferer und der größte Akkuhersteller der Welt, haben einen Natrium-Ionen-Akkumulator für die Elektromobilität entwickelt. Sie kommen ohne Lithium, Kobalt und Kupfer aus bei 90 Prozent der Energiedichte von Lithium-Eisenphosphat-Akkus (LFP) und können problemlos vollständig entladen werden, weshalb sie kein Gefahrgut sind. Die Lebensdauer soll bei 1000 vollen Ladezyklen liegen oder 3000 bei 80 % Ladung. Die Energiedichte soll 150 bis 160 Wattstunden pro Kilogramm (Wh/kg) erreichen. Die Akkus sollen daher neben den gängigen Lithium-Akkus zu einer echten Alternative für die Elektromobilität werden.[8][9][10]
Thermalbatterien mit Natriummetall
Diese nutzen einen Festelektrolyten (vom Typ Natrium-β-aluminat) zum Transport der Natriumionen. Da die Leitfähigkeit von Festelektrolyten nur bei genügend hohen Temperaturen groß genug ist, müssen die Zellen auf hoher Temperatur gehalten werden. Dafür kann die Minuspolseite aus dem preiswerten flüssigen Natrium bestehen, die Pluspolseite aus Schwefel beim Natrium-Schwefel-Akkumulator und aus Nickelchlorid bei der Zebra-Batterie (=Natrium-Nickelchlorid-Akkumulator). Im Gegensatz zu den preiswerten Elektroden ist der Festelektrolyt relativ teuer.
Natriumionenbatterien mit wässrigen Elektrolyten
Dieser Akkumulatortyp wird unter anderem mit Bezeichnungen wie Salzwasserbatterie, englisch Salt water battery, vermarktet.[11] Eine Besonderheit dieses Akkumulatortyps ist, dass er im Gegensatz zu den meisten Akkumulatoren, speziell der Gruppe der Lithium-Ionen-Akkumulatoren, tiefentladefest ist und bis zu einer Entladeschlussspannung von 0 V entladen werden kann, ohne Schaden zu nehmen.
Die Energiedichte der wässrigen Natrium-Ionen-Akkumulatoren liegt mit 12 bis 24 Wattstunden pro Liter weit unterhalb derer von Blei- oder Lithium-Ionen-Akkumulatoren,[12] was zwar bei ortsfesten Anlagen kein Problem darstellt, diese Natrium-Ionen-Akkus jedoch für mobile Anwendungen ungeeignet macht. Sie weisen zudem eine geringere Zyklenfestigkeit auf.[13]
Die entnehmbare Kapazität ist stark von der Entladestromstärke abhängig. Deshalb eignen sich solche Natrium-Ionen-Akkus eher für Anwendungen, die geringe bis mittlere Ströme benötigen, dies jedoch über lange Zeiträume.[12]
Natrium-Ionen-Akkumulatoren mit organischen Elektrolyten
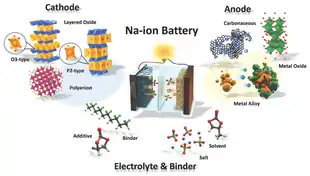
Bei der Gruppe der Natrium-Ionen-Akkumulatoren mit organischen Elektrolyten, die zurzeit intensiv erforscht werden, gibt es eine große Vielfalt an vorgeschlagenen Materialien für Anode, Kathode und Elektrolyt.[3] Daraus ergeben sich viele denkbare Kombinationen, die zu unterschiedlichen Akkumulator-Parametern führen, zu denen vor allem die Zellspannung gehört. Die am häufigsten vorgeschlagenen Elektrolyte für Natrium-Ionen-Akkumulatoren sind, analog zu Lithium-Ionen-Akkumulatoren, Lösungen von Natriumsalzen wie zum Beispiel Natriumhexafluorophosphat. Das häufig in akademischer Forschung verwendete Natriumperchlorat ist aufgrund seiner Explosionsgefahr für kommerzielle Zwecke ungeeignet.[14] Das Lösungsmittel besteht meist aus binären oder tertiären Mischungen von verschiedenen organischen Carbonaten wie Propylencarbonat, Ethylencarbonat und Diethylcarbonat. Je nach erwünschten Eigenschaften kommen auch kurzkettige Ether gelegentlich zum Einsatz.[15] Als Anodenmaterial wird unter anderem Kohlenstoff in Form von Graphen eingesetzt – metallisches Natrium ist als Anodenmaterial zwar prinzipiell möglich, das Alkalimetall wird allerdings durch die Substanzen im Elektrolyt chemisch angegriffen. Als Kathodenmaterialien werden verschiedene, Natriumionen enthaltende Materialien wie Phosphate und Diphosphate erforscht, beispielsweise Natriumeisenphosphat.
Je nach verwendeten Materialien ergeben sich daraus Zellspannungen im Bereich zwischen 2 und 3,5 Volt.[13]
Literatur
- Bruno Scrosati, Jürgen Garche, Werner Tillmetz: Advances in Battery Technologies for Electric Vehicles. 1. Auflage. Woodhead Publishing, 2015, ISBN 978-1-78242-377-5.
Nachweise
- Solarspeicher-Alternative: Batterie aus Salz und Wasser. Abgerufen am 27. Januar 2019.
- Was die günstige Natrium-Batterie von CATL kann - AUTO MOTOR UND SPORT. In: auto-motor-und-sport.de. Abgerufen am 21. Februar 2022.
- Verònica Palomares, Paula Serras, Irune Villaluenga, Karina B. Hueso, Javier Carretero-González, Teófilo Rojo: Na-ion batteries, recent advances and present challenges to become low cost energy storage systems. In: Energy and Environmental Science. Band 5, Februar 2012, S. 5884–5901, doi:10.1039/c2ee02781j.
- Jens F. Peters, Alexandra Peña Cruz, Marcel Weil: Exploring the Economic Potential of Sodium-Ion Batteries. In: Batteries. Band 5, Nr. 1, 2019, S. 10, doi:10.3390/batteries5010010 (mdpi.com [abgerufen am 19. Oktober 2020]).
- Dominique Larcher, Jean-Marie Tarascon: Towards greener and more sustainable batteries for electrical energy storage. In: Nature Chemistry. Band 7, Nr. 1. Springer Nature, Januar 2015, ISSN 1755-4330, S. 19–29, doi:10.1038/nchem.2085 (nature.com).
- nano vom 7. Februar 2022
- Huilin Pan, Yong-Sheng Hu, Liquan Chen: Room-temperature stationary sodium-ion batteries for large-scale electric energy storage. In: Energy and Environmental Science. Band 6, Juni 2013, S. 2338–2360, doi:10.1039/c3ee40847g.
- Golem:Natrium-Ionen-Akkus werden echte Lithium-Alternative
- CATL stellt erste Natrium-Ionen-Akkus für Autos vor bei golem.de, eingefügt am 4. August 2021
- Wird die Akkuindustrie nach 2021 endlich vernünftig? golem.de, 29. Dezember 2021
- Die Salzwasserbatterie. Abgerufen am 11. Dezember 2017.
- Photovoltaik.eu: Die Salzwasserbatterie, Artikel vom 31. August 2015
- Jang-Yeon Hwang, Seung-Taek Myung, Yang-Kook Sun: Sodium-ion batteries: present and future. In: Chemical Society Reviews. Band 46, Nr. 12, Juni 2017, S. 3529–3614, doi:10.1039/C6CS00776G.
- Gebrekidan Gebresilassie Eshetu, Sylvie Grugeon, Huikyong Kim, Sangsik Jeong, Liming Wu: Comprehensive Insights into the Reactivity of Electrolytes Based on Sodium Ions. In: ChemSusChem. Band 9, Nr. 5, 8. März 2016, ISSN 1864-5631, S. 462–471, doi:10.1002/cssc.201501605 (wiley.com [abgerufen am 20. Oktober 2020]).
- Yi Sun, Pengcheng Shi, Hongfa Xiang, Xin Liang, Yan Yu: High-Safety Nonaqueous Electrolytes and Interphases for Sodium-Ion Batteries. In: Small. Band 15, Nr. 14, 2019, ISSN 1613-6829, S. 1805479, doi:10.1002/smll.201805479 (wiley.com [abgerufen am 20. Oktober 2020]).