Natriumdichromat
Natriumdichromat(VI) (Na2Cr2O7) ist ein Natriumsalz der Dichromsäure (H2Cr2O7) und zählt zu den Chromaten. Es kristallisiert auch als Dihydrat (Na2Cr2O7 · 2 H2O, molare Masse 297,99 g/mol).
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
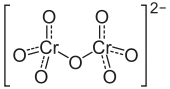 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Natriumdichromat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | Na2Cr2O7 | ||||||||||||||||||
| Kurzbeschreibung |
orangerote, geruchlose, hygroskopische Kristallnadeln[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 261,97 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
2,5 g·cm−3 [1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
400 °C (Zersetzung)[1] | ||||||||||||||||||
| Löslichkeit |
sehr gut in Wasser (2355 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend, erbgutverändernd, fortpflanzungsgefährdend (CMR)[3]; zulassungspflichtig[4] | ||||||||||||||||||
| MAK |
Schweiz: 5 μg·m−3 (berechnet als Chrom)[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung

Natriumdichromat wird im großen Maßstab aus Erzen mit Chrom(III)-oxid gewonnen. Das Erz wird mit Basen (in der Regel Natriumcarbonat) bei hohen Temperaturen in Anwesenheit von Sauerstoff behandelt:
Reaktionen in wässriger Lösung
Die wässrige Lösung reagiert sauer, da sich ein Chromat-Dichromat-Gleichgewicht einstellt und zum großen Teil Hydrogenchromat-Anionen (HCrO4−) gebildet werden. Das Hydrogenchromat-Anion reagiert als Säure:
Da durch die Autoprotolyse des Wassers immer OH−-Ionen und H3O+-Ionen vorhanden sind stellen sich mehrere Gleichgewichte ein:
Verwendung
Es findet häufige Verwendung in der Metalloberflächenbehandlung (Korrosionsinhibitor), zur Holz-Imprägnierung und unter anderem zur Herstellung von Korrosionsschutzpigmenten verwendet[6], wobei ein Gleichgewicht aus Natriumdichromat und Natriumchromat gebildet wird. Weiterhin wird es in der chemischen Industrie als Oxidationsmittel für organische Syntheseprozesse verwendet, beispielsweise zur Synthese von Anthrachinon.[7]
Sicherheitshinweise und gesetzliche Regelungen
Natriumdichromat ist sehr giftig, brandfördernd und umweltgefährlich.[1] Es wurde im Oktober 2008 aufgrund seiner Einstufung als krebserzeugend (Carc. 1B), mutagen (Muta. 1B) und reproduktionstoxisch (Reprod. 1B) in die Kandidatenliste der besonders besorgniserregenden Stoffe (Substance of very high concern, SVHC) aufgenommen.[3]Im April 2013 wurde Natriumdichromat danach in das Verzeichnis der zulassungspflichtigen Stoffe mit dem Ablauftermin für die Verwendung in der EU zum 21. September 2017 aufgenommen.[4][8] Als Chrom(VI)-Verbindung unterliegt Natriumdichromat außerdem den Beschränkungen im Anhang XVII, Nummer 47 und 72 der REACH-Verordnung (in Deutschland umgesetzt durch die Chemikalien-Verbotsverordnung).[9]
Einzelnachweise
- Eintrag zu Natriumdichromat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Eintrag zu Sodium dichromate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 14. Juli 2014.
- Eintrag im Verzeichnis der zulassungspflichtigen Stoffe der Europäischen Chemikalienagentur, abgerufen am 14. Juli 2014.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach Chrom(VI)-Verbindungen), abgerufen am 7. Oktober 2019.
- Patent DE 2707486C2
- Skript Uni Mainz
- Verordnung (EU) Nr. 348/2013
- ECHA: Liste der beschränkten Stoffe – Anhang XVII der REACH-Verordnung, abgerufen am 5. September 2020.




