Nitroprussid
Nitroprussid (auch Natrium-Nitroprussid oder Nitroprussid-Natrium) ist eine anorganische Verbindung aus der Wirkstoffklasse der Cyanide. Nitroprussid wurde 1849 erstmals als chemische Verbindung beschrieben[4]. Im Rahmen von Tierversuchen wurde 1886 dessen Toxizität im Sinne der Blausäurevergiftung[5] und 1928 die gefäßerweiternde und blutdrucksenkende Wirkung[6] beobachtet.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Nitroprussid | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
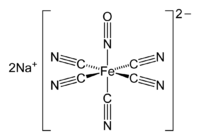
| Summenformel | Na2[Fe(CN)5NO]·2 H2O | |||||||||||||||||||||
| Kurzbeschreibung |
rubinrote rhombische Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
C02DD01 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 297,95 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,72 g·cm−3[2] | |||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Nitroprussid wird heute in der Intensivmedizin zur Behandlung von Patienten mit krisenhaftem Bluthochdruck[7] sowie zur kontrollierten Blutdrucksenkung im Rahmen bestimmter Operationen[8] verwendet.
Chemische Eigenschaften

Natrium-Nitroprussid kommt in Form rubinroter Kristalle vor. Die Formel lautet Na2[Fe(CN)5NO] · 2 H2O. Das Eisen ist darin in der Oxidationsstufe Fe2+ enthalten, das NO als NO+ Ligand.[9]
Die molare Masse entfällt anteilig zu rund 15 % auf Natrium, 19 % auf Eisen, 44 % auf Zyanid, 10 % auf Nitrosyl und 12 % auf Wasser. Bei Zimmertemperatur bildet es rosarote, geruchlose Kristalle. Bei Temperaturen zwischen 100 °C und 115 °C werden beide Kristallwassermoleküle abgespalten, bei darüber liegenden Temperaturen zerfällt das komplexe Molekül[10]. Die maximale Löslichkeit in Wasser beträgt bei 16 °C 400 g/L. Die gelösten Nitroprussid-Ionen werden durch Lichteinstrahlung unterschiedlicher Wellenlängen photochemisch angeregt. Dabei entstehen instabile Radikale, die in nachfolgender Reaktion die NO-Gruppe abspalten, welche bei Anwesenheit von Sauerstoff zu Nitrit und Nitrat oxidiert wird. Der Zerfall geht mit Farbänderungen der Lösung von Orange über Gelb und Grün in Blau einher. Der blaue Farbton entspricht dem Berliner Blau des Hexacyanoferrates[11].
Verwendung in der chemischen Analytik
In der chemischen Analytik wird Nitroprussid-Natrium zum Nachweis von Sulfidionen verwendet. In nicht allzu alkalischer Lösung (Natriumcarbonatlösung) tritt bei Zugabe von frisch zubereiteter 1%iger Lösung eine Violettfärbung auf, die beim Ansäuern wieder verschwindet.[12]
Die dabei ablaufende Reaktion im alkalischen Milieu beinhaltet dabei verschiedene Zwischenzustände und lautet wie folgt: [13]
Mit Sulfitionen bildet sich in Anwesenheit von Zinkionen ein roter Niederschlag von Zn2[Fe(CN)5SO3].[14]
Verwendung in der Medizin
Pharmakologische Wirkungen
Nitroprussid relaxiert bei intravenöser Infusion die glatte Muskulatur kleiner Blutgefäße, insbesondere diejenige in den Endaufzweigungen der Arterien (Arteriolen). Die resultierende Gefäßerweiterung kommt durch direkte Wirkung auf die Muskelzellen zustande, unabhängig vom zentralen und peripheren Nervensystem und ohne Einflussnahme auf α- oder β-adrenerge Rezeptoren[15].
Die Wirkung von Nitroprussid auf die Mikrozirkulation im Bereich von Arteriolen, Kapillaren und Venolen wurde experimentell mit verschiedenen Untersuchungstechniken an Tiermodellen untersucht. Dabei wurde mehrheitlich bestätigt, dass der entscheidende Wirkort die Arteriolen sind, während die Mehrdurchblutung der Kapillaren und Venolen eher passiv der Erweiterung der Arteriolen folgt. Die Wirkung auf Teilbereiche des Blutkreislaufs ist aber durchaus unterschiedlich. In Tierversuchen fiel eine Umverteilung des Blutstroms hin zu den inneren Organen auf, so dass insbesondere Hirn und Herz eine absolute und relative Mehrdurchblutung erfuhren, währen bei Skelettmuskulatur und Haut eine relative Minderdurchblutung resultierte[16].
Nitroprussid hat keine Eigenwirkung auf die Kontraktilität des Herzens. Es senkt den peripheren Gefäßwiderstand und mit dem arteriellen Blutdruck auch die sogenannte Nachlast des Herzens. Reflektorisch tritt eine Steigerung der Herzfrequenz auf, die im Mittel bei Patienten im Erwachsenenalter etwa 10–30 %, bei Kindern zum Teil auch mehr als 30 % der Anfangswerte ausmacht. Das Herzminutenvolumen wird beim gesunden Herzen wenig beeinflusst, beim insuffizienten Herzen in Abhängigkeit von der Ausgangslage zum Teil wesentlich vermehrt. Die Herzarbeit und der Sauerstoffverbrauch des Herzens werden verringert[16].
Wässrige Lösungen von Natriumnitroprussid waren bei Lichtausschluss tagelang ohne Verlust an blutdrucksenkender Wirkung lagerbar[11]. Demgegenüber betrug die biologische Halbwertzeit von 14-C-Nitroprussid nach intravenöser Injektion bei Ratten nur wenige Minuten. Die biologische Halbwertzeit des Komplexmoleküls entsprach damit in etwa der Dauer der blutdrucksenkenden Wirkung, wie sie nach intravenöser Infusion im Tierversuch, aber auch bei therapeutischer Anwendung an Patienten beobachtetet wird[17].
In Vitro ließ sich der Abbau der Komplexmoleküle z. B. durch Zusatz von Erythrozyten-Hämolysaten sowie von Glutathion oder Ascorbinsäure in Verbindung mit Mitochondrien-Extrakten stark beschleunigen. Deshalb wird angenommen, dass der rasche Zerfall in vivo durch Reduktionsvorgänge eingeleitet wird. Als Elektronendonatoren könnten neben Hämoglobin auch biologische Moleküle mit freien SH-Gruppen der Gefäßwände dienen[18].
Die komplexe Struktur des Moleküls hat zu der Vermutung veranlasst, dass die Effekte nur von Teilen des Moleküls, nämlich der NO-Gruppe oder der Fe-NO-Gruppierung ausgehen könnten. Beim Vergleich der relaxierenden Wirkungen strukturanaloger Verbindungen im Tierversuch zeigte sich jedoch, dass die Substitution von NO durch NO2 oder von Fe durch Ru nur zu relativ geringen Wirkverlusten führte, weshalb eher ausgegangen wird, dass für die Vasodilatation das Nitroprussid-Molekül als Ganzes verantwortlich ist[10]. Dessen rascher Zerfall im Blutkreislauf würde die extrem kurze Wirkdauer und die darauf beruhende exzellente Steuerbarkeit der Blutdrucksenkung bei intravenöser Infusion an Patienten erklären.
Therapeutische Anwendung am Menschen
Nitroprussid wird als Arzneimittel zur intravenösen Infusion im Rahmen der Behandlung von Patienten mit hypertonen Blutdruckkrisen[19] sowie zur kontrollierten Blutdrucksenkung im Rahmen bestimmter Operationen, vor allem in der Kardio-, Neuro- und HNO-Chirurgie[8], angewendet. In beiden Indikationbereichen wurde es 1974 von der FDA/USA und 1975 von der deutschen Behörde zugelassen. In den erstgenannten Anwendungsbereich fallen auch Behandlungen von Patienten mit Aortendissektionen, Aortenstenosen oder akuter Aorteninsuffizienz, sofern gleichzeitig ein Bluthochdruck besteht[7]. Das gleiche gilt für Patienten mit drohender oder manifester Linksherzinsuffizienz mit Lungenödem sowie im Falle von Enzephalopathie bei Hirnödem[20]. Erfolgreiche Anwendungen von Nitroprussid gab es auch im Rahmen von Blutdruckentgleisungen bei Patienten mit Phäochromozytomen, sofern die spezifische Behandlung mit α-Rezeptoren-Blockern nicht ausreichte[21]. Vereinzelt berichtet wurde auch über die Lösung schwerer lokaler Vasospasmen durch gezielte intraarterielle Infusionen von Nitroprussid[22]
Risiken und toxische Wirkungen
Nitroprussid besteht zu 44 % aus hochtoxischem Cyanid, das nach intravenöser Infusion im Körper rasch freigesetzt wird. Es darf daher grundsätzlich nur simultan mit Natriumthiosulfat infundiert werden. Bei nicht sachgemäßer Dosierung von Natriumthiosulfat drohen Cyanidvergiftungen. Die spezifischen Risiken von Nitroprussid sind abhängig von der Höhe des Dosisstroms und von der Dauer der Behandlung[23]. Im Rahmen kontrollierter Hypotensionen, die intraoperativ mit dem Ziel erfolgen, den Chirurgen blutungsarme Operationsfelder zu sichern, ist der Dosisstrom in der Regel niedrig und die Dauer Anwendung auf wenige Stunden begrenzt[24]. Bei sachgerechter Anwendung zusammen mit Thiosulfat und adäquater Blutdruckkontrolle sind bei dieser Indikation pharmakodynamisch oder toxikologisch bedingte Risiken kaum zu erwarten[25].
Demgegenüber kann die Behandlung intensivmedizinische Notfälle mit krisenhaftem Bluthochdruck nicht nur wesentlich höhere Dosierungen erfordern, sondern sich auch über Tage oder sogar Wochen hinziehen. In solchen Fällen kann zum einen die vom Organismus ausgehende endokrine Gegenregulation zur sogenannten Tachyphylaxie führen. Letztere bedeutet, dass der Dosisstrom, der zur Aufrechterhaltung eines adäquaten Blutdruckes erforderliche ist, immer weiter gesteigert werden muss[23]. Das fördert im Körper die Kumulation von Thiocyanat, dem Entgiftungsprodukt des aus dem Nitroprussid freiwerdenden Cyanides. Letzteres wird bei simultaner Infusion von Thiosulfat in adäquater Dosierung zwar rasch unschädlich gemacht. Das dabei entstehende Thiocyanat hat jedoch Eliminationshalbwertzeiten, die bei Nierengesunden etwa 3 Tage betragen und bei niereninsuffizienten Patienten noch länger sind. Vor allem bei Dosisströmen von mehr als 5 µg/kg/min Natriumnitroprussid können sich daher im Laufe weniger Tage toxische Thiocyanat-Spiegel im Körper aufbauen. Das daraus erwachsende Vergiftungsrisiko ist aus geeigneten Kurvenscharen vorausberechnend abschätzbar[26]. Bei Verdacht auf Überschreitung definierter Blutspiegel ist das Thiocyanat gegebenenfalls durch Hämodialyse aus dem Körper zu entfernen[27][28].
Galenische Zubereitung und Infusion am Menschen
Natriumnitroprussid ist ein extrem stark wirkendes und zugleich hochtoxisches Arzneimittel. Bei Bluthochdruck-Notfällen kann es lebensrettend sein und findet sich deshalb auch in der WHO-Liste der unverzichtbaren Arzneimittel[29]. Die erfolgreiche Anwendung hängt aber in besonderem Maße von der sachgerechten und zweckmäßigen galenischen Zubereitung und von der Infusionstechnik ab. Dabei ist einerseits dem Vergiftungsrisiko durch Cyanid, andererseits aber auch der schnellen und einfachen Anwendbarkeit im Falle eiliger intensivmedizinischer Notfallversorgungen Rechnung zu tragen.
Die Entgiftung des freiwerdenden Cyanides erfolgt mittels des mitochondrialen Enzyms Rhodanase (thiosulphate:cyanid sulfor transferase, EC 2.8.1.1) in das etwa 100 × weniger toxische Thiocyanat[30][31]. Das Enzym ist im großen Überschuss in den Körperzellen vorhandenen. Es wurde bei 15 untersuchten Tierarten in nahezu allen Körperzellen nachgewiesen[32]. Demgegenüber ist das Substrat Thiosulfat nur in geringen physiologischen Mengen verfügbar, was zu einer Eliminationskinetik 0. Ordnung führt[33]. Die Halbwertzeit von Thiosulfat im Blut beträgt aber auch nur etwa 15 Minuten[26]. Das bedeutet, dass das Thiosulfat als Dauerinfusion zusammen mit dem Natriumnitroprussid infundiert und dabei kontinuierlich dessen Dosisstrom angepasst werden muss. Mit separaten Infusionssystemen über getrennte venöse Zugänge wird diese Bedingung unzureichend erfüllt. Zweckmäßig wäre ein in Trockenampullen bereitgehaltenes Misch-Lyophilisat von Natriumnitroprussid und Natriumthiosulfat im Molverhältnis von etwa 1:3[30], das zur Anwendung in Wasser gelöst und mittels Perfusor infundiert werden kann. Der Eutektische Punkt der Mischlösung liegt jedoch bei −60 °C, was die Lyophilisation aus technischen Gründen unmöglich macht. Darüber hinaus ist Nitroprussid in wässriger Mischlösung zusammen mit Thiosulfat hochgradig lichtempfindlich, so dass ein absoluter Lichtausschluss entlang der Infusionskette bis zum Einstrom in den Körper erforderlich wird.
Ein Perfusor-Kit, der alle diese Probleme löst, wurde im Zeitraum von 1980 bis 1985 in den Universitätskliniken Köln entwickelt. Die Wirksamkeit und Sicherheit wurde bei 30 Patienten, die wegen schwerer und tagelang andauernder Hochdruckkrisen behandelt werden mussten, sowie bei 50 chirurgischen Patienten im Rahmen kontrollierter Hypotensionen, geprüft[23] [34]. Bei allen Patienten wurden stabile Blutdrucksenkungen von etwa 30–40 % der Anfangswerte erzielt. Zum retrospektiven Vergleich wurden aus der Fachliteratur insgesamt 181 frühere Behandlungs-Kasuistiken herangezogen, die mit Nitroprussid-Monoinfusionen ohne Thiosulfat-Zusatz behandelt worden waren. Die notwendigen Dosisströme zur Erzielung äquivalenter Blutdrucksenkungen waren bei der Nitroprussid-Monoinfusion tendenziell sogar etwas höher, als bei der Nitroprussid-Thiosulfat-Mischinfusion. Der entscheidende Wert der Mischinfusion lag jedoch darin, dass die Cyanid-Spiegel im Blut der Patienten im gesamten Behandlungszeitraum weit unter toxikologisch relevanten Werten blieben[34].
Dieser Perfusor-Kit wurde 1985 in den USA[35] und in Canada[36] und 1986 auch für Europa[37] als Patent anerkannt. Er besteht aus: 1 Trockenampulle mit 50 mg lyophilisiertem Natriumnitroprussid, 1 Flasche mit 50 ml 1%iger Natriumthiosulfatlösung, 1 50-ml-Perfusorspritze sowie 1 Perfusorschlauch – beide aus lichtundurchlässigem Kunststoff. Nach Aufziehen der Thiosulfatlösung in die Spritze wird mit einem kleinen Volumen das Nitroprussid-Lyophilisat gelöst und in die Spritze eingezogen. Nach Durchmischung und Auffüllung des Schlauchs wird letzterer körpernah an den Zentralvenenkatheter angeschlossen. Die gesamte Vorbereitung dauert nur wenige Minuten. Die Infusion wirkt sicher und bedarf in den ersten Behandlungstagen außer der Blutdruckkontrolle keiner weiteren Schutz- und Kontrollmaßnahmen.
Leider war die pharmazeutische Industrie bisher nicht in der Lage, ein entsprechendes Produkt anzubieten. In Deutschland ist auch im Jahre 2021 nur ein toxisches Nitroprussid-Monopräparat im Handel, dessen Fachinformation[38] mit verwirrenden Warnungen und Umrechnungstabellen in eiligen Notfällen wohl eher davon abschreckt, dieses lebensrettende Arzneimittel einzusetzen.
Fertigarzneimittel
Nipruss (D), Nitropress (USA), Nipride
Siehe auch
Literatur
- Khot UN et al.: Nitroprusside in critically ill patients with left ventricular dysfunction and aortic stenosis. New England Journal of Medicine (2003) 348:1756–1763. PMID 12724481.
- Reinhard Larsen: Anästhesie und Intensivmedizin in Herz-, Thorax- und Gefäßchirurgie. (1. Auflage 1986) 5. Auflage. Springer, Berlin/Heidelberg/New York u. a. 1999, ISBN 3-540-65024-5, S. 65–68 und 76 f.
Einzelnachweise
- Eintrag zu Nitroprussidnatrium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. Mai 2014.
- Datenblatt Nitroprussid bei AlfaAesar, abgerufen am 14. März 2010 (PDF) (JavaScript erforderlich).
- Datenblatt Sodium nitroferricyanide(III) dihydrate bei Sigma-Aldrich, abgerufen am 13. Mai 2017 (PDF).
- Lyon Playfair: XXIV. On the nitroprussides, a new class of salts. In: Philosophical Transactions of the Royal Society of London. Band 139. London 1. Januar 1849, S. 477–518, doi:10.1098/rstl.1849.0024 (royalsocietypublishing.org [abgerufen am 13. Oktober 2021]).
- L. Hermann: Ueber die Wirkung des Nitroprussidnatriums. In: Pflüger, Archiv für die Gesamte Physiologie des Menschen und der Thiere. Band 39, Nr. 1, Dezember 1886, ISSN 0031-6768, S. 419–419, doi:10.1007/BF01612172.
- C. C. Johnson: Mechanism of Actions and Toxicity of Nitroprusside. In: Experimental Biology and Medicine. Band 26, Nr. 2, 1. November 1928, ISSN 1535-3702, S. 102–103, doi:10.3181/00379727-26-4160.
- Bryan Williams, Giuseppe Mancia, Wilko Spiering, Enrico Agabiti Rosei, Michel Azizi: 2018 ESC/ESH Guidelines for the management of arterial hypertension. In: European Heart Journal. Band 39, Nr. 33, 1. September 2018, ISSN 0195-668X, S. 3021–3104, doi:10.1093/eurheartj/ehy339 (oup.com [abgerufen am 13. Oktober 2021]).
- JOHN H. TINKER, ROY F. CUCCHIARA: Use of Sodium Nitroprusside During Anesthesia aud Surgery. In: International Anesthesiology Clinics. Band 16, Nr. 2, 1978, ISSN 0020-5907, S. 89–112, doi:10.1097/00004311-197816020-00006.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 1144.
- Kreye, VAW: Sodium nitroprusside. In: A. Scriabine (Hrsg.): Pharmacology of Antihypertensive Drugs. Raven Press, New York 1980, S. 373–396.
- A. C. Van Loenen, W. Hofs-Kemper: Stability and degradation of sodium nitroprusside. In: Pharmaceutisch weekblad. Band 1, Nr. 1, Dezember 1979, ISSN 0031-6911, S. 424–436, doi:10.1007/bf02293246.
- Jander-Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie, S.Hirzel Verlag Stuttgart, 5. Auflage 1965, S. 130.
- Sandra L. Quiroga, Alejandra E. Almaraz, Valentín T. Amorebieta, Laura L. Perissinotti, José A. Olabe: Addition and Redox Reactivity of Hydrogen Sulfides (H2S/HS−) with Nitroprusside: New Chemistry of Nitrososulfide Ligands. In: Chemistry – A European Journal. Band 17, Nr. 15, 4. April 2011, S. 4145–4156, doi:10.1002/chem.201002322.
- Hans Peter Latscha, Gerald W. Linti, Helmut Alfons Klein: Analytische Chemie, Springer, Berlin, 4. Aufl., 2004, S. 52 (eingeschränkte Vorschau in der Google-Buchsuche).
- V. A. W. Kreye, S. N. Reske: Natrium-Nitroprussid: Hinweise für eine rasche In-vivo-Inaktivierung in peripheren Gefäßbetten. In: Nitrate III. Springer Berlin Heidelberg, Berlin, Heidelberg 1982, S. 624–629, doi:10.1007/978-3-662-08981-1_83.
- DAVID J. MILETICH, ANTHONY D. IVANKOVICH: Sodium Nitroprusside and Cardiovascular Hemodynamics. In: International Anesthesiology Clinics. Band 16, Nr. 2, 1978, ISSN 0020-5907, S. 31–50, doi:10.1097/00004311-197816020-00004.
- M. Höbel, V. A. W. Kreye, A. Raitelhuber: Sodium Nitroprusside: Its toxicity, metabolism, and organic distribution. In: Herz. Band 1, 1976, S. 130–136.
- ANTHONY D. IVANKOVICH, DAVID J. MILETICH, JOHN H. TINKER: Sodium Nitroprusside. In: International Anesthesiology Clinics. Band 16, Nr. 2, 1978, ISSN 0020-5907, S. 1–30, doi:10.1097/00004311-197816020-00003.
- Roger F. Palmer, Kenneth C. Lasseter: Sodium Nitroprusside. In: New England Journal of Medicine. Band 292, Nr. 6, 6. Februar 1975, ISSN 0028-4793, S. 294–297, doi:10.1056/nejm197502062920606.
- The Treatment of Malignant Hypertension and Hypertensive Emergencies. In: JAMA. Band 228, Nr. 13, 24. Juni 1974, ISSN 0098-7484, S. 1673, doi:10.1001/jama.1974.03230380041026.
- David S. Nourok, Grant Gwinup, George J. Hamwi: Phentolamine-Resistant Pheochromocytoma Treated with Sodium Nitroprusside. In: JAMA. Band 183, Nr. 10, 9. März 1963, ISSN 0098-7484, doi:10.1001/jama.1963.03700100067011.
- JW Husted, EJ Ring, LF Hirsh: Intraarterial nitroprusside treatment for ergotism. In: American Journal of Roentgenology. Band 131, Nr. 6, Dezember 1978, ISSN 0361-803X, S. 1090–1092, doi:10.2214/ajr.131.6.1090.
- V. Schulz, R. Gross, T. Pasch, J. Busse, G. Loeschcke: Cyanide toxicity of sodium nitroprusside in therapeutic use with and without sodium thiosulphate. In: Klinische Wochenschrift. Band 60, Nr. 22, November 1982, ISSN 0023-2173, S. 1393–1400, doi:10.1007/bf01716244.
- NOEL W. LAWSON, DOLA S. THOMPSON, CARL L. NELSON, JOAN W. FLACKE, ASTRIDE B. SEIFEN: A Dosage Nomogram for Sodium Nitroprusside-Induced Hypotension Under Anesthesia. In: Anesthesia & Analgesia. Band 55, Nr. 4, Juli 1976, ISSN 0003-2999, S. 574–580, doi:10.1213/00000539-197607000-00026.
- T. Pasch, V. Schulz, G. Hoppelshäuser: Nitroprusside-Induced Formation of Cyanide and Its Detoxication with Thiosulfate During Deliberate Hypotension. In: Journal of Cardiovascular Pharmacology. Band 5, Nr. 1, Januar 1983, S. 77–85, doi:10.1097/00005344-198301000-00012.
- V. Schulz: Clinical Pharmacokinetics of Nitroprusside, Cyanide, Thiosulphate and Thiocyanate. In: Clinical Pharmacokinetics. Band 9, Nr. 3, 1984, S. 239–251, doi:10.2165/00003088-198409030-00005.
- James Christensen: Thiocyanate Psychosis Treated by Extracorporeal Hemodialysis. In: JAMA. Band 181, Nr. 4, 28. Juli 1962, ISSN 0098-7484, S. 340, doi:10.1001/jama.1962.03050300060020b.
- V. Schulz, W. Döhring, P. Rathsack: Thiozyanat-Vergiftung bei der antihypertensiven Therapie mit Natriumnitroprussid. In: Klinische Wochenschrift. Band 56, Nr. 7, April 1978, ISSN 0023-2173, S. 355–361, doi:10.1007/bf01477396.
- World Health Organization: World Health Organization model list of essential medicines: 21st list 2019. WHO/MVP/EMP/IAU/2019.06. World Health Organization, 2019 (who.int [abgerufen am 5. November 2021]).
- Williamina A. Himwich, Jack P. Saunders: ENZYMATIC CONVERSION OF CYANIDE TO THIOCYANATE. In: American Journal of Physiology-Legacy Content. Band 153, Nr. 2, 1. Mai 1948, ISSN 0002-9513, S. 348–354, doi:10.1152/ajplegacy.1948.153.2.348.
- Richard Mintel, John Westley: The rhodanase reaction, mechanism of sulfur-sulfur bond cleavage. In: Journal of Biological Chemistry. Band 241, 1978, S. 3381–3385.
- F. Lynen, L. Jaenicke: Handbuch der physiologisch- und pathologisch-chemischen Analyse, für Ärzte, Biologen und Chemiker, von Hoppe-Seyler/Thierfelder. Springer-Verlag, Berlin-Göttingen-Heidelberg 1953–1960. 10. Aufl., herausgeg. von K. Lang und E. Lehnartz. In: Angewandte Chemie. Band 74, Nr. 8, 21. April 1962, S. 299–300, doi:10.1002/ange.19620740827.
- Jack P. Saunders, Williamina A. Himwich: PROPERTIES OF THE TRANSSULFURASE RESPONSIBLE FOR CONVERSION OF CYANIDE TO THIOCYANATE. In: American Journal of Physiology-Legacy Content. Band 163, Nr. 2, 31. Oktober 1950, S. 404–409, doi:10.1152/ajplegacy.1950.163.2.404.
- Volker Schulz, Georg Loeschcke: Hypotensive Efficacy of a Mixed Solution of 0.1% Sodium Nitroprusside and 1 % Sodium Thiosulphate. In: Journal of Hypertension. Band 3, Nr. 5, Oktober 1985, S. 485–490, doi:10.1097/00004872-198510000-00010.
- United States Patent Number 4,501,582. Feb. 26,1985
- Canadian Patent No. 1182398, Feb. 12 1985
- Europäisches Patentamt: Europäisches Patent Nr. 0054690, 29.01.1986
- Nipruss Fachinformation, Stand November 2020, Altamedics GmbH, D-50933 Köln
