Cyclooxygenasen
Cyclooxygenasen (COX) sind die wesentlichen Enzyme am Anfang einer Prostaglandinsynthese aus der Arachidonsäure, Dihomogammalinolensäure (DGLA) oder Eicosapentaensäure (EPA). Da dieser erste Schritt geschwindigkeitsbestimmend ist, haben die COX eine zentrale Funktion in der Regulation des Entzündungsgeschehens; sie werden durch Nichtsteroidale Antiphlogistika gehemmt.
| Cyclooxygenasen | ||
|---|---|---|
 | ||
| Cyclooxygenase-2 dimer, PDB 1CVU | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.14.99.1, Dioxygenase | |
| Substrat | Arachidonsäure + AH2 + 2 O2 | |
| Produkte | Prostaglandin-H2 + A + H2O | |
Cyclooxygenasen sind im Inneren des Endoplasmatischen Retikulums, innerhalb der Kernhülle und im Golgiapparat lokalisiert und haften den Innenseiten der Membranen dieser Zellkompartimente an. Sie kommen in Zellen von Tieren seit der frühen Entwicklung der wirbellosen Tiere vor, z. B. schon in Zellen der Koralle, nicht jedoch in einzelligen Organismen, Pflanzen oder Insekten. Hier kommen jedoch verwandte Enzyme aus der übergeordneten Familie der Pathogen-induzierbaren Oxygenasen (PIOXs) vor.
Es gibt bereits sehr früh in der Evolution der Cyclooxygenasen zwei Isoenzyme, die Cyclooxygenase-1 und die Cyclooxygenase-2, die sich durch ihren Genlocus unterscheiden, eine leicht unterschiedliche Struktur haben, in verschiedenen Zelltypen vorkommen, unterschiedlich reguliert werden, eine unterschiedliche Substratspezifität zeigen und pharmakologisch unterschiedlich beeinflussbar sind.
Geschichte der Erforschung
Prostaglandine zählen zu den Eicosanoiden und sind seit den 1930er Jahren bekannt. In den 1970er Jahren wurden erstmals Cyclooxidasen aus Gewebehomogenaten der Samenblasen von Rindern und Schafen gereinigt hergestellt und als die Enzyme der Prostaglandinsynthese mit Cyclooxygenase- und Peroxidaseaktivität erkannt. 1971 konnte demonstriert werden, dass damals schon gebräuchliche Nichtsteroidale Antiphlogistika die Cyclooxygenaseaktivität hemmen. Ab 1972 wurde aufgrund unterschiedlicher Kinetiken der Enzymreaktionen spekuliert, dass es mehr als eine Cyclooxygenase geben müsse.
Die Proteinstrukturen der Cyclooxygenase-1 und der Cyclooxygenase-2 wurden in den 1990er Jahren sequenziert und in ihrer Tertiär- und Quartärstruktur aufgeklärt und führten zur Entwicklung weiterer diese Enzyme beeinflussenden Medikamente.
Die ersten Cyclooxygenase-2 selektiven Inhibitoren waren 1999 auf dem Markt.
Ferner fand in den frühen 1990er Jahren ein Paradigmenwechsel in der Prostaglandinforschung statt, als erkannt wurde, dass die Regulation der Cyclooxygenasen den wesentlichen Kontrollpunkt in der Prostaglandinsynthese darstellt (vorher hatte man gedacht, dass dies die Phospholipasen seien, welche u. A. Arachidonsäure bilden).[1]
Struktur
Cyclooxygenasen sind globuläre Proteine mit ca. 600 Aminosäuren. Sie haben eine Molare Masse von 67 bis 72 kDa, sind zu 65 % gleich in ihrer Aminosäurensequenz und haben nahezu identische aktive Zentren. Sie fügen sich je zu zwei Dimeren zusammen. Mit einer hydrophoben Region schwimmen sie auf/in den Innenseiten der mikrosomalen Membranen z. B. des Endoplasmatischen Retikulums. Diese membranbindende Region bildet eine ebenfalls hydrophobe, enge Öffnung in einen blind endenden Kanal zu dem aktiven Zentrum mit der Cyclooxygenaseaktivität. Dieser Kanal ist in der Cyclooxygenase-1 enger als in der Cyclooxygenase-2 (durch einen Austausch an Position 523 von Isoleucin in Valin).
Im inneren Teil des Kanals befindet sich (an Position 385) ein Tyrosin, welches zu einem Tyrosyl-Radikal aktiviert wird, bevor die Cyclooxygenasen ihre eigentliche Reaktion ausführen können. Dies geschieht mit Hilfe der Peroxidaseaktivität der Cyclooxygenasen, welche in einem anderen aktiven Zentrum (an der der Membran des Endoplasmatischen Retikulums gegenüberliegenden Seite des Enzyms) liegt. Hier wird zunächst mit Hilfe von im Endoplasmatischen Retikulum vorkommenden Oxidantien an Häm gebundenes Fe3+ zu einem Ferryl-Oxo-Porphyrin-Radikal (Fe4+=O•) oxidiert, welches dann ein Elektron vom Tyrosin-OH im Zentrum der Cyclooxygenaseaktivität abzieht und so das aktive Radikal Tyrosyl-O• bildet. (Genaueres siehe Seite 400 und 401 von [1]).
Funktion
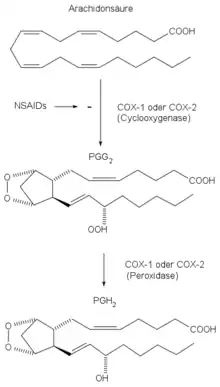
Die Cyclooxygenasen katalysieren die Umwandlung von Arachidonsäure zu Prostaglandin-H2, bzw. auch der DGLA und EPA zu den entsprechenden Vorläufern der PG1 und PG3. Dies geschieht in zwei Schritten in zwei unterschiedlichen Reaktionszentren des Enzyms:
- Der erste Reaktionsschritt findet im oben beschriebenen katalytischen Zentrum mit der Cyclooxygenaseaktivität statt. Dabei wird ein Ringschluss zwischen den Kohlenstoffatomen C8 und C12 erreicht sowie zwei Sauerstoffatome an C9 und C11 eingefügt, die anschließend eine kovalente Bindung miteinander eingehen, so dass eine Peroxidbrücke im Prostaglandin-G2 entsteht (genaueres siehe in [1]). Das entstandene Prostaglandin-G2 diffundiert aus dem Kanal heraus.
- Der zweite Reaktionsschritt wird durch das Reaktionszentrum mit Peroxidaseaktivität katalysiert: hier wird das Prostaglandin-H2 aus dem Prostaglandin-G2 gebildet.
Aus dem entstandenen Prostaglandin-H2 werden dann teilweise durch spontane Isomerisation, teils mit Hilfe verschiedener Synthasen oder Oxidasen die unterschiedlichen anderen Prostaglandine synthetisiert.
Die Cyclooxygenasen sind aber bei der Prostaglandinbildung der geschwindigkeitsbestimmende Schritt, sie haben so eine zentrale Stellung in der Regulation des Entzündungsgeschehens. Sie haben eine Halbwertzeit von 1–2 Minuten, wenn sie Arachidonsäure in einer Konzentration ausgesetzt sind, die zu maximaler Auslastung des Enzyms führen.
Unterformen (Isoenzyme)
Es gibt zwei Unterformen der Cyclooxygenasen. Sie haben sich früh in der Evolution der wirbellosen Tiere durch Genduplikation voneinander getrennt und gehen seither ihre eigenen evolutionären Wege. Sie haben 65 % der Aminosäuresequenzen gemeinsam, katalysieren dieselbe enzymatische Reaktion, finden sich aber im Organismus unterschiedlich verteilt und reguliert. Ein wichtiger Unterschied zwischen der Cyclooxygenase-1 und der Cyclooxygenase-2 ist der Austausch an Position 523 von Isoleucin gegen Valin, welches das aktive Zentrum der Cyclooxygenase-2 etwas größer macht und dort auch etwas sperrigere Substrate außer Arachidonsäure oxidieren kann. Dies ist zum Beispiel für Endocannabinoide wie zum Beispiel Anandamid möglich (siehe Seite 399 von [1]). Ein weiterer Unterschied ist die vielfache Regulation der Transkription der Cyclooxygenase-2, die vor allem durch Entzündungsprozesse und andere Bedingungen der Zellaktivierung induziert wird.
Von der Cyclooxygenase-1 ist 2002 eine Splicing-Variante als COX-3 beschrieben worden.[2] Dabei wird vom selben Gen, dem PTSG1, ein Intron weniger exprimiert. Dies führt beim Hund durch Auslassung von 93 Basenpaaren genau zu einer enzymatisch aktiven Cyclooxygenase mit 31 Aminosäuren weniger. Aber durch eine Frameshift-Mutation ist das nicht exprimierte Intron bei Mäusen und Menschen 94 Basenpaare lang und daraus ergibt sich eine gänzlich andere Proteinstruktur, die keine Cyclooxygenase-Aktivität aufweist. Über diese beiden Formen hinaus sind weitere neun Splicing-Varianten beschrieben.[3]
COX-Inhibitoren
- Weil bei einer Hemmung der Cyclooxygenase mehr Arachidonsäure für den Lipoxygenaseweg zur Verfügung steht, was die Bildung von Leukotrienen zur Folge hat, die entzündungsverstärkend und anaphylaxieverstärkend sind, können Hemmstoffe der Cyclooxygenase einen Asthmaanfall auslösen.
- Acetylsalicylsäure (Aspirin) führt zu einer Transacetylierung am Serin in Position 530 im katalytischen Zentrum der Cyclooxygenase, die das Enzym funktionsunfähig macht, bis es wieder neu gebildet wird. Die Cyclooxygenase-1 ist hierfür 10–100 mal sensitiver als die Cyclooxygenase-2.[1]
- Kompetitiv wirkende NSAIDs konkurrieren im Cyclooxygenasezentrum um die Bindungsstelle für die Arachidonsäure. Ibuprofen bindet hierbei sehr schnell und wird auch schnell wieder ausgewaschen. Diclofenac oder Indometacin haben ein trägeres Bindungsverhalten.
- Selektive COX-2-Hemmer hemmen vor allem die Aktivität der Cyclooxygenase-2 (Näheres siehe dort).
- Analgetische/antipyretische Substanzen wie Paracetamol oder Metamizol sind wichtige Medikamente bei Schmerz und Fieber ohne antiinflammatorische Eigenschaften. Der Mechanismus und die Bedingungen ihrer eher schwachen Hemmung der Cyclooxygenasen sind noch unerforscht.[1]
Behandlung entzündlicher Erkrankungen
NSAIDs werden zurzeit als Medikamente der ersten Wahl zur Behandlung der Osteoarthritis, des Rheuma, des systemischen Lupus erythematodes (SLE) und anderer entzündlicher Erkrankungen genutzt. Die Behandlung ist meistens palliativ und ändert nicht den Krankheitsverlauf. NSAIDs hemmen die Entzündung und reduzieren den Schmerz.
Einzelnachweise
- Simmons, D.L. et al. (2004): Cyclooxygenase isozymes: the biology of prostaglandin synthesis and inhibition. In: Pharmacol. Rev. Bd. 56, S. 387–437. PMID 15317910
- Regina Botting: COX-1 and COX-3 inhibitors. Thrombosis Research 2003, Band 110, Doppelausgabe 5–6 vom 15. Juni 2003, Seiten 269.272; doi:10.1016/S0049-3848(03)00411-0; PMID 14592546
- ENSEMBL-Eintrag