Cyclooxygenase-2
Die Cyclooxygenase-2 (COX-2), auch Prostaglandinsynthase-2 (PGHS-2), ist ein Enzym, das wie die Cyclooxygenase-1 (COX-1) Arachidonsäure zu dem Eicosanoid Prostaglandin H2 in zwei Schritten oxidiert. Während COX-1 konstitutiv exprimiert wird, wird die Synthese von COX-2 erst bei Verletzungen, Entzündungen oder Sprossung von Zellen durch Zytokine und Mitogene induziert. Eine Blockierung von COX-2 durch spezifische COX-2-Hemmer verursacht daher keine der von den nichtsteroidalen Antiphlogistika bekannten Nebenwirkungen. COX-2 ist auch die dominante Isoform in Plazenta und den fötalen männlichen Genitalien. Es reguliert möglicherweise die Entstehung neuer Blutgefäße, weshalb die Hemmung von COX-2 bei Krebserkrankungen derzeit untersucht wird. COX-2 gehört zu den Cyclooxygenasen, welche wiederum zu der großen Familie der Pathogen-Induzierbaren-Oxygenasen (PIOXs) zählen.[1]
| Cyclooxygenase-2 | ||
|---|---|---|
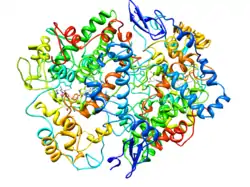
| ||
| COX-2 nach PDB 4COX | ||
|
Vorhandene Strukturdaten: PDB 6COX, 1CX2, 3PGH, 4COX, 5COX, 1PXX, 1CVU, 1DDX | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 587 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | Häm B | |
| Bezeichner | ||
| Gen-Namen | PTGS2 ; COX2; PGG/HS; COX-2; PGHS-2; PHS-2; hCox-2 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.14.99.1, Dioxygenase | |
| Reaktionsart | Oxidation + Peroxidation | |
| Substrat | Arachidonsäure + AH2 + 2 O2 | |
| Produkte | Prostaglandin H2 + A + H2O | |
| Vorkommen | ||
| Homologie-Familie | Prostaglandinsynthase | |
| Übergeordnetes Taxon | Chordatiere | |
Biosynthese
Regelung
Folgendes fördert die Biosynthese der COX-2:
- Entzündungsmediatoren wie TNFα oder Interleukin-1β sowie Lipopolysaccharide.
- Wachstumsfaktoren, Onkogene, der MAP-Kinase-Weg, NF-κB.
- Methandamid, ein Analogon der Endocannabinoide.[2]
Folgendes hemmt die Biosynthese der COX-2:
- Vitamin K2 hemmt die COX-2.[3]
- Dexamethason führt zu einer Destabilisierung der mRNA der COX-2.
- Die Tocotrienole-reiche Fraktion von Palmölen wirkt entzündungshemmend, vermutlich durch Blockierung der COX-2.[4]
- Der Hopfenbitterstoff Humulon unterdrückt die Transkription des der COX-2 zugehörigen Gens.[5]
- Die Cannabinoide Cannabidiol und Cannabigerol, hemmen die COX-2-Synthese auf transkriptioneller Ebene.[6]
Biosynthese
Das humane Gen für die Cyclooxygenase-2 liegt auf dem Chromosom 1 (1q25.2-q25.3). Es handelt sich im Vergleich mit dem Gen für COX-1 um ein kleineres Gen (8 kb) mit 10 Exons. Die Transkription des COX-2-Gens ist vielfach induzierbar (s. Regelung). Die transkribierte mRNA besitzt 4.465 Basen und das translatierte Protein besteht aus 587 Aminosäuren.[7]
Allgemeine Strukturaspekte sind unter Cyclooxygenasen beschrieben.
Vorkommen im Organismus
Cyclooxygenasen sind im Inneren des endoplasmatischen Retikulums, innerhalb der Kernhülle und im Golgiapparat lokalisiert und haften der Innenseiten der Membranen dieser Zellkompartimente an.
Die COX-2 kommt in folgenden Geweben und Organen vor:
- Makrophagen, dort wird sie z. B. über die Aktivierung des CD14-Rezeptors durch Lipopolysaccharide aktiviert, von hier kommt das Prostaglandin E2, welches den ersten Fieberanstieg bewirkt.[8]
- COX-2 kommt in den Endothelzellen proliferierender Blutgefäße, entzündeter Gewebe, und in den Endothelzellen und monozytären Schaumzellen in atherosklerotischen Läsionen vor, (während die COX-1 in Endothelzellen normaler Blutgefäße vorkommt). COX-2 wird ferner durch Scherkräfte in Endothelzellen induziert. Die Rolle von COX-2 in der Atherosklerose und in der Angiogenese ist Gegenstand gegenwärtiger Forschung.
- COX-2 kommt in einer Reihe von Tumorzellen stark vermehrt vor. Da das durch sie gebildetes Prostaglandin-E2 die Bildung des vaskulären endothelialen Wachstumsfaktoren anregt und so die Angiogenese fördert, wird vermutet, dass COX-2 eine Rolle für das Tumorwachstum spielen könnte.[2]
- In den Nieren kommt die COX-2 vor allem in der Macula densa konstitutiv vor und führt zu einer vermehrten Prostacyclinbildung, was die Reninbildung aktiviert.
- Im Gehirn wird COX-2 bei Entzündungen vermehrt induziert. Dies ist in den Endothelzellen der Gefäße des Hypothalamus z. B. in den Bereichen der zirkumventrikulären Organe der Fall, dort wird dann fieberinduzierendes PGE2 gebildet. Aber auch in Gliazellen und Neuronen kann die COX-2-Bildung induziert werden. Sie ist höher bei Neugeborenen und kann im Hippocampus nach epileptischen Anfällen induziert werden.
- Im Rückenmark kommt COX-2 immer vor und ist dort in der Schmerzreizverarbeitung involviert.
Funktion
Neben der für die Cyclooxygenasen allgemeinen Funktion der Bildung von Prostaglandin-H2 aus Arachidonsäure kann die Cyclooxygenase-2 auch sperrigere Substrate wie Endocannabinoide, z. B. Anandamid oder 2-Arachidonylglycerol zu Prostanoiden oxidieren, welche von Isomerasen weiter verstoffwechselt werden.[2] Die Funktion der hierbei entstehenden Metabolite ist noch unbekannt.
Katalysierte Reaktion
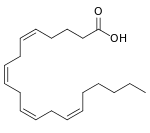 + 2 O2 + AH2 →
+ 2 O2 + AH2 → 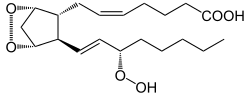 →
→ 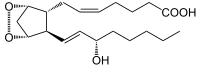 + A + H2O
+ A + H2O
Bedeutung für Erkrankungen
- Entzündungen: COX-2 wird bei Entzündungsprozessen vermehrt transkribiert, die damit zusammenhängenden Symptome (Fieber, Schmerz) lassen sich effektiv mit COX-2-Hemmern behandeln, mit deutlich weniger Nebeneffekten als bei einer Hemmung der Cyclooxygenase-1 (z. B. auf Nieren und Magen).
- Onkologie: COX-2 wird in einer Vielzahl von malignen Tumoren, und zwar sowohl in den eigentlichen Tumorzellen als auch im umgebenden Stroma, induziert. Die im Tumorgewebe gebildeten Prostaglandine, insbesondere PGE2, können dort sowohl das Tumorstroma (Angiogenese, Immunsuppression etc.) als auch Tumorzellen direkt (Proliferation, Hemmung des programmierten Zelltodes – Apoptose) auf multiple Weise beeinflussen. Daher werden derzeit Hoffnungen auf die präventive oder therapeutische Wirkung von COX-2 Inhibitoren in der Krebsbehandlung insbesondere von Tumoren des Magen-Darm-Traktes gesetzt, welche derzeit in mehreren klinischen Versuchen meist in Kombination mit anderen Therapeutika eingesetzt werden. Einer der, zumindest theoretischen, Vorteile der COX-2 gerichteten Therapie ist, dass sowohl die hochvariablen Tumorzellen, die sehr schnell einer Therapie entweichen können, als auch das relativ invariable Stroma angegriffen werden kann, wodurch die Wahrscheinlichkeit einer Resistenzbildung erniedrigt werden sollte.
- Neurologie: Die normale Funktion der COX-2 in Hirnneuronen ist unklar, daher weiß man nicht, ob ein Langzeitgebrauch von COX-2-Hemmern einen physiologischen Effekt auf das Gehirn hat. COX-2 wird aber durch viele Stimuli induziert (z. B. durch Hypoxie, exzitatorisch wirkende Toxine, Entzündungen, epileptische Anfälle) und zwar in Astrozyten, Neuronen und Mikroglia. Ob diese Induktion gegen einen Zelltod schützt oder apoptotisch wirkt, ist nicht klar. Möglicherweise beeinflussen die Cyclooxygenasen die Entstehung von Morbus Alzheimer.
Pharmakologische Beeinflussung
COX-2-Hemmer hemmen vor allem die Aktivität der Cyclooxygenase-2. Zu dieser Wirkstoffgruppe gehören Celecoxib (Celebrex), Etodolac (Lodine), Rofecoxib (Vioxx), Valdecoxib (Bextra) und Etoricoxib (Arcoxia), sowie Lumiracoxib (Prexige).
- Dass eine selektive COX-2-Inhibition thrombotische Ereignisse fördert (da in den Thrombozyten nur COX-1 vorkommt und dort vor allem das thrombosefördernde Thromboxan-A2 gebildet wird, welches dann über das thrombosehemmende Prostacyclin dominieren würde) ist theoretisch denkbar. Tatsächlich musste Rofecoxib aus diesem Grund 2004 wieder vom Markt genommen werden. Lumiracoxib wurde in Deutschland im November 2006 in Form von 100 mg Tabletten (Prexige® 100 mg) nach einem nicht zentralisierten EU-Verfahren zugelassen, im November 2007 ordnete das Bundesinstitut für Arzneimittel und Medizinprodukte das Ruhen der Zulassung an. Am 28. März 2008 wurde die Zulassung aufgrund eines Beschlusses der Europäischen Kommission vollständig widerrufen[9].
- Obwohl theoretische Überlegungen und Versuchsergebnisse eine wesentliche Beteiligung der COX-2 an der Angiogenese nahelegen, kann diese bei chronischen Erkrankungen (Rheuma, Krebserkrankungen) wohl nicht in klinisch relevantem Ausmaß durch COX-2-Hemmer gehemmt werden.[2]
Geschichte
Ab 1972 wurde spekuliert, dass es mehr als eine Cyclooxygenase gäbe. Es gab drei Gruppen, die etwa gleichzeitig um 1990 Cox-2 als weiteres Cox-Enzym und seine Rolle bei Entzündungen entdeckten und später in Patentprozesse verwickelt waren: David Young und Kerry O'Banion an der University of Rochester (1989), die Gruppe von Harvey Hirschmann an der University of California, Los Angeles, und die Gruppe von Daniel Simmons an der Brigham Young University. Die Entdeckung wurde auf einer Konferenz in Montreal 1992 publik. In den Patentstreitigkeiten siegte nach Jahren die Gruppe von Young. Zusätzlich behauptete Philip Needleman, damals an der Washington University in St. Louis und später mit Pfizer und de Entwicklung des Cox-2-Hemmers Celebrex verbunden, bereits Mitte der 1980er Jahre ein Programm zur Suche nach Cox-2 gestartet zu haben und dessen Existenz vermutet zu haben (mit einer Vorhersage auf einer internationalen Konferenz in Florenz 1990).[10][11]
1992 wurde das Gen und die primäre Proteinstruktur für die humane Cyclooxygenase-2 sequenziert. 1996–1999 wurde die kristallographische Struktur aufgeklärt, die auf den ersten Blick eine große Ähnlichkeit zu der Cyclooxygenase-1 zeigte. Ab 1999 gab es die ersten Cyclooxygenase-2-selektiven pharmakologischen Wirkstoffe. Der erste war Rofecoxib (Vioxx) von Merck, gefolgt von Celecoxib (Celebrex) von Monsanto/Searle (später von Pfizer übernommen). Seither werden die wesentlichen Unterschiede in Struktur, Herkunft, Vorkommen, Funktion und Regelung dieser beiden Cyclooxygenasen immer genauer untersucht und aufgeklärt.[2]
Einzelnachweise
- Cyclooxygenase-2. In: Online Mendelian Inheritance in Man. (englisch).
- Simmons, D.L. et al. (2004): Cyclooxygenase isozymes: the biology of prostaglandin synthesis and inhibition. In: Pharmacol. Rev. Bd. 56, S. 387–437. PMID 15317910.
- S. M. Plaza, D. W. Lamson: Vitamin K2 in bone metabolism and osteoporosis. In: Alternative medicine review: a journal of clinical therapeutic. Band 10, Nummer 1, März 2005, S. 24–35, PMID 15771560 (Review).
- Wu SJ,et al.: Tocotrienol-rich fraction of palm oil exhibits anti-inflammatory property by suppressing the expression of inflammatory mediators in human monocytic cells. Mol Nutr Food Res. 2008 Aug;52(8):921-9 PMID 18481320.
- K. Yamamoto, J. Wang, S. Yamamoto, H. Tobe: Suppression of Cyclooxygenase-2 Gene Transcription by Humulone. In: Kenneth V. Honn, Lawrence J. Marnett, Santosh Nigam, Edward Dennis, Charles Serhan (Hrsg.): Eicosanoids and other bioactive lipids in cancer, inflammation, and radiation injury, Band 5. Springer, 2002, ISBN 978-0-30647283-1, S. 73–76.
- Untersuchungen zur entzündungshemmenden Wirkung von Cannabis sativa L.- Extrakten im Modell der Gewebekulturen
- ENSEMBL-Eintrag
- Steiner, A.A. et al. (2006): Cellular and Molecular Bases of the Initiation of Fever. PLoS Biology 4(9):e284.
- BfArM - Risikobewertungsverfahren - Lumiracoxib (Prexige®): Das BfArM ordnet den Widerruf der Zulassung an. 26. Februar 2017, abgerufen am 1. November 2021.
- Tom Nesi, Poison Pills: The Untold Story of the Vioxx Drug Scandal, 2008, S. 75ff
- Needleman's Darstellung floss in den Artikel Superaspirin von Jerome Groopman, The New Yorker, 15. Juni 1998, ein. pdf