Speiseröhrenkrebs
Der Speiseröhrenkrebs oder das Ösophaguskarzinom ist eine seltene bösartige Geschwulst (maligne Neoplasie) des Speiseröhrenepithels. Am häufigsten sind Männer über 55 Jahren betroffen. Die Aussicht auf vollständige Heilung ist gering, aber umso besser, je früher der Krebs erkannt wird. Generell unterscheidet man beim Ösophaguskarzinom zwischen dem Plattenepithelkarzinom (ca. 40 %) und dem Adenokarzinom (ca. 60 %).
| Klassifikation nach ICD-10 | |
|---|---|
| C15 | Bösartige Neubildung des Ösophagus |
| C15.0 | Zervikaler Ösophagus |
| C15.1 | Thorakaler Ösophagus |
| C15.2 | Abdominaler Ösophagus |
| C15.3 | Ösophagus, oberes Drittel |
| C15.4 | Ösophagus, mittleres Drittel |
| C15.5 | Ösophagus, unteres Drittel |
| C15.8 | Ösophagus, mehrere Teilbereiche überlappend |
| C15.9 | Ösophagus, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
Histopathologie: Adeno- und Plattenepithelkarzinom
Man unterscheidet grundsätzlich zwei verschiedene Formen des Speiseröhrenkrebses, das sogenannte Adenokarzinom und das Plattenepithelkarzinom. Diese unterscheiden sich hinsichtlich ihres feingeweblichen Bildes (Histologie), ihrer Ursachen (Ätiologie), ihrer Lokalisation (obere, mittlere, untere Speiseröhre) und ihrer Genetik etc. Die Adenokarzinome, welche in der westlichen Welt an Häufigkeit zunehmen, entstehen in der unteren Speiseröhre, auf dem Boden einer Refluxerkrankung (saurer Rückfluss in die Speiseröhre). Als Vorstufe (Präkanzerose) wird der sogenannte Barrett-Ösophagus (früher Endobrachyösophagus) angesehen. Die Plattenepithelkarzinome entstehen in jeder Lokalisation der Speiseröhre (cervikal = am Hals; suprabifurkal = oberhalb der Gabelung der Luftröhre, infrabifurkal = unterhalb der Gabelung der Luftröhre). Als wesentliche Hauptursachen für das Plattenepithelkarzinom werden Alkohol und Rauchen angenommen.
Epidemiologie
Speiseröhrenkrebs kommt häufiger im fernen Osten als in Europa vor, was wahrscheinlich an den Ess- und Trinkgewohnheiten liegt. In Asien wird beispielsweise viel heißer Tee konsumiert.[1] Dabei ist nicht der Tee selbst karzinogen, sondern durch die Hitze entstehende Verbrennungen. In den USA sollten 2020 nach Schätzungen von SEER 18.440 Fälle von Speiseröhrenkrebs auftreten.[2] Das sind 1 % aller Tumorerkrankungen. Gleichzeitig sterben 16.170 Patienten an den Folgen eines Speiseröhrenkrebses. Das sind 2,7 % aller Krebstodesfälle der USA. Die Inzidenz lag in den Jahren 2013–2016 bei 4,3 pro 100.000 Einwohner. Die Prävalenz der Erkrankten beträgt 47.690 (= lebende Patienten mit Speiseröhrenkrebs in den USA, Schätzung für 2017). 18 % der Fälle waren lokal begrenzt. Bei diesen überlebten 47,1 % 5 Jahre. Weitere 33 % waren regional ausgebreitet. Von diesen überlebten 25,2 % 5 Jahre. 39 % der Fälle waren zum Zeitpunkt der Diagnose bereits metastasiert. Von diesen überlebten nur 4,9 % 5 Jahre. Bei weiteren 10 % war der Ausbreitungsgrad unbekannt. Männer hatten mit 7,3 pro 100.000 Einwohner und Jahr ein höheres Risiko, an Speiseröhrenkrebs zu erkranken, als Frauen mit 1,7. Das mediane Erkrankungsalter in den USA betrug 68 Jahre.
Risikofaktoren
Folgende Faktoren erhöhen das Risiko an Speiseröhrenkrebs zu erkranken:
- Rauchen
- Alkoholkonsum
- Übergewicht
- Achalasie
- frühere Strahlentherapie im Hals- oder Thoraxbereich
- frühere Verletzung durch Säuren oder Laugen
- Reflux
- Barrett-Ösophagus
- Vorbestrahlung im Hals-/Thoraxbereich (dosisabhängig)[3]
- Vordiagnose von Plattenepithelkarzinomen im Kopf-Hals Bereich oder der Lunge[3]
- Howel-Evans-Syndrom (Tylosis): autosomal-dominante Dys/Hyperkeratose Füße und Hände: bis zu 90 % entwickeln ein Plattenepithelkarzinom des Ösophagus[3]
- männliches Geschlecht (bei Plattenepithelkarzinomen)[3]
Rauchen erhöht das Risiko für Ösophaguskarzinome.[4] In Taiwan wurde der Einfluss von Rauchen, Alkohol und Betelnüssen auf die Entstehung von Ösophaguskarzinomen untersucht.[5] Raucher hatten 5,9- bis 8,5-mal häufiger Speiseröhrenkrebs. Die Zunahme betrifft sowohl Plattenepithelkarzinome als auch Adenokarzinome. Bei Einnahme von Alkohol und Rauchen erhöhte sich das Risiko auf das 10–23,9-fache gegenüber Menschen, die weder Alkohol tranken noch rauchten.
Alkohol erhöht vor allem das Risiko von Plattenepithelkarzinomen der Speiseröhre.[4][6] Adenokarzinome und Tumoren am Übergang von Speiseröhre zum Magen (AEG) sind bei Alkoholgebrauch nicht häufiger.[7] Das lässt sich mit dem anderen Entstehungsmechanismus über eine Metaplasie des Plattenepithels im Ösophagus erklären.
Auch Übergewicht erhöht das Risiko für Speiseröhrenkarzinome. Betroffen sind vor allem Adenokarzinome des Ösophagus und des ösophagogastralen Übergangs.[8] Bei übergewichtigen Menschen kommt es häufig zu einem Reflux von Magensäure in die Speiseröhre. Dieses kann eine Metaplasie des Plattenepithels bewirken. Diese gilt als Risikoläsion für die Entstehung eines Karzinoms.
Bei einer Achalasie ist der Nahrungstransport in der Speiseröhre behindert, weil der untere Ösophagusmund sich nicht regelrecht öffnet. Eine Achalasie erhöht das Risiko für Plattenepithelkarzinome der Speiseröhre um das 11-fache, für Adenokarzinome um das 10,4-fache.[9]
Eine gastro-ösophageale Refluxerkrankung entsteht, wenn regelmäßig Magensäure in die Speiseröhre aufsteigt (klinisch Sodbrennen). Dieser Vorgang wird durch einen zu niedrigen Muskeltonus des unteren Ösophagussphinkters begünstigt, was durch Nikotin, Alkohol, Koffein, fettreiche Ernährung und diverse Medikamente ausgelöst werden kann.
Eine fakultative Präkanzerose für das Ösophaguskarzinom stellt das Barrett-Syndrom dar.
Symptome
Speiseröhrenkrebs breitet sich rapide aus, und die Symptome sind oft uncharakteristisch, weshalb die Krankheit meist erst in späten Stadien diagnostiziert wird.
Das Kardinalsymptom ist die Dysphagie (Schluckbeschwerden – beim Essen kann es sich anfühlen, als ob der Bissen im Hals oder hinter den Rippen stecken bleiben würde, verbunden mit lokal andauerndem Schmerz). Später kann auch weiche Nahrung zum Problem werden und eventuell auch das Trinken. Häufige Symptome sind ein brennendes Gefühl beim Schlucken von Essen, Herzrasen beim Trinken von heißen Getränken.
Eine Obstruktion (Verengung) der Speiseröhre tritt meist erst spät oder gar nicht ein, da sich das Karzinom in Längsrichtung ausbreitet. Späte Symptome schließen das Aussondern von Speichel, Ausspucken von unverdauter Nahrung und Gewichtsverlust ein. Lungenentzündungen, ausgelöst durch Flüssigkeit, die in die Luftröhre geraten ist, können auftreten (Aspiration). Husten und Heiserkeit können ebenfalls auftreten, wenn anderes Gewebe nahe der Speiseröhre von Krebs befallen wurde. Die Symptome des Krebsbefalls, der sich auf andere Bereiche ausgebreitet hat, hängen davon ab, wo der Krebs sich ausbreitet.
Verbesserte Behandlungen haben geholfen, die Lebenserwartung und Lebensqualität von Menschen mit dieser Krankheit zu erhöhen.
Weitere Symptome sind:[10]
- Inappetenz
- frühes Sättigungsgefühl
- ungewollter Gewichtsverlust
- gastrointestinale Blutung
Diagnose
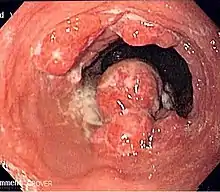
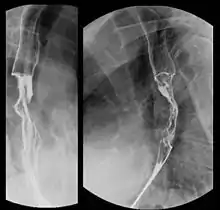
Die wichtigste Maßnahme zur Diagnosestellung ist eine Spiegelung (Endoskopie) der Speiseröhre. Diese wird meist im Rahmen einer kombinierten Ösophago-Gastro-Duodenoskopie (Spiegelung von Speiseröhre, Magen und Zwölffingerdarm) durchgeführt. Nachdem ein Betäubungsmittel verabreicht wurde, wird ein dünner, flexibler Schlauch in die Speiseröhre eingeführt. Von suspekten Bereichen werden dabei Biopsien entnommen und feingeweblich von einem Pathologen untersucht.
Eine Bariumsulfat-Röntgenuntersuchung während des Schluckvorgangs erlaubt es, Flüssigkeit zu beobachten, die in der Speiseröhre nach unten transportiert wird. Dies kann helfen, Größe, Verfassung und Lage der Geschwulst zu beobachten.
Eine endoskopische Ultraschalluntersuchung kann die Tiefe des Geschwürs bestimmen und liefert weitere Informationen für die Behandlung. Bei der Endoskopie kann ebenfalls eine Gewebeprobe entnommen (Biopsie) und im Labor untersucht werden.
Bluttests und andere Röntgenuntersuchungen können dazu dienen festzustellen, ob sich das Krebsgeschwür auch außerhalb der Speiseröhre ausgebreitet hat.
Eine Bronchoskopie wird normalerweise durchgeführt, um festzustellen, ob ein Befall der Luftröhre vorliegt. Andere Tests, die eine mögliche Ausbreitung (Metastasen) des Tumors nachweisen, sind z. B. die Computertomographie der Brust, des Abdomens und des Beckens und die Positronen-Emissions-Tomographie. Ein Knochenszintigramm kann aufgenommen werden, wenn der Verdacht besteht, dass Knochen befallen sind.
Stadien
Die Stadieneinteilung erfolgt nach der achten Auflage der TNM-Klassifikation der UICC[11] Diese Klassifikation gilt nur für Karzinome, also Tumoren, die vom Oberflächenepithelzellen ausgehen, nicht aber für Sarkome oder Lymphome. Eingeschlossen sind auch Tumoren vom Übergang zum Magen. Wenn das Zentrum des Tumors bis zu 2 cm vom Übergang Speiseröhre-Magen in der Magenkardia liegt und der Tumor in die Speiseröhre ragt, so gilt er als Speiseröhrentumor.
| T | TX | Primärtumor kann nicht beurteilt werden |
| T0 | Kein Anhalt für Primärtumor | |
| Tis | Carcinoma in situ | |
| T1 | Tumor infiltriert Lamina propria (innere Gewebsschicht), Muscularis mucosae (innere Muskelschicht) oder Submukosa (Zwischenschicht) | |
| T1a | Tumor infiltriert Lamina propria oder Muscularis mucosae | |
| T1b | Tumor infiltriert die Submukosa | |
| T2 | Tumor infiltriert Muscularis propria (äußere Muskelschicht) | |
| T3 | Tumor infiltriert Adventitia (äußeres Hüllgewebe) | |
| T4 | Tumor infiltriert Nachbarstrukturen | |
| T4a | Tumor infiltriert Pleura, Pericard, Vena azygos, Zwerchfell oder Peritoneum | |
| T4b | Tumor infiltriert Aorta, Wirbelkörper oder Trachea | |
| N | NX | Regionäre Lymphknoten können nicht beurteilt werden |
| N0 | Keine regionären Lymphknotenmetastasen | |
| N1 | Metastasen in ein bis zwei regionären Lymphknoten | |
| N2 | Metastasen in 3–6 regionären Lymphknoten | |
| N3 | Metastasen in mehr als 6 regionäre Lymphknoten | |
| M | M0 | Keine Fernmetastasen nachgewiesen |
| M1 | Fernmetastasen nachgewiesen |
Die Stadieneinteilung gilt sowohl für die klinische Klassifikation (z. B. cT2 cN1 M0) als auch für die postoperative pathologische Klassifikation (z. B. pT3 pN0 M0).
Zum N-Stadium: Regionäre Lymphknoten sind diejenigen, die dem Lymphabflussgebiet der Speiseröhre entsprechen. Dazu gehören auch die paraösophagealen Lymphknoten des Halses. Zusätzlich die zöliakalen Lymphknoten, die am Truncus coeliacus im Bauchraum liegen. Metastasen in den supraclavikulären Lymphknoten in der Schlüsselbeingrube bedeuten ein M1 Stadium.
Therapie
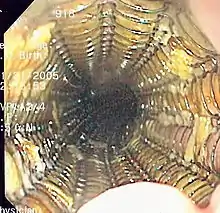
Die Behandlung hängt von der Größe und dem Standort des Tumors ab, außerdem ob und wie weit er sich ausgebreitet hat, vom Alter und dem generellen Gesundheitszustand des Patienten.
Die Behandlungsmöglichkeiten sind Operation, Bestrahlungstherapie, medikamentöse Anti-Krebs-Therapie oder eine Kombination all dieser Therapien. Das Ziel der Behandlung ist grundsätzlich die Heilung (kurativer Therapieansatz), was am besten bei den frühen Formen oder nach einer Vorbehandlung mit Medikamenten und Bestrahlung vor der Operation (neoadjuvante Therapie) möglich ist. Nicht selten kann bei einem Anteil der Patienten (20-40 %) mit fortgeschrittenen Tumorerkrankung nach einer kombinierten Radiochemotherapie eine Heilung erzielt werden. Bei Patienten mit Fernmetastasen kommt ein kuratives Konzept nur noch selten in Einsatz. Wenn der Zustand des Patienten eine kurative Behandlung nicht erlaubt (z. B. bei mehreren Begleiterkrankungen, mehrere Fernmetastasen) wird palliativ behandelt[10]. Gemäß Leitlinie erfolgt die Operation als subtotale Oesophagus-en-bloc-Resektion mit Entfernung der regionalen Lymphknoten. Der Ersatz der Speiseröhre wird in der Regel mit dem schlauchförmig umgewandelten Magen (Magenhochzug) erreicht. Als Ausweichmethode, z. B. nach Voroperation am Magen, wird ein Anteil des Dickdarmes interponiert (Koloninterponat).
Ziel der palliativen Behandlung ist es, dass der Patient sich besser fühlt, indem der Schmerz verringert und das Schlucken erleichtert wird. Mögliche Behandlungen sind eine Kombination aus Bestrahlung und medikamentöser Behandlung, photodynamische Therapie, bei der mit einem Laser Blockaden der Speiseröhre entfernt werden, eine Ausdehnungstherapie oder eine Überbrückungstherapie mittels spezieller Stents.
In den letzten Jahren hat sich für frühe Formen (auf die Schleimhaut begrenzt) von Speiseröhrenkrebs (sowohl Adeno- als auch Plattenepithelkarzinom) die endoskopische Therapie (endoskopische Resektion (ER)) etabliert, insbesondere als endoskopische Mukosaresektion (EMR). Bei dieser Form der endoskopischen Therapie wird während einer Magenspiegelung der Tumor mit einer speziellen, auf das Endoskop angebrachten Vorrichtung eingesaugt und anschließend reseziert. Diese Therapie sollte dann angewendet werden, wenn die bösartige Veränderung nur auf die oberste Schleimhautschicht (die sogenannte Mukosa) beschränkt ist, da in diesem Falle das Metastasierungsrisiko sehr gering ist. Der Vorteil der EMR ist die niedrige Komplikationsrate, während die Operation (die sogenannte radikale Ösophagusresektion) mit einer Komplikationsrate von 30–50 % und einer Sterblichkeitsrate von 5–20 % – je nach Erfahrung des chirurgischen Zentrums – einhergeht. Auch die endoskopische Therapie sollte nur in Krankenhäusern mit großer Erfahrung in diesem Bereich durchgeführt werden.
Prophylaxe
Es gibt kein Mittel, um diese Art von Krebs zu vermeiden. Man kann das Risiko, ihn zu bekommen, verringern, indem man nicht raucht, keinen Alkohol trinkt und den Konsum sehr heißer Speisen und Getränke meidet. Ein schützender Effekt von frischem Obst und Gemüse sowie durch längerfristige Einnahme von Acetylsalicylsäure (ASS) und nichtsteroidalen Antirheumatika (NSAR) wird beschrieben. Um Probleme frühzeitig zu erkennen, sind die regelmäßige Untersuchung und die aufmerksame Beobachtung von Veränderungen des eigenen Körpers sinnvoll.
Literatur
- S3-Leitlinie zur Diagnostik und Therapie der Plattenepithelkarzinome und Adenokarzinome des Ösophagus der Deutschen Krebsgesellschaft, AWMF-Register Nr. 021/023OL, Stand: 31. Dezember 2018, gültig bis 30. Dezember 2023
Weblinks
- Ösophaguskarzinom-bilder, auch Bilder von eingebrachten palliativen Stents
- Plattenephitelkarzinome und Adenokarzinome des Ösophagus: Diagnostik und Therapie
- Illustration der Ösophagusresektion und der Rekonstruktion durch Magenhochzug
- Beschreibung der minimal-invasiven Operationstechnik beim Ösophaguskarzinom
Einzelnachweise
- Heißer Tee – ein Risiko für Speiseröhrenkrebs? 23. März 2019, abgerufen am 30. März 2019.
- Surveillance, Epidemiology, and End Results Programm: Cancer Stat Facts: Esophageal Cancer. National Cancer Institute, USA, abgerufen am 13. August 2020.
- Michael Stahl, Salah-Eddin Al-Batran, Markus Borner, Ines Gockel, Lars Grenacher, Holger Hass, Dieter Köberle, Markus Möhler, Rainer Porschen, Ron Pritzkuleit, Holger Rumpold, Martin Stuschke, Marianne Sinn: Ösophaguskarzinom. In: Onkopedia. Dezember 2018, abgerufen am 28. März 2020.
- Federführende Fachgesellschaft: Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS): S3-Leitlinie Diagnostik und Therapie der Plattenepithelkarzinome und Adenokarzinome des Ösophagus. Hrsg.: Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft), Deutsche Krebshilfe, AWMF. Langversion 2.0, AWMF Registernummer: 021/023OL Auflage. 2018 (leitlinienprogramm-onkologie.de).
- Chien-Hung Lee, Deng-Chyang Wu, Jang-Ming Lee, I-Chen Wu, Yih-Gang Goan: Anatomical subsite discrepancy in relation to the impact of the consumption of alcohol, tobacco and betel quid on esophageal cancer. In: International Journal of Cancer. Band 120, Nr. 8, 15. April 2007, S. 1755–1762, doi:10.1002/ijc.22324.
- Farhad Islami, Veronika Fedirko, Irene Tramacere, Vincenzo Bagnardi, Mazda Jenab: Alcohol drinking and esophageal squamous cell carcinoma with focus on light-drinkers and never-smokers: A systematic review and meta-analysis. In: International Journal of Cancer. Band 129, Nr. 10, 15. November 2011, S. 2473–2484, doi:10.1002/ijc.25885.
- I. Tramacere, E. Negri, C. Pelucchi, V. Bagnardi, M. Rota, L. Scotti, F. Islami, G. Corrao, C. La Vecchia, P. Boffetta: A meta-analysis on alcohol drinking and gastric cancer risk. In: Annals of Oncology. Band 23, Nr. 1, 2012, S. 28–36, doi:10.1093/annonc/mdr135.
- F. Turati, I. Tramacere, C. La Vecchia, E. Negri: A meta-analysis of body mass index and esophageal and gastric cardia adenocarcinoma. In: Annals of Oncology. Band 24, Nr. 3, 1. März 2013, ISSN 0923-7534, S. 609–617, doi:10.1093/annonc/mds244.
- K. Zendehdel, O. Nyrén, A. Edberg, W. Ye: Risk of esophageal adenocarcinoma in achalasia patients, a retrospective cohort study in Sweden. In: American Journal of Gastroenterology. Band 106, Nr. 1, 2011, S. 57–61, doi:10.1038/ajg.2010.449, PMID 21212754.
- S3-Leitlinie Diagnostik und Therapie der Plattenepithelkarzinome und Adenokarzinome des Ösophagus, Seite 104-107. Langversion 2.0 – Dezember 2018.
- C. Wittekind (Hrsg.): TNM. Klassifikation maligner Tumoren. 8. Auflage. Wiley-VCH Verlag, 2017, ISBN 978-3-527-34280-8.