Cytochrom P450
Die Cytochrome P450 (CYP) sind Hämproteine mit enzymatischer Aktivität (Oxidoreduktasen), die praktisch in allen Formen des Lebens vorkommen. In Tieren wurden sie in allen Organen, insbesondere in der Leber, nachgewiesen. Beim Menschen wurden 57 verschiedene CYPs gefunden. CYPs reagieren fast ausschließlich als Monooxygenasen (Ein-Sauerstoffatom-Überträger). Der wichtigste Reaktionstyp ist die Hydroxylierung nicht-aktivierter C-H-Bindungen:
Als Reduktionsmittel dienen NADH/NADPH (16 Fälle), Flavine oder Flavoproteine (26 Fälle) oder Eisen-Schwefel-Proteine wie Ferredoxin (5 Fälle).[1]
CYPs leisten einen wichtigen Beitrag bei der Verstoffwechselung wasserunlöslicher Stoffe durch Oxidation. Diese werden dadurch besser wasserlöslich und können schneller aus dem Körper ausgeschieden werden (Biotransformation). Als Substrate fungieren sowohl körpereigene als auch körperfremde Stoffe (z. B. Arzneimittel). Daneben sind CYPs an wichtigen Schritten der Synthese von Steroidhormonen, Prostaglandinen, Retinoiden und von Vitamin D3 (z. B. durch das CYP27B1) beteiligt.
Geschichte
Die Cytochrome P450 (P = Pigment) wurden in Ermangelung jeglichen Wissens über ihre Funktion nach der ungewöhnlichen Lage der Soret-Bande des Komplexes mit Kohlenmonoxid bei 450 nm benannt, die erstmals von Martin Klingenberg 1958 bei der Arbeit mit "Cytochrom b5" beobachtet wurde. Eine erste Funktion im Steroidmetabolismus konnte 1963 von Estabrook, Cooper und Rosenthal gesichert werden.[2]
Struktur
Cytochrom-P450-Enzyme sind Proteine, die üblicherweise aus ca. 500 Aminosäuren bestehen. Das aktive Zentrum des Enzyms, an dem die Katalyse stattfindet, ist ein Eisen(III)-Ion, dessen äquatoriale Koordinationsstellen durch die vier Stickstoffatome eines Protoporphyrin IX besetzt werden. Dieses Häm b ist durch die Koordination eines Cysteinatorestes in einer der beiden axialen Positionen des Eisenzentrums mit dem Proteinrückgrat verknüpft. Die zweite axiale Position wird im Ruhezustand des Enzyms durch einen schwach gebundenen Wasserliganden besetzt.
Cytochrom-P450-Enzyme sind meist Teil eines zwei- oder dreiteiligen Proteinsystems; die Redoxpartner sind für die Übertragung der Elektronen vom Cofaktor NAD(P)H auf P450 zuständig. In Eukaryoten herrschen Zweikomponentsysteme vor, mit einer NADPH-Cytochrom-P450-Oxidoreduktase (CPR) als Partner. Bei den Dreikomponentsystemen in Prokaryoten und Mitochondrien kommt neben einem Flavoprotein meist noch ein Eisen-Schwefel-Protein (Ferredoxin) hinzu.[3]
Typen
Eine eigene Nomenklatur stellt eine Ordnung über die zahlreichen Untertypen von Cytochrom P450 her. Die Vertreter im menschlichen Organismus sind: CYP1A1, CYP1A2, CYP1B1, CYP2A6, CYP2A7, CYP2A13, CYP2B6, CYP2C8, CYP2C9, CYP2C18, CYP2C19, CYP2D6, CYP2E1, CYP2F1, CYP2J2, CYP2R1, CYP2S1, CYP2U1, CYP2W1, CYP3A4, CYP3A5, CYP3A7, CYP3A43, CYP4A11, CYP4A22, CYP4B1, CYP4F2, CYP4F3, CYP4F8, CYP4F11, CYP4F12, CYP4F22, CYP4V2, CYP4X1, CYP4Z2, CYP5A1, CYP7A1, CYP7B1, CYP8A1, CYP8B1, CYP11A1, CYP11B1, CYP11B2, CYP17A1, CYP19A1, CYP20A1, CYP21A1, CYP21A2, CYP24A1, CYP26A1, CYP26B1, CYP26C1, CYP27A1, CYP27B1, CYP27C1, CYP39A1, CYP46A1, CYP51A1.
Wirkungsmechanismus in Grundzügen
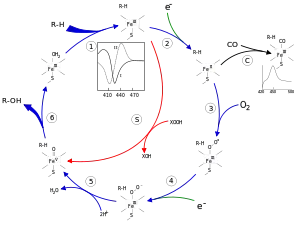
Der Katalysezyklus beginnt mit der Bindung eines Substratmoleküls in der Nähe des aktiven Zentrums. Dadurch wird der labile Wasserligand verdrängt. Nun wird das aktive Zentrum einmal reduziert und anschließend molekularer Sauerstoff an das Eisenzentrum angelagert. Nach Aufnahme eines weiteren Elektrons und zweier Protonen wird die Bindung des Disauerstoffs gespalten. Eines der Sauerstoffatome wird dabei als Wassermolekül abgegeben, das andere auf das Substrat übertragen. Abschließend wird das oxidierte Substrat durch eintretendes Wasser verdrängt und der Ruhezustand wiederhergestellt. Die Reduktionsäquivalente werden hierbei von NADPH und einem Flavoprotein (z. B. NADPH-Cytochrom-P450-Reduktase) bereitgestellt. In Dreikomponentensystemen nimmt meist noch ein Eisen-Schwefel-Protein an der Elektronenübertragung teil.[3] Anstelle des nativen Systems O2/NADPH kann auch Wasserstoffperoxid zur Erzeugung der aktiven Spezies verwendet werden (siehe S in Abb.). Nachteilig ist dabei, dass das Enzym schnell Schaden nimmt und somit seine Aktivität verliert.
Eine Störung kann zum Cytochrom-POR-Mangel führen.
Siehe auch
Literatur
- Hasler JA: Human Cytochromes P450. In: Mol. Aspects Med.. 20, 1999, S. 1–137. doi:10.1016/S0098-2997(99)00005-9.
- Sono M, Roach MP, Coulter ED, Dawson JH: Heme-Containing Oxygenases. In: Chem. Rev.. 96, Nr. 7, November 1996, S. 2841–2888. PMID 11848843.
- Solomon EI, Brunold TC, Davis MI, et al.: Geometric and electronic structure/function correlations in non-heme iron enzymes. In: Chem. Rev.. 100, Nr. 1, Januar 2000, S. 235–350. PMID 11749238.
- Guengerich FP: Reactions and significance of cytochrome P-450 enzymes. In: J. Biol. Chem.. 266, Nr. 16, Juni 1991, S. 10019–22. PMID 2037557.
- K. J. McLean, M. Sabri u. a.: Biodiversity of cytochrome P450 redox systems. In: Biochem. Soc. Trans. Band 33, Pt 4August 2005, S. 796–801, doi:10.1042/BST0330796. PMID 16042601. (Review).
- I. G. Denisov, A. Y. Shih, S. G. Sligar: Structural differences between soluble and membrane bound cytochrome P450s. In: Journal of Inorganic Biochemistry. Band 108, März 2012, S. 150–158, doi:10.1016/j.jinorgbio.2011.11.026. PMID 22244217.
Einzelnachweise
- UniProt-Suchergebnis CYP450 (Mensch) nach EC-Nummer
- Estabrook RW: A passion for P450s (remembrances of the early history of research on cytochrome P450). In: Drug Metab. Dispos.. 31, Nr. 12, Dezember 2003, S. 1461–73. doi:10.1124/dmd.31.12.1461. PMID 14625342.
- Interpro: IPR001128:Cytochrome P450
Weblinks
- Die Cytochrom-P450-Superfamilie auf KEGG
- PROSITE-Eintrag
- Cytochrome P450 Datenbank für Drug-Cytochrom-Interaktionen (engl.)
- Liste mit verstoffwechselten Arzneimitteln, Enzyminduktoren und Enzymhemmern für die einzelnen Isoenzyme
- Jennifer McDowall/Interpro: Protein Of The Month: Cytochrome P450. (engl.)
- Video der Gruppe von Nicholas Turner, University of Manchester: Expanding the toolbox of cytochrome P450s through enzyme engineering (engl.)