Glutaminsäure
Glutaminsäure (auch α-Aminoglutarsäure, 2-Aminoglutarsäure) ist eine α-Aminosäure, die in zwei Spiegelbildisomeren (Enantiomere) vorkommt, deren eine proteinogene Form der menschliche Organismus selber herstellen kann (nicht essentielle Aminosäure). Im Dreibuchstabencode wird sie als Glu und im Einbuchstabencode als E bezeichnet. Ihre Salze und Ester werden Glutamate genannt. In Biologie und Medizin wird die Glutaminsäure meist Glutamat genannt, da die Verbindung im Körper dissoziiert vorliegt. Glutaminsäure ist ein wichtiger Baustein von Proteinen; daneben ist Glutamat einer der wichtigsten erregenden Neurotransmitter im zentralen Nervensystem (ZNS) auch des menschlichen Organismus. Als Lebensmittelzusatzstoff werden L-Glutaminsäure (E 620) sowie einige ihrer Salze (siehe Glutamate) als Geschmacksverstärker[7] eingesetzt, besonders in der asiatischen Küche und bei Convenience-Produkten.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
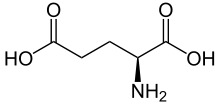 | ||||||||||||||||
| Struktur der natürlich vorkommenden L-Glutaminsäure | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Glutaminsäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H9NO4 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[3] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 147,13 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,54 g·cm−3 (20 °C)[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
Zersetzung bei 205 °C[3] | |||||||||||||||
| pKS-Wert | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Stereochemie
Aminosäuren sind chirale Moleküle. In der Natur liegt im Wesentlichen nur die L-(+)-Glutaminsäure [Synonym: (S)-Glutaminsäure] vor. Wenn in diesem Text oder in der wissenschaftlichen Literatur „Glutaminsäure“ ohne weiteren Namenszusatz (Präfix) erwähnt wird, ist L-Glutaminsäure gemeint.
Die D-(−)-Glutaminsäure [Synonym: (R)-Glutaminsäure] kann auf chemischem Wege erzeugt werden. Auf sie und das Racemat aus beiden Enantiomeren wird in diesem Artikel nicht näher eingegangen.
| Isomere von Glutaminsäure | ||
| Name | L-Glutaminsäure | D-Glutaminsäure |
| Andere Namen | (S)-Glutaminsäure (+)-Glutaminsäure | (R)-Glutaminsäure (−)-Glutaminsäure |
| Strukturformel |  | 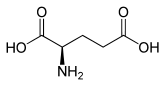 |
| CAS-Nummer | 56-86-0 | 6893-26-1 |
| 617-65-2 (DL) | ||
| EG-Nummer | 200-293-7 | 230-000-8 |
| 210-522-2 (DL) | ||
| ECHA-Infocard | 100.000.267 | 100.027.273 |
| 100.009.567 (DL) | ||
| PubChem | 33032 | 23327 |
| 611 (DL) | ||
| DrugBank | DB00142 | |
| – (DL) | ||
| Wikidata | Q26995161 | Q27077040 |
| Q181136 (DL) | ||
Vorkommen
L-Glutaminsäure kommt in den meisten Proteinen in unterschiedlichen Anteilen vor und ist in jedem eiweißhaltigen Nahrungsmittel vorhanden. Die folgenden Beispiele beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil von Glutaminsäure am Gesamtprotein angegeben.[8] Besonders reich an freiem L-Glutamat sind Käse und Fleischprodukte.
| Lebensmittel | Protein | Glutaminsäure | Anteil |
|---|---|---|---|
| Rindfleisch, roh | 21,26 g | 3191 mg | 15,0 % |
| Hähnchenbrustfilet, roh | 23,09 g | 3458 mg | 15,0 % |
| Lachs, roh | 20,42 g | 2830 mg | 13,9 % |
| Hühnerei | 12,58 g | 1676 mg | 13,3 % |
| Kuhmilch, 3,7 % Fett | 3,28 g | 687 mg | 20,9 % |
| Walnüsse | 15,23 g | 2816 mg | 18,5 % |
| Weizen-Vollkornmehl | 13,21 g | 4328 mg | 32,8 % |
| Mais-Vollkornmehl | 6,93 g | 1300 mg | 18,8 % |
| Reis, ungeschält | 7,94 g | 1618 mg | 20,4 % |
| Erbsen, getrocknet | 24,55 g | 4196 mg | 17,1 % |
| Tomatenpüree | 1,65 g | 658 mg | 39,9 % |
Geschichte
Durch den schwefelsauren Aufschluss von Gluten gelang dem deutschen Chemiker Heinrich Ritthausen 1866 an der Landwirtschaftlichen Akademie Waldau bei Königsberg erstmals die Isolierung von Glutaminsäure.[9] An den ihm von Ritthausen übergebenen Kristallen konnte Gustav Werther, zu der Zeit Professor für Chemie in Königsberg, die Zusammensetzung der Glutaminsäure richtig bestimmen.[10] Nach dem Wechsel Ritthausens an die Landwirtschaftliche Akademie in Bonn-Poppelsdorf veranlasste er dort den Chemiker Wilhelm Dittmar mit der Strukturaufklärung, die Dittmar 1872 gelang.[11] Die Ergebnisse wurden 1890 durch Ludwig Wolff bestätigt.[12]
Eigenschaften
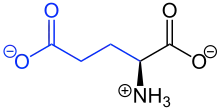
bei pH 7,4 mit der Seitenkette in blau
Der isoelektrische Punkt der Glutaminsäure liegt bei pH 3,24.[13] Die Dicarbonsäure löst sich nur wenig in Wasser (≈11 g·l−1 bei 25 °C) und Ethanol;[3] die Lösung reagiert stark sauer (pKCOOH 2,16, pKγ-COOH 4,32[4]).
Herstellung
L-Glutaminsäure wird kommerziell ausschließlich nach der Fermentationsmethode (Sojasauce, Flüssigwürze) hergestellt. Es begann damit, dass systematisch nach Wildtyp-Organismen geforscht wurde, bei denen sich L-Glutaminsäure unter Verwendung günstiger Nährmedien (Edukte) und Kulturbedingungen (Temperatur, Konzentration von Spurenelementen etc.) anreichern ließen. Durch Verwendung von Mutanten wurde die Fermentationsmethode optimiert.[14][15]
Derivate
Beim Erhitzen einer Mischung aus gleichen Gewichtsteilen Glutaminsäure und Wasser in einem Autoklaven erhält man unter Wasserabspaltung bei Reaktionstemperaturen von 135–143 °C Pyroglutaminsäure, ein cyclisches Amid (Lactam).
Physiologische Bedeutung
Wie bei allen anderen Aminosäuren wird auch bei Glutamat nur das L-Isomer im Stoffwechsel des menschlichen Körpers als Baustein verwendet. Als proteinogene α-Aminosäure ist L-Glutaminsäure Bestandteil von Proteinen. Daneben spielt sie im Zellstoffwechsel insofern eine wesentliche Rolle, als sie über den Citratzyklus in Verbindung zum Kohlenhydratstoffwechsel steht. Darüber hinaus wird L-Glutaminsäure für die Bildung anderer Aminosäuren herangezogen.
L-Glutaminsäure bindet das beim Protein- und Aminosäureabbau freiwerdende Zellgift Ammoniak unter Bildung von Glutamin durch folgende Reaktion:
- α-Ketoglutarat → Glutaminsäure → Glutamin
L-Glutamat ist der wichtigste exzitatorische Neurotransmitter im zentralen Nervensystem der Wirbeltiere. Es wird präsynaptisch freigesetzt und bindet postsynaptisch an spezifische Glutamat-Rezeptoren. Im Zentralnervensystem kann L-Glutaminsäure durch das Enzym L-Glutaminsäuredecarboxylase zu γ-Aminobuttersäure (GABA) decarboxyliert werden, die als Neurotransmitter an inhibitorischen Synapsen wirkt. L-Glutaminsäure ist die einzige Aminosäure, welche im Gehirn oxidiert, transaminiert, aminiert und decarboxyliert wird.
Bedeutung im Citratzyklus
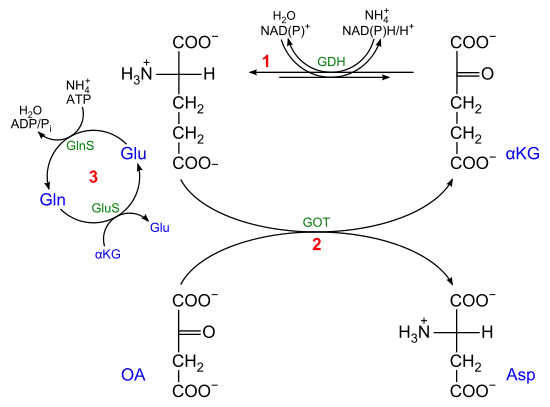
L-Glutamat entsteht im Citratzyklus aus α-Ketoglutarat (αKG) und einem Ammoniumion durch die Reaktion des Enzyms Glutamatdehydrogenase (GDH) (1). Ein weiteres Ammoniumion kann über die Reaktion der Glutamin-Synthetase (GlnS) abgefangen werden, wobei Glutamin entsteht (3). Beide Reaktionen dienen der spontanen Entgiftung aller Gewebe und sind im Hirn von besonderer Bedeutung.
Für die endgültige Entgiftung müssen Ammoniumionen dem Harnstoffzyklus zugeführt werden. Dies erfolgt sowohl durch Übertragung (Transaminierung) auf Oxalacetat (OA) (2), als auch über die Glutamat-Dehydrogenase-Reaktion (1). Glutamin kann mit α-Ketoglutarat in Pflanzen zu zwei Molekülen L-Glutaminsäure umgesetzt (3) und damit der GDH-Reaktion zugeführt werden. Diese Reaktion wird durch Glutamat-Synthase (GluS) katalysiert.
Bei der Aminosäuresynthese ist L-Glutaminsäure der NH2-Donor in einer Transaminierungsreaktion. Diese überführt α-Ketosäuren in die homologen α-Aminosäuren. Beispiele sind Glutamat-Oxalacetat-Transaminase (GOT) (2) und Glutamat-Pyruvat-Transaminase (GPT). Coenzym ist Pyridoxalphosphat. Für nahezu alle anderen Aminogruppen, die im Stoffwechsel benötigt werden, ist Glutamin der Donor.
Glutaminsäure (Glutamat) im Blutbefund (Aminosäurenkonzentrationen)
Die Referenzbereiche (Normalwerte) für Glutaminsäure im Blutbefund sind in µmol/ml bei Säuglingen 20–107, bei Kindern 18–65 und bei Erwachsenen 28–92.[16] Als Therapie bei sehr hohen Glutaminsäurewerten (Glutamat) im Blutbefund, wie sie z. B. beim Chinarestaurant-Syndrom oder bei Ekzemen und/oder Histamin-Intoleranz vorkommen können, empfiehlt Reinhart Jarisch[17] eine Vitamin-B6-Gabe in der Größenordnung von 0,5 mg/kg Körpergewicht je Tag. Dies fördert auch die körpereigene Synthese von Diaminooxidase (DAO) und bekämpft so ursächlich die Auswirkungen der Histamin-Intoleranz.
Salze
Die verschiedenen Salze der Glutaminsäure sind als Lebensmittelzusatzstoffe bekannt. Es kommen verschiedene Salze der Glutaminsäure mit der Bezeichnung Geschmacksverstärker E 621 bis E 625 zum Einsatz.[7]
Weblinks
Einzelnachweise
- Eintrag zu E 620: Glutamic acid in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- Eintrag zu GLUTAMIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 11. August 2020.
- Eintrag zu Glutaminsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 21. Juni 2019. (JavaScript erforderlich)
- Hans-Dieter Jakubke und Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, 1982, ISBN 3-527-25892-2, S. 40.
- Eintrag zu Glutaminsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 9. Dezember 2014.
- Joint FAO/WHO Expert Committee on Food Additives (JECFA), Monograph für Glutamic acid and its salts, abgerufen am 9. Dezember 2014.
- ZZulV: Anlage 4 (zu § 5 Abs. 1 und § 7) Begrenzt zugelassene Zusatzstoffe.
- Nährstoffdatenbank des US-Landwirtschaftsministeriums, 21. Auflage.
- K. H. Ritthausen: Über die Glutaminsaure, Journal Prakt Chem, Band 99(6-7), S. 454ff (1866).
- Sabine Hansen: Die Entdeckung der proteinogenen Aminosäuren von 1805 in Paris bis 1935 in Illinois. (Memento vom 15. Juni 2016 im Internet Archive) Berlin 2015.
- W. Dittmar: Über die Reduction der Glutansäure durch Jodwasserstoff, Journal Prakt Chem, Band 5(7), S. 308ff (1872).
- L. Wolff: Über Glyoxylpropionsäure und einige Abkömmlinge derselben. Liebigs Annalen der Chemie, Band 260, S. 79ff (1890).
- P. M. Hardy: The Protein Amino Acids in G. C. Barrett (Herausgeber): Chemistry and Biochemistry of the Amino Acids, Chapman and Hall, 1985, ISBN 0-412-23410-6, S. 9.
- Izumi, Y. et al. (1979): Herstellung und Verwendung von Aminosäuren. In: Angewandte Chemie 90(3); 187–194; doi:10.1002/ange.19780900307.
- Chiaki Sano: History of glutamate production. In: The American Journal of Clinical Nutrition. 90, Nr. 3, September 2009, S. 728S-732S. doi:10.3945/ajcn.2009.27462F. PMID 19640955.
- Helmut Greiling, A. M. Gressner: Lehrbuch der klinischen Chemie und Pathobiochemie. Schattauer Verlagsgesellschaft, 1987, ISBN 3-7945-0949-8, 1197 Seiten.
- Reinhart Jarisch: Histaminintoleranz Histamin und Seekrankheit. 2. Auflage, Thieme Verlag, Stuttgart New York, 2004, ISBN 3-13-105382-8, S. 151.