Michael-Addition
Die Michael-Addition ist eine Namensreaktion in der organischen Chemie. Benannt wurde die Reaktion nach dem amerikanischen Chemiker Arthur Michael (1853–1942), der darüber zuerst 1887 veröffentlichte.[1][2] Sie wird oft zur Knüpfung von Kohlenstoff-Kohlenstoff-Einfachbindungen eingesetzt, ist aber nicht darauf beschränkt. Es lassen sich beispielsweise auch Kohlenstoff-Schwefel-, Kohlenstoff-Sauerstoff- oder Kohlenstoff-Stickstoff-Bindungen knüpfen.
Übersichtsreaktion
Es handelt sich um eine Addition an eine α,β-ungesättigte Carbonylverbindung (Michael-Akzeptor), z. B. in α,β-ungesättigten Aldehyden, Ketonen, Estern oder Carbonsäureamiden. An α,β-ungesättigten Nitrilen – z. B. Acrylnitril – kann ebenfalls eine Michael-Addition erfolgen.[3]
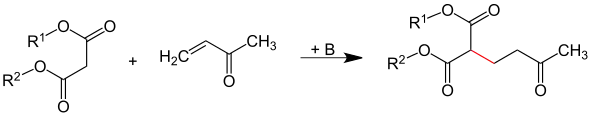
Das angreifende Agenz (Michael-Donator) muss nukleophil und nach dem HSAB-Konzept relativ weich sein. Geeignete Verbindungen, die addiert werden können, sind Carbanionen, d. h. durch Zugabe einer Base in α-Stellung deprotonierte Carbonylverbindungen. Im folgenden Beispiel ist die neu gebildete C-C-Bindung rot markiert:
Als Nucleophile können z. B. auch organische Kupferverbindungen, Amine, Thiole, Phenolat-Ionen oder Cyanid aus Blausäure verwendet werden.[3] Früher führte man die Michael-Addition ausschließlich in einem protischen Lösungsmittel (wie Alkohol) durch und setzte als Base die entsprechenden Alkoholate ein. Durch den Übergang zu aprotischem Lösungsmittel (Beispiel: wasserfreies THF) und sterisch gehinderter und nicht-nucleophiler Base (Beispiel: LDA) wurde das Anwendungsspektrum für die Michael-Addition deutlich erweitert.
Reaktionsmechanismus
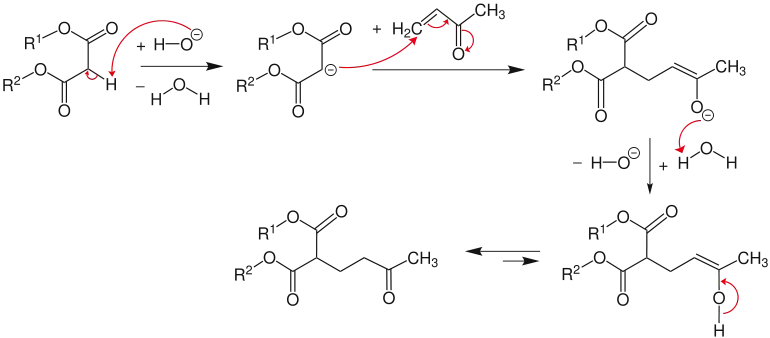
Im ersten Schritt wird der Michael-Donator (hier: ein Ester) durch eine Base (hier: Hydroxidion) deprotoniert und es entsteht dabei Wasser. Im weiteren Verlauf reagiert das entstandene Anion mit dem Michael-Akzeptor (hier: ein α,β-ungesättigtes Keton). Anschließend bildet sich dann durch Protonierung und Tautomerisierung das Michael-Addukt.[4]
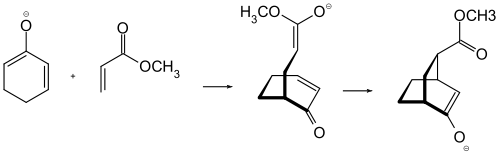
Im Falle von protischen Lösungsmitteln wird das als Primärprodukt erhaltene Enolation protoniert und eine Weiterreaktion gestoppt. Führt man jedoch die Michael-Addition in einem aprotischen Medium durch, so kann das Enolation zu weiteren Reaktionen führen. Dies kann man recht gut ausnutzen, indem man dem, bei der Michael-Reaktion entstehenden Enolation, einen weiteren und jetzt intramolekularen Michael-Akzeptor zur Verfügung stellt. Auf diese Weise ist z. B. durch die Umsetzung eines Dienolations von Cyclohexadien-Derivaten mit Acrylsäureestern die Darstellung eines komplexen Bicyclo[2.2.2]octan-Ringsystems leicht möglich. Strukturen dieses Typs sind als Ausgangsverbindung für die Synthese von komplexen Terpenen im Rahmen von Naturstoffsynthesen von Bedeutung.[5][6]
Die Michael-Addition ist eine wichtige Reaktion bei der Gruppentransfer-Polymerisation (GTP).
Enantioselektive Michael-Addition
Zahlreiche enantioselektive Ausführungsformen der Michael-Addition sind bekannt, dazu zählen u. a. folgende Reaktionen:[7]
- Addition von Ketonen oder Aldehyden an Nitroalkene oder Enone
- Addition von Malonestern an Nitroalkene oder Enone
- Addition von Diethylzink an Nitroalkene oder Enone
- Addition von N-Heterocyclen oder Aldehyden an Nitroalkene oder Enone
- Addition von α-Hydroxyketonen oder Aldehyden an Nitroalkene oder Enone
- Addition von Arylborsäuren
Technische Anwendung
Die Addition von Methylmercaptan (Methanthiol) an die Kohlenstoff-Kohlenstoff-Doppelbindung von Acrolein führt zu Methylmercaptopropionaldehyd (MMP), einem Zwischenprodukt für die ökonomisch bedeutende Produktion von DL-Methionin, dessen Hydroxyanalogon (Aminogruppe des Methionins durch Hydroxygruppe ersetzt) sowie deren Salzen (vor allem Natrium- und Calciumsalzen). Von diesem Futtermittelzusatzstoffen werden mehrere 100.000 t pro Jahr hergestellt.
Einzelnachweise
- Takashi Tokoroyama: Discovery of the Michael Reaction, European Journal of Organic Chemistry 2010, 10, 2009–2016 doi:10.1002/ejoc.200901130.
- Arthur Michael: Über die Addition von Natriumacetessig- und Natriummalonsäureäthern zu den Aethern ungesättigter Säuren, Journal für praktische Chemie, Band 35, 1887, S. 349–356.
- Axel Kleemann, Wolfgang Leuchtenberger, Jürgen Martens und Horst Weigel: Ein neuer Weg zu 4-Aminobuttersäureamid. In: Angewandte Chemie 1980, 92, 640 doi:10.1002/ange.19800920815; Angewandte Chemie – International Edition English 1980, 19, 627. doi:10.1002/anie.198006271
- Zerong Wang: Comprehensive Organic:Name Reactions and Reagents, Wiley Verlag, 2009, S. 1922–1925, ISBN 978-0-471-70450-8.
- Dietrich Spitzner, Anita Engler: Aprotic double Michael Addition: 1,3-Dimethyl-5-oxobicyclo[2.2.2]octane-2-carbolic acid In: Organic Syntheses. 66, 1988, S. 37, doi:10.15227/orgsyn.066.0037; Coll. Vol. 8, 1993, S. 219 (PDF).
- Dietrich Spitzner, Kai Oesterreich: In Anionically Induced Domino Reactions − Synthesis of a Norpatchoulenol-Type Terpene European Journal of Organic Chemistry, 2001, 10; 1883-1886 doi:10.1002/1099-0690(200105)2001:10<1883::AID-EJOC1883>3.0.CO;2-M
- Muniappan Thirumalaikumar: Enantioselective Michael Addition Reactions, Organic Preparations and Procedures International 2011, 43, 67–129 doi:10.1080/00304948.2011.547102.