Zwitterion
Ein Zwitterion (siehe auch Ion) ist ein Molekül mit zwei oder mehreren funktionellen Gruppen, von denen eine positiv und eine andere negativ geladen ist. Besitzt ein Zwitterion beispielsweise zwei funktionelle Gruppen mit entgegengesetzten Ladungen, so ist das Molekül (am isoelektrischen Punkt) insgesamt elektrisch neutral.[1] Teilweise wird auch der Begriff „inneres Salz“ für ein Zwitterion verwendet.
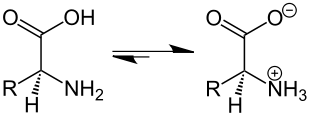
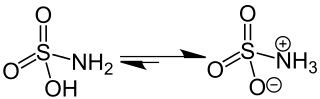
Meist handelt es sich bei den Gruppen um eine Säure- und eine Basenfunktion. Das bekannteste Beispiel sind Aminosäuren,[2] die sowohl in wässriger Lösung als auch in der festen Phase zwitterionisch vorliegen. Die Hydroxygruppe gibt ein Wasserstoffion ab und trägt eine negative Ladung, die Aminogruppe nimmt ein Wasserstoffion auf und trägt eine positive Ladung. Im Unterschied zu Betainen lassen sich die Ladungen also durch Protonenwanderung ausgleichen.
In Lösung sind bei einem bestimmten pH-Wert, dem isoelektrischen Punkt, gleich viele Carboxygruppen, zu (negativ geladen) Carboxylatgruppen deprotoniert wie Aminogruppen zu (positiv geladenen) Amoniumgruppen protoniert worden sind, positiv.[3] Dann wandern Aminosäuren im elektrischen Feld nicht mehr, sondern richten sich nur aus, da die Summenladung neutral ist. Liegt der pH-Wert unter dem isoelektrischen Punkt, nimmt die Dissoziation der Carboxygruppe ab, und die Aminosäure trägt eine positive Summenladung. Liegt der pH-Wert darüber, nimmt die Dissoziation der Carboxygruppe zu, und das Molekül trägt eine negative Summenladung. Diesen Effekt nutzt man bei der Elektrophorese und bei der isoelektrischen Fokussierung. Am isoelektrischen Punkt ist die Wasserlöslichkeit von Aminosäuren am geringsten, da aufgrund der entstandenen intramolekularen Ladungen keine stabile Hydrathülle mehr gebildet werden kann.
Bei Peptiden und Proteinen sind die Verhältnisse analog zu denen bei den Aminosäuren. Von einer Carboxygruppe des Peptids oder Proteins wandert ein Proton zu einer basischen Aminogruppe, die am N-terminalen Ende stehen kann, aber nicht zwingend stehen muss.
Berechnung des isoelektrischen Punktes
Der pH-Wert am isoelektrischen Punkt lässt sich (bei nicht allzu starker Verdünnung) aus den pKs-Werten der Säuregruppe und der Aminogruppe berechnen:
Herleitung:
Die Säurekonstanten sind definiert als:
Durch Multiplizieren dieser zwei Gleichungen wird die Konzentration des Zwitterions eliminiert:
Da am isoelektrischen Punkt die Konzentrationen von Anion und Kation gleich sind, vereinfacht sich die Gleichung zu:
Wurzelziehen und Logarithmieren ergibt dann:
Mehrprotonensysteme
Bei sauren (z. B. Asparaginsäure, Glutaminsäure) oder basischen Aminosäuren (z. B. Lysin, Arginin) werden zur Berechnung des isoelektrischen Punkts die pKs-Werte der beiden Carboxy- bzw. Aminogruppen berücksichtigt. Zur Berechnung des IEP bei Aminosäuren mit mehr als zwei pK-Werten werden lediglich die pK-Werte der ähnlich ionisierenden Gruppen herangezogen. Das bedeutet, dass im Falle von basischen Aminosäuren die beiden proximalen pK-Werte oberhalb des isoelektrischen Punkts und bei sauren Aminosäuren die beiden proximalen pK-Werte unterhalb des isoelektrischen Punkts in die obengenannte Gleichung eingesetzt werden[4] und vereinfachend der Mittelwert gebildet wird,[5] z. B. für Lysin (8,95 + 10,53)/2 = 9,74[6] und für Asparaginsäure (2,09 + 3,86)/2 = 2,98.[7]
Lecithine
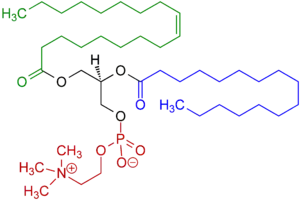
Lecithine sind Phospholipide, die sich aus Fettsäuren, Glycerin, Phosphorsäure und Cholin ableiten. Sie sind Bestandteile der Zellmembran tierischer und pflanzlicher Lebewesen, erlauben das Emulgieren (Vermischen) von Fetten und Wasser und sind somit wichtige natürliche Tenside (Emulgatoren) für Nahrungs- und Futtermittel sowie in der Pharmaindustrie. Dabei sind zwei Hydroxygruppen des Glycerins mit Fettsäuren verestert. Die dritte OH-Gruppe des Glycerins bildet mit einer Phosphatgruppe einen Ester. Die Phosphatgruppe ist weiter mit der OH-Gruppe des Cholins verestert und bildet damit einen Diester. Cholin ist eine quartäre Ammoniumverbindung, trägt also eine positive Ladung und ist ein Kation. Die Phosphatgruppe liegt über einen breiten pH-Bereich als Anion vor, trägt also eine negative Ladung. Somit kann man Lecithine als Zwitterionen bzw. innere Salze auffassen.
Siehe auch
Einzelnachweise
- Eintrag zu zwitterionic compounds/zwitterions. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.Z06752 – Version: 2.1.5.
- Olaf Kühl: Organische Chemie. Wiley-VCH, Weinheim, 2012, S. 242, ISBN 978-3-527-33199-4.
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Verlag Helvetica Chimica Acta, Zürich, 2006, S. 371, ISBN 978-3-906390-29-1.
- Reinhard Kuhn: Capillary Electrophoresis: Principles and Practice. Springer Science & Business Media, 2013, ISBN 978-3-642-78058-5, S. 79.
- Cherng-ju Kim: Advanced Pharmaceutics. CRC Press, 2004, ISBN 978-0-203-49291-8, S. 86–99.
- W. T. Godbey: An Introduction to Biotechnology. Elsevier, 2014, ISBN 978-1-908818-48-5, S. 15.
- Raymond Chang: Physical Chemistry for the Biosciences. University Science Books, 2005, ISBN 978-1-891389-33-7, S. 291.