Nalidixinsäure
Nalidixinsäure ist eine synthetisch hergestellte chemische Verbindung aus der Gruppe der Diazanaphthaline, die starke strukturelle Ähnlichkeit zu Chinolonen aufweisen. Durch ihre Wirkung als Gyrasehemmer war sie 1962 das erste als Antibiotikum eingesetzte Verbindung dieser Klasse.[1]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
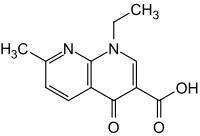 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Nalidixinsäure | |||||||||||||||||||||
| Andere Namen |
1-Ethyl-7-methyl-4-oxo-1,4-dihydro-1,8-naphthyridin-3-carbonsäure (IUPAC) | |||||||||||||||||||||
| Summenformel | C12H12N2O3 | |||||||||||||||||||||
| Kurzbeschreibung |
weiße bis schwach gelbe, monokline Kristalle[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
J01MB02 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 232,24 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt |
229,5 °C[2] | |||||||||||||||||||||
| pKS-Wert |
6,0[1] | |||||||||||||||||||||
| Löslichkeit |
gering in Wasser (100 mg·l−1 bei 23 °C[2]) | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Gewinnung und Darstellung
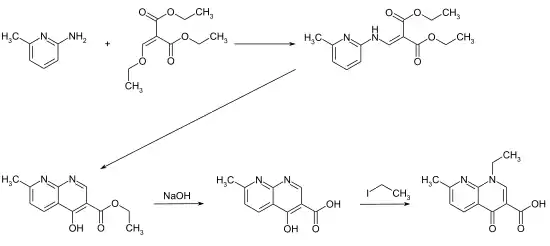
Die vierstufige Synthese startet im ersten Schritt mit der Umsetzung von 2-Amino-6-methylpyridin mit Ethoxymethylenmalonsäurediethylester. Das resultierende Zwischenprodukt wird dann zur 1,8-Naphthyridinstruktur zyklisiert. Nach der Verseifung der Ethylestergruppe mit Natronlauge wird die Zielverbindung durch eine N-Alkylierung mittels Ethyliodid erhalten.[5][6][4]
Wirkung
Der Wirkstoff hemmt das Enzym Gyrase in Bakterien. Nalidixinsäure wurde 1962 als hauptsächlich gegen Gram-negative Bakterien wirksames Antibiotikum mit niedriger Toxizität entdeckt (LD50 bei oraler Gabe in Mäusen von ca. 3 g·kg−1).[5] Von Nalidixinsäure ausgehend wurde nach ähnlichen, aber wirksameren Antibiotika gesucht. Im Folgenden wurde es durch die wesentlich wirksameren Fluorchinolone verdrängt. Nalidixinsäure ist gegen Gram-positive und Gram-negative Bakterien wirksam. In geringer Konzentration wirkt es bakteriostatisch, das heißt, es verhindert die Vermehrung von Bakterien, während es in höheren Konzentrationen bakterizid wirkt und diese abtötet.[7]
Verwendung
Eingesetzt wird es hauptsächlich, um Infektionen der Harnwege zu behandeln, die von Escherichia coli, Proteus, Shigellen, Enterobacter oder Klebsiella verursacht werden. Der Wirkstoff befindet sich aufgrund von raschen Resistenzentwicklungen und einem engen Wirkungsspektrum in Europa nicht mehr im Handel. Eine bessere Alternative der Chinoloncarbonsäuren der ersten Generation stellt die Pipemidsäure dar, welche durch einen 7-Piperazinyl-Substituenten auch gegen gramnegative Erreger wirksam ist.[8]
Handelsnamen
- Wintomylon (Brasilien)
Weblinks
- MedlinePlus: Nalidixic Acid
- HealthDigest.org: Nalidixic acid
Einzelnachweise
- Eintrag zu Nalidixinsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 11. November 2017.
- Eintrag zu Nalidixic acid in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 10. November 2017.
- Datenblatt Nalidixic acid bei Sigma-Aldrich, abgerufen am 14. Mai 2017 (PDF).
- A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances – Synthesis, Patents, Applications, 4. Auflage (2000), Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9.
- G. Y. Lesher, E. J. Froehlich, M. D. Gruett, J. H. Bailey, P. R. Brundage: 1,8-Naphthyridine Derivatives. A New Class of Chemotherapeutic Agents in J. Med. Chem. 5 (1962) 1063–1065, doi:10.1021/jm01240a021.
- Patent US 3 149 104 (Sterling Drug, 15. September 1964).
- R. K. Hamatake, R. Mukai, M. Hayashi: Role of DNA gyrase subunits in synthesis of bacteriophage phi X174 viral DNA März 1981; PMID 6262812; PMC 319165 (freier Volltext).
- Schubert-Zsilavecz, Manfred., Roth, Hermann J.: Medizinische Chemie : Targets – Arzneistoffe – chemische Biologie ; 191 Tabellen. 2., völlig neu bearb. und erw. Auflage. Dt. Apotheker-Verl, Stuttgart 2010, ISBN 978-3-7692-5002-2.