Glutamin
Glutamin ist eine proteinogene, für den Menschen nicht essentielle α-Aminosäure und stellt das γ-Mono-Amid der L-Glutaminsäure dar. Im Dreibuchstabencode wird sie als Gln und im Einbuchstabencode als Q bezeichnet. Im Stoffwechsel ist L-Glutamin ein universeller Aminogruppen-Donor. Im Blutplasma kommt Glutamin mit einem Mengenanteil von 20 % als Hauptbestandteil des Pools an freien Aminosäuren vor. Bei hyperkatabolen und hypermetabolen Krankheitszuständen wie z. B. nach Operationen, schweren Verletzungen, Verbrennungen und Infektionen ist stets eine ausgeprägte Glutaminverarmung zu beobachten. Glutamin wird durch ein Basentriplett CAG oder CAA der mRNA codiert.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
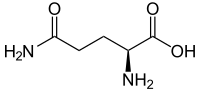 | ||||||||||||||||||||||
| Struktur von L-Glutamin, dem natürlich vorkommenden Enantiomer | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Glutamin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C5H10N2O3 | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff [2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 146,15 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Enantiomere
Glutamin besitzt ein Stereozentrum, somit existieren zwei chirale Enantiomere. In den Proteinen kommt, neben anderen Aminosäuren, ausschließlich L-Glutamin [Synonym: (S)-Glutamin] peptidisch gebunden vor. Spiegelbildlich aufgebaut dazu ist das D-Glutamin [Synonym: (R)-Glutamin], das in Proteinen nicht vorkommt. Racemisches DL-Glutamin [Synonyme: (RS)-Glutamin und (±)-Glutamin] besitzt geringe Bedeutung.
Wenn in diesem Text oder in der wissenschaftlichen Literatur „Glutamin“ ohne weiteren Namenszusatz (Deskriptor) erwähnt wird, ist L-Glutamin gemeint.
| Enantiomere von Glutamin | ||
| Name | L-Glutamin | D-Glutamin |
| Andere Namen | (S)-Glutamin | (R)-Glutamin |
| Strukturformel |  | 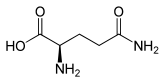 |
| CAS-Nummer | 56-85-9 | 5959-95-5 |
| 6899-04-3 (unspez.) | ||
| EG-Nummer | 200-292-1 | 673-968-0 |
| 230-006-0 (unspez.) | ||
| ECHA-Infocard | 100.000.266 | 100.199.389 |
| 100.027.278 (unspez.) | ||
| PubChem | 5961 | 145815 |
| 738 (unspez.) | ||
| DrugBank | DB00130 | DB02174 |
| − (Racemat) | ||
| FL-Nummer | 17.007 | - |
| Wikidata | Q181619 | Q27102193 |
| Q27103623 (unspez.) | ||
Vorkommen
Glutamin kommt zu durchschnittlich 3,9 % – gebunden in Proteinen – vor; auch in freier Form findet sich die Aminosäure häufig in allen Pflanzen, Tieren, Pilzen und Bakterien als zentraler Metabolit im Stoffwechsel aller Lebewesen.[4]
Nahrungsmittel mit hohem Glutamingehalt sind
| Lebensmittel | Glutamin [mg/100g][5] |
|---|---|
| Weizen | 4080 |
| Dinkelmehl | 5170 |
| Linsen | 4490 |
| Mungbohne | 4810 |
| Sojabohnen | 6490 |
| Erdnüsse | 5630 |
| Käse | 3050–8100 |
| Rindfleisch | 4130 |
| Hammelfleisch | 4300 |
| Schweinefleisch | 3910 |
Alle diese Nahrungsmittel enthalten praktisch ausschließlich chemisch gebundenes L-Glutamin als Proteinbestandteil, jedoch kein freies L-Glutamin.
Geschichte
L-Glutamin wurde 1877 erstmals beschrieben. Gemeinsam mit einem seiner Doktoranden kam Ernst Schulze zu der Schlussfolgerung, dass in den Runkelrüben die Glutaminsäure als Amid vorliegt, welches sie Glutamin nannten (analog zu Asparagin und Asparaginsäure). Kurz darauf untersuchte Ernst Schulze diese Zusammenhänge in Kürbiskeimlingen und kam zu demselben Ergebnis. Die Strukturaufklärung für Glutaminsäure / Glutamin war bereits 1872 durch den deutschen Chemiker Wilhelm Dittmar erfolgt. Dittmar war zu dieser Zeit an der agrikulturchemischen Versuchsanstalt in Bonn-Poppelsdorf unter Heinrich Ritthausen tätig, der bereits 1866 die Glutaminsäure entdeckt hatte.[6]
Eigenschaften
Das farblose, kristalline Glutamin ist unlöslich in Alkoholen, Benzol und Chloroform. Mäßig löslich ist es hingegen in Wasser (100 g/l bei 40 °C).
- Van-der-Waals-Volumen: 114
- Lipidlöslichkeit: LogP = −3,5
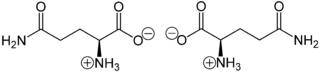
Glutamin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe an das freie Elektronenpaar des Stickstoffatoms der Aminogruppe wandert.
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert) der Fall, bei dem das Zwitterion auch seine geringste Löslichkeit in Wasser hat. Sein isoelektrischer Punkt liegt bei 5,65.[7]
Herstellung
Großtechnisch wird L-Glutamin fermentativ hergestellt.[8]
Biochemie
Für die Biosynthese inklusive Strukturformeln siehe Abschnitt Weblinks.
L-Glutamin wird aus der L-Glutaminsäure durch die Glutamin-Synthetase hergestellt. Dabei wird Adenosintriphosphat (ATP) verbraucht. Im Körper kann L-Glutamin zu Succinat in drei Reaktionsschritten abgebaut werden.
Funktionen
Mit einem Mengenanteil von 20 % ist Glutamin Hauptbestandteil des Pools an freien Aminosäuren im Blutplasma (400–600 µmol/l).[9] Glutamin kommt in der höchsten Konzentration in den Muskelzellen (ca. 35 mmol/l) vor, die dieses auch hauptsächlich synthetisieren. Es ist unter anderem für die Wassereinlagerung in die Zelle verantwortlich und bewirkt bei körperlicher Belastung eine Vergrößerung des Zellvolumens, was als anaboles, die Proliferation unterstützendes Signal zu betrachten ist. Das heißt, die Protein- und Glykogenbildung wird gefördert.
Hyperkatabole und hypermetabole Krankheitszustände gehen mit einer deutlichen Glutaminverarmung im Blut und in der Muskulatur einher, ohne dass reaktiv die Glutaminsynthese gesteigert wird. Charakteristisch für die Reaktion auf ein Trauma oder eine Infektion ist die Reduktion freien Glutamins in der Muskulatur um etwa 50 %. Dieser Verlust intrazellulären Glutamins wurde sowohl nach selektiven Operationen, Polytraumen und Verbrennungen als auch bei Infektionen und Pankreatitis unabhängig von der Ernährung festgestellt. Glutamin stellt nicht nur einen Baustein für die Proteinsynthese, sondern u. a. auch für die Zellen des Gastrointestinaltraktes (Enterozyten, Kolonozyten) und für Leberzellen ein wichtiges Substrat dar. Daraus wurde die These entwickelt, dass Glutamin eine bedingt essentielle Aminosäure sei, die besonders bei schweren Erkrankungen notwendig ist. Entsprechend entstand die Hypothese, dass eine Glutamin-Supplementierung bei schwerkranken Patienten zu einem besseren Ergebnis führen würde.
Hingegen zeigte eine internationale multizentrische randomisierte Doppelblindstudie an über 1200 schwerkranken mechanisch beatmeten Intensivpatienten mit Multiorganversagen, die in der Verumgruppe sowohl enteral als auch parenteral Glutamin erhielten, eine signifikant erhöhte Mortalität von 32,4 % (Placebo 27,2 %) mit einem adjustierten Risikofaktor von 1,09 nach 28 Tagen. Auch nach sechs Monaten war die Mortalität unter Glutaminbehandlung signifikant höher, jedoch hatte Glutamin keinen Einfluss auf das Organversagen oder die Infektionsrate.[10] Somit erscheint eine Glutamin-Substitution in der Intensivmedizin obsolet, und in einem Kommentar wird sogar von einer „Glutamintoxizität“ gesprochen. Der verminderte Glutaminspiegel bei schwerkranken Patienten könnte somit weniger eine Folge eines Mangels als vielmehr ein positiver Adaptationsmechanismus sein.[11]
Funktion im Nervensystem
Glutamin ist chemisch eng verwandt mit der exzitatorischen Aminosäure Glutaminsäure (häufig wird nur von der ionisierten Form, dem Glutamat, gesprochen), die als Neurotransmitter bei glutamatergen Synapsen im zentralen Nervensystem vorkommt. An diesen Synapsen wird ein Teil des Glutamats nach der Ausschüttung in den synaptischen Spalt in benachbarte Gliazellen aufgenommen. Um das aufgenommene Glutamat zurück in die präsynaptischen Neuronen zu transportieren, wird es in den Gliazellen in Glutamin umgewandelt, da Glutamin keine exzitatorische Auswirkung auf die postsynaptische Membran aufweist. In den Neuronen wird Glutamin dann wieder in Glutamat umgewandelt.
Funktion in der Zellkultur von Tumorzellen
Für die Zellkultur vieler Tumorzellen ist Glutamin in hohem Überschuss notwendig. Wie bereits oben erwähnt hat das menschliche Blut eine Konzentration von 500 bis 900 µmol/l Glutamin, in der Zellkultur wird allerdings meist mit 2000–4000 µmol/l gearbeitet. Das liegt daran, dass viele Arten von Tumorzellen wesentlich mehr Glutamin aufnehmen und verstoffwechseln als normale Körperzellen.[12] Über die Gründe wird in der wissenschaftlichen Literatur zurzeit viel diskutiert. Als eine mögliche Ursache für die erhöhte Glutaminaufnahme und -abhängigkeit von Tumoren wird von verschiedenen Autoren die erhöhte Expression des Onkogens myc vorgeschlagen.[13][14] Aufgrund dieser Abhängigkeit werden und wurden verschiedene Glutaminanaloga wie DON, Azaserin oder Acivicin zur Behandlung verschiedener solider Tumoren getestet.
Polyglutamin
Eine Reihe wichtiger Proteine beinhalten Polyglutamin-Einheiten, das heißt längere, sich wiederholende Glutamin-Glutamin-Verknüpfungen. Beispiel dafür sind das FOXP2-Protein oder das die Chorea Huntington auslösende Huntingtin. Im Huntingtin bewirkt eine durch eine autosomal-dominante Mutation bedingte Verlängerung der Polyglutamin-Einheit das Ausbrechen der Krankheit.[15][16]
Weblinks
Einzelnachweise
- Eintrag zu GLUTAMINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- Datenblatt S-(+)-Glutamin (PDF) bei Merck, abgerufen am 15. Februar 2013.
- CRC Handbook of Chemistry and Physics, Ed. D.R. Lide, 85th Ed., CRC Press, Boca Raton, FL, 2005.
- Eintrag zu L-Glutamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Oktober 2013.
- Glutamingehalt von Lebensmitteln. DocMedicus, Deutsche Gesellschaft für Nährstoffmedizin und Prävention, abgerufen am 13. Oktober 2013.
- S. Hansen: Entdeckung der Aminosäuren (Memento vom 15. Juni 2016 im Internet Archive), Berlin 2015.
- P. M. Hardy: The Protein Amino Acids. In: G. C. Barrett (Herausgeber): Chemistry and Biochemistry of the Amino Acids. Chapman and Hall, 1985, ISBN 0-412-23410-6, S. 9.
- Yoshiharu Izumi, Ichiro Chibata und Tamio Itoh: Herstellung und Verwendung von Aminosäuren. In: Angewandte Chemie 90 (1978) 187-194; Angewandte Chemie International Edition in English 17, 176–183, doi:10.1002/anie.197801761.
- P. B. Soeters, I. Grecu: Have we enough glutamine and how does it work? A clinician's view. In: Annals of nutrition & metabolism. Band 60, Nummer 1, 2012, S. 17–26, doi:10.1159/000334880, PMID 22212454 (Review). (freier Volltext).
- Daren Heyland, John Muscedere u. a.: A Randomized Trial of Glutamine and Antioxidants in Critically Ill Patients. In: New England Journal of Medicine. 368, 2013, S. 1489–1497, doi:10.1056/NEJMoa1212722.
- Greet Van den Berghe: Low Glutamine Levels during Critical Illness – Adaptive or Maladaptive? In: New England Journal of Medicine. 368, 2013, S. 1549–1550, doi:10.1056/NEJMe1302301.
- B. C. Fuchs, B. P. Bode: Amino acid transporters ASCT2 and LAT1 in cancer: partners in crime? In: Seminars in Cancer Biology. Band 15, Nummer 4, August 2005, S. 254–266, doi:10.1016/j.semcancer.2005.04.005, PMID 15916903.
- M. Yuneva, N. Zamboni u. a.: Deficiency in glutamine but not glucose induces MYC-dependent apoptosis in human cells. In: Journal of Cell Biology. Band 178, Nummer 1, Juli 2007, S. 93–105, doi:10.1083/jcb.200703099. PMID 17606868. PMC 2064426 (freier Volltext).
- D. R. Wise, R. J. DeBerardinis u. a.: Myc regulates a transcriptional program that stimulates mitochondrial glutaminolysis and leads to glutamine addiction. In: Proceedings of the National Academy of Sciences. Band 105, Nummer 48, Dezember 2008, S. 18782–18787, doi:10.1073/pnas.0810199105. PMID 19033189. PMC 2596212 (freier Volltext).
- J. Rutishauser: Morbus Huntington: disrupt the fatal attraction. (PDF; 163 kB) In: Schweiz Med Forum, 24/2002, S. 586–587.
- E. Cattaneo u. a: Das Rätsel der Chorea Huntington. In: Spektrum der Wissenschaft, JANUAR 2004, S. 60–66.