Glycin
Glycin, abgekürzt Gly oder G, (auch Glyzin oder Glykokoll, von altgr. κόλλα kólla: Leim, nach systematischer chemischer Nomenklatur Aminoessigsäure oder Aminoethansäure), ist die kleinste und einfachste 'α-Aminosäure und wurde erstmals 1820 aus Gelatine, d. h. aus Kollagenhydrolysat, gewonnen. Es gehört zur Gruppe der hydrophilen Aminosäuren und ist als einzige proteinogene (oder eiweißbildende) Aminosäure achiral und damit nicht optisch aktiv.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
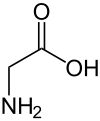 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Glycin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C2H5NO2 | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser, kristalliner Feststoff[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
B05CX03 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 75,07 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,161 g·cm−3 [3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert | ||||||||||||||||||||||
| Löslichkeit |
gut löslich in Wasser[6] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−528,5 kJ/mol[7] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Glycin ist nicht essentiell, kann also vom menschlichen Organismus selbst synthetisiert werden und ist wichtiger Bestandteil nahezu aller Proteine und ein wichtiger Knotenpunkt im Stoffwechsel.
Der Name leitet sich vom süßen Geschmack reinen Glycins her (griechisch γλυκύς glykýs, deutsch ‚süß‘).
Geschichte
Glycin ist die erste Aminosäure, die durch einen sauren Aufschluss von Eiweißen gewonnen wurde. Dies gelang Henri Braconnot 1819 in Nancy, der Leim mit Schwefelsäure hydrolysierte, mit dem Ziel, aus tierischem Material Zucker zu extrahieren.

Die nach Aufreinigung gewonnenen süß schmeckenden Kristalle nannte er daher sucre de gélatine, zu deutsch „Leimzucker“.[8] Gelatine ist der Hauptbestandteil von Glutinleim.
Bald darauf wurde die Substanz umbenannt in Glykokoll („süßer Leim“), ehe Jöns Jakob Berzelius 1848 entschied, dass er von nun an den kürzeren Namen Glycin anwenden werde. Die chemische Struktur wurde erst 1858 durch den französischen Chemiker Auguste André Thomas Cahours richtig beschrieben.[9]
Synthese
Das bei der Reaktion von Formaldehyd, Cyanwasserstoff und Ammoniak (Strecker-Synthese) entstehende Aminonitril (genauer: α-Aminoacetonitril) liefert bei der Hydrolyse Glycin:
Diese Reaktion spielte als Teilreaktion eine besondere Rolle in der Hypothese, dass organische Moleküle als „Bausteine“ für die ersten primitiven Organismen vor ca. 4 Mrd. Jahren aus den einfachen anorganischen Verbindungen der Uratmosphäre der Erde entstanden waren. Für diese Uratmosphäre wurde eine Zusammensetzung aus Wasser (H2O), Methan (CH4), Ammoniak (NH3), Wasserstoff (H2) und Kohlenstoffmonoxid (CO) sowie Helium (He) und anderen Edelgasen angenommen (vgl. → Miller-Urey-Experiment).
Chemisch kann Glycin auch aus Monochloressigsäure und Ammoniak hergestellt werden:
Im Körper wird das meiste Glycin mit der Nahrung aufgenommen, es kann aber auch aus Serin hergestellt werden.
Eigenschaften
Glycin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der sauren Carboxygruppe an das einsame Elektronenpaar des Stickstoffatoms der basischen Aminogruppe wandert:

Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert, hier 5,97[10]) der Fall, bei dem das Glycin auch seine geringste Löslichkeit in Wasser hat.
- Van-der-Waals-Volumen: 48
- Hydrophobizitätsgrad: −0,4
Freies Glycin hat einen süßen Geschmack, wobei der Erkennungsschwellenwert bei 25 bis 35 mmol/L liegt.[11]
Vorkommen
Die folgenden Beispiele geben einen Überblick über Glycingehalte und beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil von Glycin, bezogen auf das Gesamtprotein, angegeben:[12]
| Lebensmittel | Gesamt- protein | Glycin | Anteil |
|---|---|---|---|
| Schweinefleisch, roh | 21 g | 0,95 g | 4,5 % |
| Hähnchenbrustfilet, roh | 21 g | 0,95 g | 4,4 % |
| Lachs, roh | 20,5 g | 0,95 g | 4,7 % |
| Gelatinepulver, ungesüßt | 86 g | 19 g | 22,3 % |
| Hühnerei | 12,5 g | 0,43 g | 3,4 % |
| Kuhmilch, 3,7 % Fett | 3,3 g | 0,07 g | 2,1 % |
| Walnüsse | 15 g | 0,82 g | 5,4 % |
| Kürbiskerne | 30 g | 1,85 g | 6,1 % |
| Weizen-Vollkornmehl | 14 g | 0,55 g | 4,0 % |
| Mais-Vollkornmehl | 7,0 g | 0,28 g | 4,1 % |
| Reis, ungeschält | 8,0 g | 0,39 g | 4,9 % |
| Sojabohnen, getrocknet | 36,5 g | 1,9 g | 5,2 % |
| Erbsen, getrocknet | 24,5 g | 1,1 g | 4,4 % |
Alle diese Nahrungsmittel enthalten praktisch ausschließlich chemisch gebundenes Glycin als Proteinbestandteil, jedoch kein freies Glycin.
Glycin wurde 2009 erstmals in Partikelproben aus der Koma eines Kometen nachgewiesen, gesammelt mit der Raumsonde Stardust 2004 in der Nähe von 81P/Wild 2.[14][15] 2016 gelang der Nachweis auch im Schweif des Kometen 67P/Tschurjumow-Gerassimenko.[16]
Funktionen
Stoffwechsel
Die Umsetzung von Serin zu Glycin dient neben der Erzeugung von Glycin auch der Umsetzung von Tetrahydrofolsäure zu N5-N10-Methylen-Tetrahydrofolsäure (TH4), die unter anderem für die Synthese von Thymin-Nukleotiden (DNA-Bestandteil) benötigt wird.
Umgekehrt kann Glycin unter Aufnahme von CH3 aus TH4 zur Synthese von Serin dienen, welches dann für die Proteinsynthese, als Grundsubstanz des Cholins oder als Pyruvat zur Verfügung steht.
Auch für die Synthese anderer Bestandteile der Erbsubstanz (Purine) wird Glycin häufig benötigt.
Es dient ebenfalls der Biosynthese von Häm (Sauerstoff-Bindung im Blut), Kreatin (Energiespeicher im Muskel) oder Glutathion:
- Glycin + Succinyl-CoA → 5-Aminolävulinsäure → Porphyrinsynthese zum Aufbau des Häm.
- Glycin + Guanodingruppe (aus Arginin) → Guanidinoacetat, welches dann in die Kreatininsynthese eingehen kann.
- Glycin + Glu-Cys-Peptidbindung → Glutathionsäure
Als Nebenprodukt kann aus Glycin auch gesundheitsschädliche Oxalsäure gebildet werden.
Als sog. glucogene oder glucoplastische Aminosäure kann Glycin im Rahmen des Stoffwechsels über Pyruvat zu Glucose umgesetzt werden.
Proteinbestandteil
Aufgrund seiner geringen Größe wird Glycin bevorzugt in Polypeptide an räumlich beengten Positionen (der Protein-Sekundärstruktur) eingebaut.
Besonders häufig kommt es im Kollagen, dem häufigsten Protein in tierischen Organismen, vor. Hier macht es gut ein Drittel aller Aminosäuren aus, da es aufgrund seiner geringen Größe das Aufwickeln des Kollagens zu dessen Tripelhelix-Struktur erlaubt.
Nervensystem
Glycin wirkt im Zentralnervensystem über den Glycinrezeptor als inhibitorischer Neurotransmitter, also als hemmender Signalstoff. Die Wirkung erfolgt über die Öffnung von ligandengesteuerten Chlorid-Kanälen und führt so zu einem inhibitorischen postsynaptischen Potential (IPSP), was die Aktivität der nachgeschalteten Nervenzelle herabsetzt.
Am NMDA-Rezeptor hingegen wirkt es neben dem hauptsächlichen Agonisten Glutamat an einer speziellen Glycin-Bindungsstelle stimulierend.
Glycin freisetzende Nervenzellen (glycinerge Neurone) kommen vor allem im Hirnstamm und im Rückenmark[17] vor, in letzterem hemmen sie die Aktivität der Motoneuronen des Vorderhorns, wodurch es zu einer Herabsetzung der Aktivität der von diesen Zellen innervierten Muskeln kommt.
Eine Herabsetzung der Glycinwirkung bewirken Strychnin, das als Antagonist die Bindungsstelle des Glycinrezeptors blockiert, und das Tetanustoxin, das die Ausschüttung von Glycin hemmt. Durch die Blockade der Glycinrezeptoren oder einen verminderten Glycinspiegel wird die Hemmung der Motoneuronenaktivität vermindert, sodass es zu lebensbedrohlichen Krämpfen kommen kann.
Durch abnormale Ansammlung von Glycin kann es zur Glycin-Enzephalopathie kommen.
Verwendung
Als Geschmacksverstärker wird Glycin Lebensmitteln zugesetzt.
Glycin sowie sein Natriumsalz sind in der EU als Lebensmittelzusatzstoff der Nummer E 640 ohne Höchstmengenbeschränkung für Lebensmittel allgemein zugelassen, negative gesundheitliche Auswirkungen sind nicht bekannt.
Weiterhin ist Glycin ein Bestandteil von Infusionslösungen zur parenteralen Ernährung.[18]
Bei der monopolaren transurethralen Resektion kann Glycin neben einem Gemisch aus Mannitol und Sorbitol als Zusatz zur Spülflüssigkeit eingesetzt werden.[19]
In der molekularbiologischen bzw. biochemischen Forschung wird Glycin in Form eines TRIS-Glycin-Puffersystems bei der Proteinauftrennung mittels SDS-PAGE verwendet; die Glycin-Ionen fungieren dabei als Folgeionen im Sammelgel.[20]
Literatur
- G. Löffler, P. E. Petrides: Biochemie und Pathobiochemie. 7. Auflage. Springer Verlag, 2003, ISBN 3-540-42295-1.
Weblinks
Einzelnachweise
- Eintrag zu GLYCINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 8. Juli 2020.
- Eintrag zu E 640: Glycine and its sodium salt in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 11. August 2020.
- Eintrag zu Glycin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 17. Dezember 2019. (JavaScript erforderlich)
- F. A. Carey: Organic Chemistry. 5. Auflage The McGraw Companies, 2001, S. 1059, Link
- Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, S. 38–43, 1982, ISBN 3-527-25892-2.
- Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. 1. Student Edition. CRC Press, Boca Raton, Florida 1988, ISBN 0-8493-0740-6, S. C-706.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-22.
- H. Braconnot, Sur la Conversion des matières animales en nouvelles substances par le moyen de l`acide sulfurique., Ann. Chim. Phys., Band 10, S. 29ff (1819).
- S. Hansen: Die Entdeckung der proteinogenen Aminosäuren von 1805 in Paris bis 1935 in Illinois. (Memento vom 15. Juni 2016 im Internet Archive) Berlin 2015.
- P. M. Hardy: The Protein Amino Acids. In: G. C. Barrett (Hrsg.): Chemistry and Biochemistry of the Amino Acids. Chapman and Hall, 1985, ISBN 0-412-23410-6, S. 9.
- W. Ternes, A. Täufel, L. Tunger, M. Zobel (Hrsg.): Lebensmittel-Lexikon. 4. Auflage. Behr’s Verlag, Hamburg 2005, ISBN 3-89947-165-2, S. 62f.
- Nährstoffdatenbank des US-Landwirtschaftsministeriums, 22. Ausgabe.
- Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, S. 19, 1982, ISBN 3-527-25892-2.
- NASA Researchers Make First Discovery of Life's Building Block in Comet nasa.gov, August 2009; Lebensbausteine aus dem All spektrum.de, August 2009 (abgerufen am 4. Oktober 2010).
- Jamie E. Elsila, et al.: Cometary glycine detected in samples returned by Stardust. Meteoritics & Planetary Science 44, Nr. 9, 1323–1330 (2009), pdf online@gsfc.nasa.gov, abgerufen am 23. November 2011.
- Wolfgang Stieler: Aminosäure in Kometen gefunden. Heise.de, Technology Review, 27. Mai 2016.
- Georg Löffler, Petro E. Petrides, Peter C. Heinrich: Biochemie & Pathobiochemie. Springer Medizin Verlag, Heidelberg 2006, ISBN 3-540-32680-4, S. 1040.
- S. Ebel, H. J. Roth (Hrsg.): Lexikon der Pharmazie. Georg Thieme Verlag, 1987, ISBN 3-13-672201-9, S. 28.
- Dawkins G. P.C. and Miller R. A Sorbitol-Mannitol Solution for Urological Electrosurgical Resection – A safer Fluid than Glycine 1.5% European Urology 1999; 36:99-102.
- U. K. Laemmli: Cleavage of structural proteins during the assembly of the head of bacteriophage T4. In: Nature. Bd. 227, 1970, S. 680–685, doi:10.1038/227680a0, PMID 5432063.
