Mosasaurus
Mosasaurus („Echse von der Maas“) ist die Typusgattung der Mosasaurier (Mosasauridae), einer ausgestorbenen Familie großer Meeresreptilien aus der Zeit der Oberkreide. Die Gattung war namensgebend für die Mosasauridae, Schuppenkriechtiere, die hochgradig an eine aquatische Lebensweise angepasst waren. Mosasaurus war einer der letzten, am weitesten entwickelten und größten Mosasaurier.
| Mosasaurus | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Skelettrekonstruktion von Mosasaurus hoffmannii | ||||||||||||
| Zeitliches Auftreten | ||||||||||||
| Oberkreide (Campanium bis Maastrichtium) | ||||||||||||
| 83,6 bis 66 Mio. Jahre | ||||||||||||
| Fundorte | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Mosasaurus | ||||||||||||
| Conybeare, 1822 | ||||||||||||
| Arten | ||||||||||||
| ||||||||||||
Bei den Schädeln, die in den späten Jahren des 18. Jahrhunderts in einem Kreidesteinbruch in der Nähe der niederländischen Stadt Maastricht gefunden wurden, handelte es sich um die frühesten der Wissenschaft bekannten Fossilien. Ursprünglich wurde angenommen, dass sie die Knochen von Krokodilen oder Walen waren.
Das erste Fossil, der Schädel des Holotypus (NMHN AC. 9648), wurde etwa 1770 von niederländischen Bergleuten in der Nähe von Maastricht gefunden. Nach dem Einmarsch französischer Truppen wurde der Schädel 1794 als Kriegsbeute nach Paris gebracht und erlangte mit dem Spitznamen „großes Tier von Maastricht“ Bekanntheit. Im Jahr 1808 kam der Naturforscher Georges Cuvier zu dem Schluss, dass es sich um eine riesige Meereseidechse handelt, die Ähnlichkeiten zu Waranen aufweist, sich aber ansonsten von allen heute bekannten Tieren unterscheidet. Diese Auffassung war zu dieser Zeit revolutionär und trug dazu bei, die sich damals entwickelnden Vorstellungen des Aussterbens von Lebewesen zu unterstützen. Mosasaurus war somit das erste Reptil, bei dem anerkannt wurde, dass es eine nicht mehr existierende Art aus einer Vorwelt war. Zuvor hielt man Fossilien für Überreste rezenter (oder vielmehr unveränderlicher) Arten. Cuvier gab dem neuen Tier jedoch keinen wissenschaftlichen Namen; dies tat der britische Paläontologe William Daniel Conybeare im Jahr 1822.[1] Er nannte es Mosasaurus in Bezug auf den Fossilfund in der Nähe der Maas. Die Verwandtschaftsverhältnisse zwischen Mosasaurus und modernen Reptilien sind umstritten und die Frage, ob seine nächsten lebenden Verwandten Warane oder Schlangen sind, ist nach wie vor Bestandteil des wissenschaftlichen Diskurses.
Sein je nach Art breiterer oder schmalerer Schädel war mit robusten Kiefern mit großen Zähnen und starken Muskeln ausgestattet, die einen starken Biss ermöglichten. Seine vier Extremitäten waren zu robusten Paddeln geformt, um das Tier unter Wasser zu steuern. Sein Schwanz war lang und endete in einer paddelartigen Flosse, der nach unten gebogen war. Mosasaurus war ein Prädator, der einen schlechten Geruchssinn, dafür aber ein hervorragendes Sehvermögen hatte; außerdem eine hohe Stoffwechselrate, die darauf hindeutet, dass er endotherm (warmblütig) war, womit die Mosasaurier unter den Schuppenkriechtieren eine Ausnahme bilden würden. Die Klassifizierung von Mosasaurus war aufgrund einer unklaren Diagnose des Typusexemplars historisch problematisch. Infolgedessen wurden in der Vergangenheit über fünfzig verschiedene Arten der Gattung zugeordnet. Eine erneute Diagnose des Typusexemplars im Jahr 2017 trug zur Lösung des Taxonomieproblems bei und bestätigte, dass mindestens fünf Arten zur Gattung gehören. Weitere fünf Arten, die noch nominell in Mosasaurus klassifiziert sind, sollen in einer künftigen Studie erneut untersucht werden. Jede Art zeichnet sich durch einzigartige anatomische Merkmale aus, vom robust gebauten M. hoffmannii bis zum schlanken und schlangenförmigen M. lemonnieri.

Die Typusart und gleichzeitig größte Art der Gattung, M. hoffmannii, erreichte wahrscheinlich knapp 18 Meter Gesamtlänge. Gideon Mantell benannte 1829 die Art nach dem vermeintlich an der Bergung des Schädels beteiligten Militärchirurgen Johann Leonard Hoffmann.[2]
Fossile Beweise deuten darauf hin, dass Mosasaurus in einem Großteil des Atlantischen Ozeans und der angrenzenden Gewässer verbreitet war. Mosasaurus-Fossilien wurden in Nordamerika, Südamerika, Europa, Afrika, Westasien und der Antarktis gefunden. Diese Verbreitung umfasste ein breites Spektrum ozeanischer Klimazonen, einschließlich tropischer, subtropischer, gemäßigter und subpolarer Klimazonen. Mosasaurus war ein häufiges großes Raubtier in diesen Ozeanen und eine dominante Gattung, die an der Spitze der Nahrungskette stand. Wissenschaftler glauben, dass er praktisch jedes Tier erbeutete; in seinem Beutespektrum befanden sich Fische, Haie, Kopffüßer, Vögel und anderen Meeresreptilien wie Meeresschildkröten und andere Mosasaurier. Vermutlich jagte er bevorzugt im offenen Wasser nahe der Oberfläche. Aus ökologischer Sicht hatte Mosasaurus wahrscheinlich einen tiefgreifenden Einfluss auf die Struktur mariner Ökosysteme. Die Verbreitung an einigen Orten wie dem Western Interior Seaway in Nordamerika veränderte die Fauna stark. Obwohl Mosasaurus mit anderen großen räuberischen Mosasauriern wie Prognathodon und Tylosaurus, die sich von ähnlichen Beutetieren ernährten, in Konkurrenz stand, konnten die Gattungen durch Nischendifferenzierung in denselben Ökosystemen koexistieren. Mehrere Fossilien illustrierten Angriffe auf Mosasaurus-Individuen durch Tylosaurus und durch Artgenossen. Vermutlich fanden Rangkämpfe in Form von Bissen statt, wie sie heute bei Krokodilen zu beobachten sind.
Forschungsgeschichte
Erste Entdeckungen

Die ersten der Wissenschaft bekannten Überreste des Mosasaurus sind Fragmente eines Schädels, die 1764 in einem unterirdischen Kreidesteinbruch unter dem Sint Pietersberg, einem Hügel in der Nähe von Maastricht in den Niederlanden, entdeckt wurden. Das Fossil wurde 1766 von Leutnant Jean Baptiste Drouin gesammelt und 1784 vom Museumsdirektor Martinus van Marum für das Teylers Museum in Haarlem beschafft. Im Jahr 1790 veröffentlichte van Marum eine Beschreibung des Fossils, in der er es als Pisces cetacei klassifizierte.[3] Seiner Ansicht nach handelte es sich um eine Art „großer atmender Fische“ (also einen Wal). Dieser Schädel befindet sich bis heute in den Sammlungen des Museums und ist als TM 7424 katalogisiert.[4]
Um 1780 wurde im selben Steinbruch ein zweiter, vollständigerer Schädel entdeckt. Ein pensionierter niederländischer Militärchirurg namens Johann Leonard Hoffmann interessierte sich sehr für dieses Exemplar und korrespondierte darüber mit dem bekannten Biologen Petrus Camper. Hoffmann, der um 1770 verschiedene Mosasaurierknochen gesammelt hatte, vermutete, dass das Tier ein Krokodil war.[5] Camper kam dagegen 1786 zu dem Schluss, dass es sich bei den Überresten um eine „unbekannte Zahnwalart“ handelte und veröffentlichte seine Studien des Fossils in der Philosophical Transactions of the Royal Society,[6] die zu dieser Zeit die international renommierteste wissenschaftliche Zeitschrift war. So erlangte auch das zweite Fossil internationale Bekanntheit.[7] Während dieser Zeit befand es sich im Besitz des Kanonikers Theodorus Joannes Godding, dem der Teil des Landes gehörte, in dem es entdeckt wurde. Godding war von der Schönheit des Fossils beeindruckt, ergriff alle Maßnahmen, um es zu erhalten, und stellte es schließlich in einem Grotte hinter seinem Haus aus.[5]

Maastricht, eine zu dieser Zeit wichtige österreichische Festungsstadt, wurde während der Koalitionskriege im November 1794 von den französischen Truppen unter der Führung von General Jean-Baptiste Kléber erobert. Vier Tage später wurde das Fossil aufgrund seines internationalen wissenschaftlichen Wertes[7] von dem Politoffizier Augustin-Lucie de Frécine im Auftrag Klébers[8] aus Goddings Besitz entwendet. Nach einem Bericht von Goddings Nichte und Erbin Rosa gab Frécine zunächst vor, an der Untersuchung der berühmten Überreste interessiert zu sein, und arrangierte mit Godding per Brief einen Besuch in seiner Hütte. Frécine schickte sechs bewaffnete Soldaten, um das Fossil unter dem Vorwand, er sei krank und wollte es bei sich zu Hause studieren, gewaltsam zu beschlagnahmen.[5][7] Der Nationalkonvent verfügte, dass das Exemplar zum Muséum national d’histoire naturelle transportiert werden sollte. Bei dem Transport gingen verschiedene Teile des Schädels verloren. In einem Reklamationsantrag von 1816 behauptete Rosa, noch zwei der fehlenden Seitenteile des Schädels zu besitzen. Das Schicksal dieser Knochen ist jedoch unbekannt, und Historiker glauben, dass Rosa sie in der Hoffnung erwähnte, über eine Entschädigung verhandeln zu können. Die französische Regierung weigerte sich, das Fossil zurückzugeben, entschädigte aber Godding 1827 durch Befreiung von Kriegssteuern.[7]
Es gibt eine populäre Legende über Goddings Besitz des Exemplars und der anschließenden Aneignung durch die Franzosen, die auf der Publikation des Geologen Barthélemy Faujas de Saint-Fond (einer der vier Männer, die im Januar 1795 nach Maastricht kamen, um Objekte von wissenschaftlichem Wert für Frankreich zu beschlagnahmen) Histoire naturelle de la montagne de Saint-Pierre de Maestricht von 1798 basiert. Laut Faujas war Hoffmann der ursprüngliche Besitzer des Exemplars, bei deren Ausgrabung er geholfen und das er anschließend gekauft hatte. Als die Nachricht von dieser Entdeckung Godding erreichte, den Faujas als böswillig darstellte, habe er versucht, das äußerst wertvolle Exemplar in seinen Besitz zu überführen, und eine Klage gegen Hoffmann eingereicht, in der er seine Rechte als Landbesitzer geltend machte. Aufgrund der Position von Godding als Kanoniker habe er die Gerichte beeinflussen und Hoffmann zwingen können, das Fossil abzugeben und die Kosten der Klage zu tragen. Als Maastricht von den Franzosen angegriffen wurde, sei den Artilleristen bewusst gewesen, dass das berühmte Fossil in Goddings Haus aufbewahrt wurde. Dieser wusste nicht, dass sein Haus verschont bleiben würde und habe das Exemplar an einem geheimen Ort in der Stadt versteckt. Nach der Eroberung der Stadt habe Faujas persönlich bei der Sicherung des Fossils geholfen, während de Frécine denjenigen, der den Schädel unbeschädigt ausfindig machen und ihm bringen würde, mit 600 Flaschen guten Weins belohnen sollte. Am nächsten Tag brachten zwölf Grenadiere das Fossil sicher zu de Frécine, nachdem sie Godding die volle Entschädigung zugesichert und ihre versprochene Belohnung bekommen hatten.
Historiker haben wenig Beweise gefunden, um Faujas´ Bericht zu stützen. Zum Beispiel gibt es keine Beweise dafür, dass Hoffmann das Fossil jemals besaß, dass es ein Gerichtsverfahren zwischen ihm und Godding gab oder dass Faujas direkt an der Überführung des Fossils beteiligt war. Zuverlässigere, aber widersprüchliche Berichte deuten darauf hin, dass seine Erzählung größtenteils erfunden wurde: Faujas war als berüchtigter Lügner bekannt, der seine Geschichten gewöhnlich verschönerte, und es gilt als wahrscheinlich, dass er die Geschichte fälschte, um Hinweise auf Plünderungen eines privaten Eigentümers zu verschleiern (was ein Kriegsverbrechen war), um französische Propaganda zu betreiben oder einfach um andere zu beeindrucken. Trotzdem hat die Legende, die durch Faujas´ beschönigende Darstellung geschaffen wurde, dazu beigetragen, dem zweiten Schädel zu kultureller Bekanntheit zu verschaffen.[7][5]
Im Gegensatz zu dem bekannten Fossil wurde der erste Schädel TM 7424 nach der Eroberung von Maastricht nicht von den Franzosen beschlagnahmt. Während der Mission Faujas´ und seiner drei Kollegen im Jahr 1795 wurden die Sammlungen des Teylers Museum, obwohl sie berühmt waren, vor Beschlagnahme geschützt. Es ist möglich, dass die vier Männer angewiesen wurden, alle Privatsammlungen als „unverletzlich“ zu schützen (es sei denn, ihr Besitzer war zum Rebellen erklärt worden) und es ihnen so verboten wurde, die Sammlungen des Teylers Museum zu beschlagnahmen. Der Schutz könnte jedoch auch auf van Marums Bekanntschaft mit Faujas und André Thouin (ein weiterer der vier Männer) zurückzuführen sein.[5]
Identifikation und Namensgebung
Bevor der zweite Schädel Ende 1794 von den Franzosen beschlagnahmt wurde, waren die beiden populärsten Hypothesen zu seiner Zugehörigkeit, dass er die Überreste eines Krokodils oder eines Wals darstellte, wie es zuerst Hoffmann bzw. Camper vertreten hatten. Hoffmanns Identifikation als Krokodil wurde damals von vielen als die naheliegende Lösung angesehen, da zu dieser Zeit Vorstellungen von Evolution und Aussterben nicht verbreitet waren und der Schädel oberflächlich dem eines Krokodils ähnelte.[9] Unter den verschiedenen Mosasaurierknochen, die Hoffmann 1770 sammelte, befanden sich außerdem Phalanxknochen, die er zusammensetzte und auf eine Gipsmatrix legte. In seiner Zusammensetzung wurde die Sicht auf einige der Phalangen derart verzerrt, dass es so schien, als wenn Krallen vorhanden wären, was für Hoffmann wahrscheinlich einen weiteren Beweis für ein Krokodil darstellte. Camper stützte seine Argumentation für einen Wal auf vier Punkte. Zunächst bemerkte er, dass die Kieferknochen des Schädels eine glatte Textur hatten und die Zähne an der Wurzel fest waren, ähnlich wie bei Pottwalen und unähnlich zu den porösen Kieferknochen und hohlen Zähnen eines Krokodils.[10] Zweitens erhielt Camper Mosasaurier-Phalangen, von denen er feststellte, dass sie sich signifikant von denen von Krokodilen unterscheiden. Er vermutete, dass sie zu paddelförmigen Gliedmaßen gehörten, was ebenso zu Walen passte. Drittens bemerkte Camper Zähne am Pterygoidknochen des Schädels, ein Merkmal, das nicht bei Krokodilen, aber bei vielen Fischarten vorhanden ist (Camper glaubte auch, dass die rudimentären Zähne im Oberkiefer des Pottwals, von dem er fälschlicherweise glaubte, dass er eine Fischart wäre, Pterygoidzähnen entsprächen). Schließlich wies Camper darauf hin, dass alle anderen Fossilien aus Maastricht marin sind, was darauf hinweist, dass auch der Schädel zu einem marinen Tier gehört. Da er fälschlicherweise glaubte, Krokodile seien ausschließlich Süßwassertiere, kam Camper durch das Ausschlussverfahren zu dem Ergebnis, dass das Tier nur ein Wal sein könne.[9]
Der zweite Schädel kam 1795 im Muséum national d’histoire naturelle an, wo er heute als MNHN AC 9648 katalogisiert ist. Er erregte die Aufmerksamkeit weiterer Wissenschaftler und wurde als Le Grand Animal Fossile des Carrières de Maestricht[5] („großes Tier von Maastricht“)[4] bezeichnet. Einer der Wissenschaftler war Campers Sohn Adriaan Gilles Camper. Obwohl Camper Jr. ursprünglich beabsichtigt hatte, die Ergebnisse seines Vaters zu verteidigen, war er stattdessen der Erste, der begriff, dass sowohl die Krokodil-, als auch die Walhypothese falsch waren. Basierend auf seinen eigenen Untersuchungen von MNHN AC 9648 und den Fossilien seines Vaters stellte er fest, dass ihre anatomischen Merkmale eher Schuppenkriechtieren und Waranen ähnelte. Er kam zu dem Schluss, dass das Tier eine große Meereseidechse mit Ähnlichkeiten zu Waranen gewesen sein muss. 1799 diskutierte Camper Jr. seine Schlussfolgerungen mit dem französischen Naturforscher Georges Cuvier. Cuvier untersuchte MNHN AC 9648 und bestätigte 1808 die Identifizierung als große Meereseidechse, bemerkte jedoch, dass es sich um eine ausgestorbene Art handelt, die sich von allen rezenten Arten unterscheidet.[9] Das Fossil wurde so Teil von Cuviers ersten Spekulationen über die Möglichkeit des Aussterbens von Arten, die den Weg für seine Theorie des Katastrophismus oder der „aufeinanderfolgender Schöpfungen“, einer der Vorgänger der Evolutionstheorie, ebneten. Zuvor wurden fast alle Fossilien, auch wenn anerkannt wurde, dass sie von vergangenen Lebensformen stammten, als Formen interpretiert, die denen der heutigen Zeit ähnlich waren. Cuviers Vorstellung, dass das Maastricht-Exemplar eine gigantische Version eines modernen Tieres ohne größere Ähnlichkeit zu irgendeiner heutigen Spezies, mutete zu dieser Zeit seltsam an, sogar für ihn selbst.[11] Die Idee war für Cuvier so bedeutsam, dass er 1812 verkündete: „In erster Linie erscheint die genaue Bestimmung des berühmten Tieres aus Maastricht uns für die Theorie der zoologischen Gesetze ebenso wichtig wie für die Geschichte der Welt.“[5] Cuvier begründete seine Konzepte damit, dass er seinen Techniken auf dem sich damals entwickelnden Gebiet der vergleichenden Anatomie vertraute, mit denen er bereits riesige ausgestorbene Vertreter anderer moderner Gruppen identifiziert hatte.[11]

Obwohl die binäre Nomenklatur zu dieser Zeit gut etabliert war, gab Cuvier der neuen Art nie einen wissenschaftlichen Namen und für eine Weile wurde es weiterhin als „großes Tier von Maastricht“ bezeichnet. 1822 veröffentlichte der englische Arzt James Parkinson eine Konversation, die einen Vorschlag von Llandaff-Dekan William Daniel Conybeare enthielt, die Art als vorübergehend als Mosasaurus zu bezeichnen, bis Cuvier sich für einen dauerhaften wissenschaftlichen Namen entschied. Cuvier übernahm selbst Mosasaurus als Gattungsnamen der Art und legte MNHN AC 9648 als Holotyp fest. Im Jahr 1829 fügte der englische Paläontologe Gideon Mantell das Epitheton hoffmannii zu Ehren Hoffmanns hinzu.[4][12]
Frühe amerikanische Entdeckungen
Die erste mögliche Entdeckung eines Mosasauriers in Nordamerika war ein Teilskelett, das 1804 bei der Lewis-und-Clark-Expedition gefunden und als Fisch beschrieben wurde. Es wurde von Sergeant Patrick Gass in schwarzen Schwefelgestein entlang des Missouri River gefunden[13][14] und bestand aus einigen Zähnen und Teilen einer Wirbelsäule mit einer Länge von 14 m. Vier Mitglieder der Expedition hielten die Entdeckung schriftlich fest, darunter Clark und Gass.[14] Einige Teile des Fossils wurden gesammelt und nach Washington, D.C. zurückgeschickt, wo sie verloren gingen, bevor sie ordnungsgemäß dokumentiert werden konnten. In seinem 2003 veröffentlichten Buch Sea Dragons: Predators of Prehistoric Seas stellt Richard Ellis die Vermutung auf, dass die Überreste zu M. missouriensis gehört haben könnten[15]; andere Spekulationen gehen jedoch eher von einem Vertreter der Tylosaurinae oder einem Plesiosaurier aus.[16]
Die früheste Beschreibung nordamerikanischer Fossilien, die sicher der Gattung Mosasaurus zugeordnet sind, wurde 1818 vom Naturforscher Samuel L. Mitchill vom Lyceum of Natural History vorgenommen. Die beschriebenen Fossilien bestanden aus einem Zahn- und Kieferfragment, die aus einer Mergelgrube aus Monmouth County geborgen wurden. Mitchill beschrieb sie als „Eidechsenmonster oder Saurier, das dem berühmten fossilen Reptil von Maestricht ähnelt“, was darauf hindeutet, dass die Fossilien Ähnlichkeit zu dem damals unbenannten M. hoffmannii-Holotypus aus Maastricht aufwiesen. Cuvier war sich dieser Entdeckung bewusst, bezweifelte jedoch, dass sie zur Gattung Mosasaurus gehörte. Zusätzlich erklärte ein anderer ausländischer Naturforscher, dessen Name nicht bekannt ist, „vorbehaltlos“, dass die Fossilien stattdessen einer Art von Ichthyosaurus gehörten. 1830 untersuchte der Zoologe James Ellsworth De Kay das Exemplar erneut. Er kam zu dem Schluss, dass es sich tatsächlich um eine Mosasaurus-Art handelt, die erheblich größer als der M. hoffmannii-Holotyp ist, was sie zum größten fossilen Reptil macht, das jemals auf dem Kontinent entdeckt wurde.[17] Ob die beiden zur selben Art gehörten oder nicht, blieb unbekannt, bis der deutsche Paläontologe Heinrich Georg Bronn das Exemplar 1839 als neue Art bezeichnete und es zu Ehren von De Kays Bemühungen Mosasaurus dekayi nannte.[18] Das Exemplar ging jedoch verloren und das Taxon wurde 2005 zum Nomen Dubium erklärt.[12][19] Es existieren einige weitere Fossilien aus New Jersey, die ehemals als M. dekayi bezeichnet wurden, heute aber M. hoffmannii zugeordnet werden.[12][20]

Das Typusexemplar der zweiten Art, M. missouriensis, wurde erstmals in den frühen 1830er Jahren entdeckt und von einem Pelzfänger in der Nähe der Big Bend Talsperre des Missouri Rivers geborgen. Dieses Exemplar, das aus einigen Wirbeln und einem teilweise vollständigen Schädel bestand, dem insbesondere das Ende seiner Schnauze fehlte, wurde nach St. Louis zurückgebracht, wo es von einem Indianeragenten als Heimdekoration gekauft wurde. Dieses Fossil erregte die Aufmerksamkeit des deutschen Prinzen Maximilian zu Wied-Neuwied während seiner Reisen von 1832 bis 1834 in den amerikanischen Westen. Er kaufte das Fossil und schickte es anschließend für Forschungszwecke an den Naturforscher Georg August Goldfuss von der Universität Bonn. Es wurde in den Sammlungen der Universität unter der Katalognummer RFWUIP 1327 aufbewahrt. Goldfuss untersuchte das Exemplar sorgfältig und kam zu dem Ergebnis, dass es sich um eine neue Mosasaurus-Art handelte, die er 1845 zu Ehren Maximilians M. maximiliani nannte.[13] Der amerikanische Naturforscher Richard Harlan veröffentlichte jedoch bereits 1834 eine Beschreibung einer partiellen fossilen Schnauze, die er von einem Händler aus den Rocky Mountains erhalten hatte, der sie an derselben Stelle wie das Goldfuss-Exemplar gefunden hatte. Basierend auf Merkmalen der Zähne und Positionierung der Nasenlöcher glaubte Harlan, das Fossil gehöre zu einer Ichthyosaurus-Art und nannte es Ichthyosaurus missouriensis.[21] 1839 revidierte er diese Ansicht, nachdem er Unterschiede im Zwischenkieferbein und in den Poren zwischen der Schnauze des Fossils und denen eines Ichthyosaurus festgestellt hatte. Stattdessen glaubte er, dass das Fossil zu einer neuen Froschgattung oder einer salamanderähnlichen Amphibie gehörte und ordnete es der Gattung Bactrachiosaurus zu.[22] Aus unbekannten Gründen dokumentierte eine Veröffentlichung von Harlans Ergebnissen der Société géologique de France das Fossil im selben Jahr als Bactrachotherium.[23] Spätere Autoren vermuteten, dass die Schnauze weder zu einem Ichthyosaurier, noch einer Amphibie, sondern zu einem Mosasaurier gehörte, und dass es die Schnauze gewesen sein könnte, die im Goldfuss-Schädel fehlte. Dies konnte zu diesem Zeitpunkt nicht bestätigt werden, da die fossile Schnauze verloren ging. Im Jahr 2004 wurde sie in den Sammlungen des Nationalen Naturkundemuseums in Frankreich unter der Katalognummer MNHN 958 wiederentdeckt. Harlan hatte das Fossil dem Museum gespendet hatte, wo es bis zu seiner Wiederentdeckung in Vergessenheit geraten war. Die Schnauze passte perfekt zum Goldfuss-Schädel, was bestätigte, dass es sich um die fehlende Schnauze des Exemplars handelte. Aufgrund seiner früheren Beschreibung hatte Harlans Taxon Vorrang und das Fossil bekam den endgültigen wissenschaftlichen Namen M. missouriensis.[13]
Frühe Darstellungen
Wissenschaftler stellten sich Mosasaurus zunächst als amphibisches Meeresreptil mit Schwimmhäuten und für die Bewegung an Land angepassten Beinen vor, das sich sowohl terrestrisch als auch aquatisch fortbewegen konnte. Gelehrte wie Goldfuss argumentierten, dass die damals bekannten Skelettmerkmale wie die elastische Wirbelsäule darauf hinwiesen, dass Mosasaurus laufen konnte, weil für ein Leben ausschließlich im Wasser eine steife Wirbelsäule wegen ihrer höheren Stabilität besser geeignet wäre. Der deutsche Zoologe Hermann Schlegel bewies 1854 durch anatomische Forschungsergebnisse als erster, dass Mosasaurus Flossen anstelle von Füßen hatte. Bei der Untersuchung der fossilen Phalangen, einschließlich der von Hoffmann gesammelten, mit Gips umhüllten Proben (die Schlegel aus dem Gips extrahieren musste, wobei er feststellte, dass dies frühere Wissenschaftler irregeführt haben könnte), stellte er fest, dass sie breit und flach waren und keinen Hinweis auf Muskel- oder Sehnenanhaftung zeigten, was darauf hinweist, dass Mosasaurus nicht laufen konnte, sondern flossenartige Gliedmaßen für einen vollständig aquatischen Lebensstil hatte. Schlegels Hypothese wurde von seinen Zeitgenossen weitgehend ignoriert, wurde jedoch in den 1870er Jahren allgemein akzeptiert, als die amerikanischen Paläontologen Othniel Charles Marsh und Edward Drinker Cope vollständigere Mosasaurierfossilien in Nordamerika entdeckten.[9]

Eine der frühesten künstlerischen Rekonstruktionen des Mosasaurus ist eine lebensgroße Betonskulptur, die der naturhistorische Bildhauer Benjamin Waterhouse Hawkins zwischen 1852 und 1854 als Teil der Sammlung von Skulpturen prähistorischer Tiere im Crystal Palace in London, der ehemaligen Ausstellungsfläche der Great Exhibition. Hawkins modellierte Mosasaurus unter der Leitung des englischen Paläontologen Richard Owen, der dessen mögliches Erscheinungsbild hauptsächlich anhand des Holotypschädels rekonstruierte. Angesichts seiner Kenntnis der möglichen Verwandtschaft zwischen Mosasaurus und Waranen stellte Hawkins das prähistorische Tier im Wesentlichen als wasserlebenden Waran dar. Der Kopf war groß und kastenförmig, was in Owens Schätzungen der Maße des Holotypschädels von 0,76 m × 1,5 m begründet war. An der Seite des Schädels waren Nasenlöcher und um die Augen viel Weichgewebe, die Lippen erinnern an Warane. Die Haut erhielt eine robuste, schuppige Textur, ähnlich wie bei größeren Waranen wie dem Komodowaran. Zu den dargestellten Gliedmaßen gehört eine rechte, einzelne Flosse, die die aquatische Natur des Mosasaurus widerspiegelt. Das Modell wurde jedoch absichtlich unvollständig geformt, wobei nur der Kopf, der Rücken und die einzelne Flosse konstruiert wurden. Dies wurde allgemein auf Owens mangelndes klares Wissen über die postkraniale Anatomie des Mosasaurus zurückgeführt. Der Paläontologe und Paläokünstler Mark P. Witton hält dies aber für unwahrscheinlich, da Owen eine vollständige spekulative Rekonstruktion einer Dicynodon-Skulptur, die damals ebenfalls nur durch Schädel bekannt war, anleiten konnte. Stattdessen könnten zeitliche und finanzielle Einschränkungen Hawkins dazu veranlasst haben, Abstriche zu machen und das Mosasaurus-Modell auf eine Weise zu formen, die unvollständig, aber visuell akzeptabel war.[24] Um die fehlenden anatomischen Teile zu verbergen, wurde die Skulptur teilweise in den See getaucht und in der Nähe der Pterodactylus-Modelle auf der anderen Seite der Hauptinsel platziert.[25] Obwohl einige Elemente der Mosasaurus-Skulptur wie die Zähne genau dargestellt wurden, können viele Elemente des Modells selbst für diese Zeit als ungenau angesehen werden. Die Darstellung von Mosasaurus mit kastenförmigem Kopf, seitlich positionierten Nasenlöchern und Flossen widersprach den Studien von Goldfuss (1845), dessen Untersuchungen der Wirbel und des nahezu vollständigen und unverfälschten Schädel von M. missouriensis einen schmaleren Schädel, Nasenlöcher an der Schädeloberseite und amphibische, terrestrische Gliedmaßen implizierten (letzteres ist nach aktuellen Erkenntnissen falsch). Die Unkenntnis dieser Ergebnisse könnte auf eine allgemeine Unkenntnis von Goldfuss 'Studien durch andere zeitgenössische Wissenschaftler zurückzuführen sein.[24]
Spätere Entdeckungen
Außer M. hoffmannii und M. missouriensis (als die bekanntesten und bestuntersuchten Arten der Gattung Mosasaurus) wurden noch weitere Arten der Gattung beschrieben.[26] 1881 beschrieb Cope eine dritte Mosasaurus-Art anhand von Fossilien, die ihm ein Kollege geschickt hatte, der sie in Lagerstätten in der Umgebung von Freehold Township, New Jersey, entdeckte;[27] darunter ein Teil des Unterkiefers, einige Zähne und Wirbel sowie Gliedmaßen. Diese Fossilien befinden sich jetzt unter der Katalognummer AMNH 1380 im American Museum of Natural History.[28] Aufgrund ihres schlanken Körperbaus vermutete Cope, dass die Fossilien eine neue Art von Clidastes darstellten, die er Clidastes conodon nannte.[27] 1966 untersuchten die Paläontologen Donald Baird und Gerard R. Case die Holotyp-Fossilien erneut und stellten fest, dass die Art stattdessen Mosasaurus zuzuordnen war, woraufhin sie sie in Mosasaurus conodon umbenannten.[28] Cope gab keine Etymologie für das Epitheton conodon an.[27] Der Etymologe Ben Creisler gibt als Übersetzung „Kegelzahn“ an, abgeleitet vom altgriechischen κῶνος (kônos, was „Kegel“ bedeutet) und ὀδών (odṓn, was „Zahn“ bedeutet), wahrscheinlich in Bezug auf die für die Art charakteristischen konischen Zähne mit glatter Oberfläche.[29]
_(20248316020).jpg.webp)
Die vierte Art, M. lemonnieri, wurde 1889 von belgischen Paläontologen Louis Dollo beschrieben, basierend auf einem ziemlich vollständigen Schädel, der aus einem Phosphat-Steinbruch geborgen wurde, der im Besitz des Konzerns Solvay war. Der Schädel war eines von vielen Fossilien, die der Ausgrabungsleiter Alfred Lemonnier dem Königlich-Belgischen Institut für Naturwissenschaften gespendet hatte; deshalb nannte Dollo die Art zu seinen Ehren.[30] In den folgenden Jahren führte der Gesteinsabbau dort zu weiteren gut erhaltenen Fossilien der Art, von denen einige in Dollos späteren Veröffentlichungen beschrieben wurden, darunter mehrere Teilskelette, die ausreichten, um fast das gesamte Skelett von M. lemonnieri zu rekonstruieren. Alle bekannten Fossilien der Art befinden sich in den Sammlungen desselben Museums; der Holotyp-Schädel ist als IRSNB R28 katalogisiert.[12][31] Obwohl die Art der Gattung durch die meisten Funde gestützt ist, wurde sie in der wissenschaftlichen Literatur oft ignoriert. Der Paläontologe Theagarten Lingham-Soliar von der Nelson Mandela University schlug zwei Gründe für eine solche Nichtbeachtung vor: Der erste Grund war, dass M. lemonnieri-Fossilien in Belgien und den Niederlanden endemisch waren; diese Gebiete zogen trotz der berühmten Entdeckung des Holotyps von M. hoffmannii im Allgemeinen kaum die Aufmerksamkeit von Mosasaurier-Paläontologen auf sich. Der zweite Grund war, dass M. lemonnieri durch ihre berühmtere und geschichtsträchtige Nachbarart M. hoffmannii in den Schatten gestellt wurde.[31] M. lemonnieri wurde als umstrittenes Taxon betrachtet, und Autoren, die die Art thematisierten, argumentierten teilweise, dass es sich um ein Synonym für andere Arten handeln würde.[32] 1967 argumentierte der Paläontologe Dale Russell von der North Carolina State University, dass Unterschiede zwischen den Fossilien von M. lemonnieri und M. conodon zu gering seien, um eine Trennung auf Artebene zu unterstützen. Gemäß der Prioritätsregel bezeichnete Russell M. lemonnieri als Junior-Synonym für M. conodon.[33] In einer im Jahr 2000 veröffentlichten Studie widerlegte Lingham-Soliar Russells Klassifizierung durch eine umfassende Untersuchung der Proben des Royal Belgian Institute und wies signifikante Unterschiede in der Schädelmorphologie nach. Er erklärte jedoch, dass bessere Studien über M. conodon erforderlich seien, um die Frage der Synonymie zu lösen.[31] Eine solche Studie wurde 2014 in einem Artikel von Takehito Ikejiri von der University of Alabama und Spencer G. Lucas vom New Mexico Museum for Natural History and Science veröffentlicht, bei der der Schädel von M. conodon im Detail untersucht und so die Trennung von M. conodon und M. lemonnieri als unterschiedliche Arten gerechtfertigt wurde.[28] 2004 stellten die Paläontologen Eric Mulder, Dirk Cornelissen und Louis Verding jedoch die Theorie auf, dass M. lemonnieri tatsächlich juvenile Vertreter von M. hoffmannii sein könnten. Gestützt wurde diese These durch die Argumentation, Unterschiede zwischen den beiden Arten seien nur in „Idealfällen“ beobachtbar und könnten durch altersbedingte Faktoren erklärt werden. Dennoch gibt es einige Unterschiede wie beispielsweise Riffelungen an den Zähnen von M. lemonnieri, die darauf hinweisen könnten, dass es sich um unterschiedliche Arten handelt. Für einen schlüssigere Ergebnisse bezüglich der Synonymie sind weitere Studien erforderlich.[34]
Die fünfte Art, M. beaugei, wurde 1952 vom französischen Paläontologen Camille Arambourg beschrieben, im Rahmen eines seit 1934 laufenden Großprojekts, um paläontologische und stratigraphische Daten Marokkos zu untersuchen und Phosphatbergarbeitern wie dem OCP zur Verfügung zu stellen.[35] Die Art wurde anhand von neun einzelnen Zähnen beschrieben, die aus Phosphatdeponien im Ouled-Abdoun-Becken und im Ganntour-Becken in Marokko stammen.[36] Die Art wurde zu Ehren des OCP-Generaldirektors Alfred Beaugé benannt, der Arambourg zur Teilnahme am Forschungsprojekt einlud und bei der Beschaffung lokaler Fossilien half.[35] Die Zähne befinden sich derzeit im Nationalen Naturkundemuseum in Frankreich. Einer der Zähne, der als MNHN PMC 7 (freier Volltext) katalogisiert ist, wurde als Holotyp bezeichnet. In einer Studie von 2004 untersuchten Paläontologen unter der Leitung von Nathalie Bardet vom selben Museum Arambourgs Zähne erneut und stellten fest, dass nur drei mit Sicherheit M. beaugei zuzuordnen sind. Zwei der anderen Zähne weisen Eigenschaften auf, die möglicherweise innerhalb der Variationsbreite der Art liegen, aber schließlich nicht M. beaugei zugeordnet wurden, während die verbleibenden vier Zähne in keinem Zusammenhang zu der Art stehen und unbestimmt blieben. Die Studie beschrieb auch vollständigere M. beaugei-Fossilien in Form zweier gut erhaltener Schädel, die aus dem Ouled-Abdoun-Becken geborgen wurden.[36]
Beschreibung
Mosasaurus war ein spezialisierter Mosasaurier, der einen vollständig aquatischen Lebensstil entwickelt hat. Er hatte einen stromlinienförmigen Körper, einen länglichen Schwanz, der mit einer abwärts gebogenen Schwanzflosse endete, und zwei Paar paddelförmiger Flossen. Während in der Vergangenheit Mosasaurier als riesige Seeschlangen mit Flossen dargestellt wurden, weiß man jetzt, dass sie in ihrer oberflächlichen Gestalt anderen großen Meereswirbeltieren wie Ichthyosauriern, Thalattosuchia (Crokodylomorpha) und Archaeoceti durch konvergente Evolution ähnlicher waren.[37][38][39]
Größe
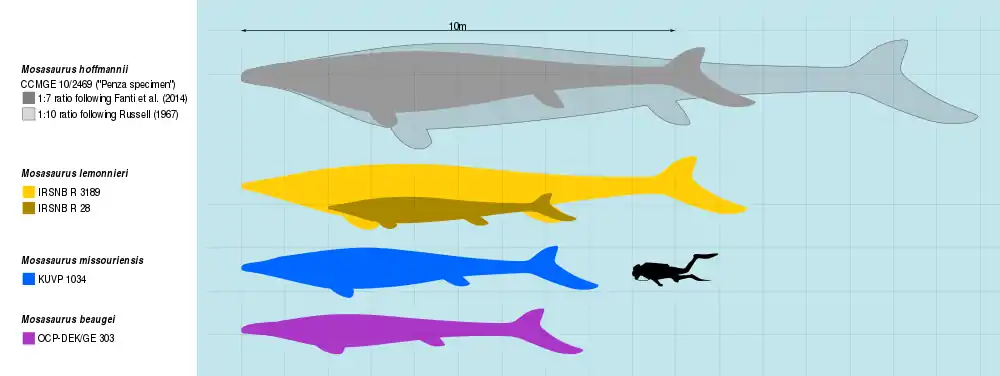

Mosasaurus ist eine der größten bekannten Arten der Mosasaurier.[40] Da nur wenige postkraniale Fossilien gefunden wurden, unterliegt seine Länge groben Schätzungen, die auf Hochrechnungen unvollständiger Fossilien beruhen.[12] Die Art ist durch fossile Schädel gut vertreten, weshalb von der Länge des Schädels oder des Unterkiefers ausgehend eine hypothetische Gesamtlänge ermittelt werden kann. Weithin bekannt ist die von Russell (1967) verwendete Berechnung; der schrieb, dass „die gegebene Länge des Kiefers 10 % der Körperlänge entspricht“.[33] Unter Anwendung dieses Verhältnisses auf den größten Unterkiefer, der M. hoffmannii zugeschrieben wird (CCMGE 10/2469; auch bekannt als das Pensa-Exemplar mit einer Länge von 1.710 Millimetern), schätzte Grigoriev (2014) eine maximale Länge von 17,1 Metern.[40] Bei der Untersuchung eines kleineren Teils eines Kieferknochenfossils (NHMM 009002) mit einer Größe von 900 Millimetern und einer „zuverlässigen Schätzung von 1600 mm“ vermutete Lingham-Soliar (1995) eine größere maximale Länge von 17,6 Metern unter der Annahme desselben Verhältnisses, das er aber möglicherweise falsch angewendet hatte, indem er die Länge des Unterkiefers mit dessen zehnfacher Länge addierte (also ein Verhältnis von 1:10, anstatt 1:9 wie Russell).[41][33] Der Vergleich mit den Verhältnissen verwandter Mosasaurier-Gattungen legt nahe, auch für M. hoffmannii eine im Verhältnis zur Kopflänge geringere Gesamtlänge anzunehmen. In einer Studie von 2014 gingen Federico Fanti et al. von einer etwa siebenfachen Gesamtlänge von M. hoffmannii aus, nachdem sie ein nahezu vollständiges Skelett von Prognathodon overtoni studiert und verglichen hatten. Demnach besäße ein M. hoffmannii-Exemplar mit einer Schädellänge von 144 Zentimetern eine Körperlänge von guten 11 Metern.[42]
Einzelne Knochen deuten darauf hin, dass einige M. hoffmannii die Länge des Pensa-Fossils überschritten haben könnten. Ein solcher Knochen ist ein Quadratum (NHMM 003.892), das 150 % der durchschnittlichen Größe aufwies; Everhart et al. (2016) berichteten, dass dies auf eine Länge von etwa 18 Metern hochgerechnet werden kann, wobei aber nicht angegeben wurde, ob bei der Berechnung das Verhältnis von Russell verwendet wurde.[43]
M. missouriensis und M. lemonnieri sind kleiner als M. hoffmannii, aber durch vollständigere Fossilien bekannt. Basierend auf Messungen verschiedener belgischer Skelette schätzte Dollo, dass M. lemonnieri ausgewachsen eine Länge von etwa 7 bis 10 Metern erreichte, wobei der Schädel etwa ein Elftel des gesamten Körpers ausmachte.[33][44] Polycn et al. (2014) schätzten M. missouriensis auf 8–9 Meter Länge.[45][46] Street (2016) stellte fest, dass große M. missouriensis typischerweise Schädel von mehr als einem Meter Länge hatten. Bei einem nahezu vollständigen Skelett von M. missouriensis mit einem einen Meter langen Schädel wurde eine Gesamtlänge von 6,5 Metern gemessen.[47] Zuverlässige Größenschätzungen von M. conodon existieren in der wissenschaftlichen Literatur nicht, aber mit einem Schädel von etwa 97,7 Zentimetern Länge wird er als kleiner bis mittelgroßer Vertreter der Gattung angesehen.[28]
Schädel
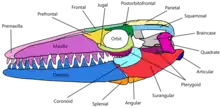
Der Schädel des Mosasaurus war konisch und verjüngte sich zu einer kurzen und konischen Schnauze, die sich ein wenig über die Prämaxillarzähne hinaus erstreckte. Oberhalb des Zahnfleischrands in beiden Kiefern befand sich parallel zur Kinnlinie ein einreihiges Muster kleiner Gruben, die als Foramina bezeichnet werden und in die die Nervenenden mündeten. Einige Foramina waren auch entlang der Schnauze in einem ähnlichen Muster vorhanden wie bei Schädeln von Clidastes.[41] Bei den meisten Arten war der Oberkiefer robust gebaut, breit und tief, mit Ausnahme von M. conodon, der schlanke Kiefer hatte.[28] Der Prämaxillarstab, der lange Teil des Prämaxillarknochens, der sich hinter den Prämaxillarzähnen erstreckte, war robust und verschmälerte sich nicht zur Mitte hin, wie es für andere Mosasaurier-Gattungen typisch ist.[48] Die äußeren Nasenöffnungen waren mäßig groß und messen bei M. hoffmannii etwa 21–24 % der Schädellänge. Sie befanden sich weiter hinten als bei jedem anderen Mosasaurier (bis auf Goronyosaurus, bei dem sie noch weiter hinten sind) und begannen oberhalb der vierten oder fünften Oberkieferzähne.[41]
Mosasaurus hatte einen dichten Gaumenkomplex, was eine große Stabilität des Schädels gewährleistete; er bestand aus Pterygoidknochen, Gaumenbein und nahegelegenen Knochen anderer Bereiche. Das begrenzte Neurokranium beherbergte ein im Vergleich zu anderen Mosasauriern relativ kleines Gehirn (bei Plioplatecarpus marshi war das Gehirn etwa doppelt so groß wie das von M. hoffmannii, bei halber Körperlänge). Die Räume innerhalb des Neurokraniums, die den Okzipitallappen und das Großhirn umschlossen, waren eng und flach, was darauf hindeutet, dass diese Gehirnteile relativ klein waren. Das Foramen parietale, das mit dem Scheitelauge assoziiert ist, war das kleinste in der Familie der Mosasauridae.[41] Die Luftröhre verlief wahrscheinlich von der Speiseröhre bis unter das hintere Ende des Muskelfortsatzes des Unterkiefers, wo sie sich in kleinere Bronchienpaare aufspaltete, die sich parallel zueinander erstreckten.[49]
Zähne
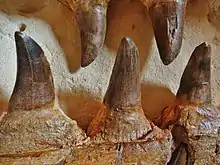
Die Merkmale der Mosasaurus-Zähne sind je nach Art verschieden. Gemeinsame Merkmale der Gattung sind die Schmelzprismen und die zwei gegenüberliegenden Schneidekanten.[28][36][50][51] Mosasaurus-Zähne sind groß und robust, mit Ausnahme von M. conodon und M. lemonnieri, die schlankere Zähne haben.[28][36] Die Schneidekanten der Zähne können je nach Art gezackt sein: Die Schneidekanten von M. hoffmannii und M. missouriensis waren fein gezackt,[26][48] während die von M. conodon und M. lemonnieri keine Zacken aufwiesen.[34] Die Schneidekanten von M. beaugei waren weder gezackt noch glatt, sondern wiesen winzige Krenulationen auf. Die Anzahl der Prismen und flachen Seiten kann zwischen den Zahntypen leicht variieren und die allgemeinen Schemata unterscheiden sich zwischen den Arten. M. hoffmannii hatte zwei bis drei Prismen auf der labialen (nach außen zeigenden) Seite und keine Prismen auf der lingualen (der Zunge zugewandten) Seite. M. missouriensis hatte vier bis sechs labiale und acht linguale Prismen, M. lemonnieri hatte acht bis zehn labiale Prismen und M. beaugei hatte drei bis fünf labiale und acht bis neun linguale Prismen.[36]
Wie alle Mosasaurier hatte Mosasaurus vier Arten von Zähnen, die nach den Kieferknochen benannt waren, auf denen sie sich befanden. Am Oberkiefer gab es drei Arten: die Prämaxillarzähne, die Maxillarzähne und die Pterygoidzähne (ein Merkmal, das bei allen Mosasauriern und verschiedenen modernen Reptilien vorhanden ist). Am Unterkiefer war nur ein Typ vorhanden, die Dentalzähne. In jeder Kieferreihe hatte Mosasaurus (von vorne nach hinten): zwei Prämaxillarzähne, zwölf bis sechzehn Maxillarzähne und acht bis sechzehn Pterygoidzähne und vierzehn bis siebzehn Dentalzähne.[49][28][36][52] Die Anzahl der Zähne in der Maxillar-, Pterygoid- und Dentallage variiert zwischen Arten und manchmal sogar zwischen Individuen. M. hoffmannii hatte vierzehn bis sechzehn Maxillarzähne, vierzehn bis fünfzehn Dentalzähne und acht Pterygoidzähne;[28][40][41] M. missouriensis hatte vierzehn bis fünfzehn Maxillarzähne, vierzehn bis fünfzehn Dentalzähne und acht bis neun Pterygoidzähne;[49][36][53] M. conodon hatte vierzehn bis fünfzehn Maxillarzähne, sechzehn bis siebzehn Dentalzähne und acht Pterygoidzähne; M. lemonnieri hatte fünfzehn Maxillarzähne und 14 bis 17 Dentalzähne;[28][36] M. beaugei hatte zwölf bis dreizehn Maxillarzähne und vierzehn bis sechzehn Dentalzähne.[36] Einem unbestimmten Exemplar von Mosasaurus, das M. conodon aus dem staatlichen Park Pembina Gorge in North Dakota ähnelt, wurde eine ungewöhnliche Anzahl von 16 Pterygoidzähnen festgestellt, was einer weitaus höheren Anzahl als bei bekannten Arten entspricht.[52]
Mosasaurus hatte ein thekodontes Gebiss, was bedeutet, dass die Zahnwurzeln tief im Kieferknochen verankert waren. Mosasaurus hatte keine bleibenden Zähne und verlor sie häufig. Aus den Wurzeln des Originalzahns entwickelten sich in einer Resorptionsgrube Ersatzzähne durch einen achtstufigen Prozess, der für Mosasaurier einzigartig war. Die erste Stufe ist durch die Mineralisierung einer kleinen Zahnkrone gekennzeichnet, die an anderer Stelle entwickelt wurde und in der zweiten Stufe in die Resorptionsgrube wanderte. In der dritten Stufe zementierte sich die sich entwickelnde Krone fest in der Resorptionsgrube und wuchs an Größe; im vierten Stadium hatte es die gleiche Größe wie die Krone im Originalzahn. In den Stufen fünf und sechs entwickelte sich die Wurzel des Ersatzzahns: In Stufe fünf entwickelte sie sich vertikal und in Stufe sechs dehnte sich die Wurzel in alle Richtungen aus, bis der Ersatzzahn freigelegt wurde und auf den ursprünglichen Zahn drückte. In der siebten Stufe wurde der ursprüngliche Zahn abgestoßen und der nun unabhängige Ersatzzahn begann sich in der Lücke zu verankern. Im achten und letzten Stadium wuchs der Ersatzzahn, um sich fest zu verankern.[54] Chemische Untersuchungen an einem M. hoffmannii-Maxillarzahn schätzten die Dauer der Ablagerung von Odontoblasten, den für die Dentinbildung verantwortlichen Zellen, auf 511 Tage und die vollständige Entwicklung des Dentins auf 233 Tage.[55]
Postcraniales Skelett

Das vollständigste Skelett des Mosasaurus, dessen Identifikation auf Artenebene diskutiert wird[12][28] und das im Museum für Geologie der South Dakota School of Mines and Technology unter der Katalognummer SDSM 452 ausgestellt ist, hat sieben Halswirbel, achtunddreißig Rückenwirbel (einschließlich Brust- und Lendenwirbel) und acht Pygalwirbel (vordere Schwanzwirbel ohne Hämalbögen), gefolgt von achtundsechzig Schwanzwirbeln. Alle Mosasaurus-Arten hatten sieben Halswirbel, aber die Anzahl der anderen Wirbel variieren. Verschiedene Teilskelette von M. conodon, M. hoffmannii und M. missouriensis legen nahe, dass M. conodon wahrscheinlich bis zu sechsunddreißig Rückenwirbel und neun Pygalwirbel hatte; M. hoffmannii hatte wahrscheinlich bis zu zweiunddreißig Brustwirbel und zehn Pygalwirbel;[31][28] und M. missouriensis um dreiunddreißig Rückenwirbel, elf Pygalwirbel und mindestens neunundsiebzig Schwanzwirbel. M. lemmonieri hatte mit bis zu etwa vierzig Rückenwirbeln, zweiundzwanzig Pygalwirbeln und neunzig Schwanzwirbeln die meisten Wirbel der Gattung.[12][31] Im Vergleich zu anderen Mosasauriern war der Brustkorb von Mosasaurus ungewöhnlich tief und bildete einen nahezu perfekten Halbkreis, der ihm eine zylinderförmige Brust verlieh. Vermutlich verband Knorpel die Rippen flächendeckend mit dem Brustbein, was bei dem Wasserdruck in größeren Tiefen das Atmen erleichterte.[41] Die Knochentextur war praktisch identisch mit der moderner Wale, was impliziert, dass Mosasaurus wie diese ein hohes Maß an aquatischer Anpassungsfähigkeit und neutralem Auftrieb aufwies.[39]

Die Schwanzflosse war zweilappig und hypocerk, was bedeutet, dass die Schwanzwirbel den unteren Lappen stützten.[39] Die Schwanzstruktur ähnelt Verwandten wie Prognathodon, von dem 2013 erstmals Weichgewebe eines zweilappigen Schwanzes nachgewiesen wurde.[56] Die Wirbelkörper der Schwanzwirbel verkürzten sich allmählich zur Mitte des Schwanzes hin und verlängern sich hinter der Mitte, was auf eine Steifheit um die Schwanzmitte und eine ausgezeichnete Flexibilität dahinter hinweist. Wie bei den meisten höher entwickelten Mosasauriern bog sich der Schwanz nahe der Mitte leicht nach unten. Mosasaurus hatte große Hämalbögen, die sich nahe der Mitte des Schwanzes krümmten (im Gegensatz zur Verkürzung der Hämalbögen bei anderen Meeresreptilien wie Ichthyosauriern). Diese und andere Merkmale unterstützen einen großen und kräftigen paddelartigen Flossenschlag.[39]
Die Vordergliedmaßen von Mosasaurus waren breit und robust. Schulterblatt und Oberarmknochen waren fächerförmig und breiter als hoch. Radius und Ulna waren kurz, wobei der Radius etwas größer war. Fünf Sätze von Mittelhandknochen und Phalangen stützten die paddelförmigen Flossen, wobei der fünfte Satz kürzer und vom Rest abgesetzt war. Die Gesamtstruktur des Paddels war ähnlich wie bei Plotosaurus komprimiert und war gut für schnelleres Schwimmen geeignet.[41][28] In den Hintergliedmaßen wurde das Paddel mit vier Sätzen unterstützt. Das Darmbein war stäbchenförmig und schlank; bei M. missouriensis war es etwa 1,5-mal länger als der Femur. Der Femur war etwa doppelt so lang wie breit und endete in einem Paar unterschiedlicher Gelenkfortsätze, die sich in einem Winkel von ungefähr 120° trafen.[49]
Klassifikation
Geschichte der Taxonomie

Da die Regeln der Nomenklatur zu dieser Zeit nicht genau definiert waren, fertigten Wissenschaftler des 19. Jahrhunderts keine korrekte Erstbeschreibung von Mosasaurus an. Dies führte zu Unklarheiten hinsichtlich der Definition der Gattung, was dazu führte, dass sie zu einem sogenannten Mülleimer-Taxon wurde, das nahezu fünfzig verschiedene Arten enthielt. Das taxonomische Problem war so schwerwiegend, dass es Fälle von Arten gab, bei denen festgestellt wurde, dass sie Junior-Synonyme von Arten waren, die selbst Junior-Synonyme waren (beispielsweise wurden vier Taxa zu Junior-Synonymen von M. maximus, der selbst zu einem Junior-Synonym von M. hoffmannii wurde). Dieses Problem wurde von vielen damaligen Wissenschaftlern erkannt, aber Bemühungen, die Taxonomie von Mosasaurus zu bereinigen, wurden durch das Fehlen einer eindeutigen Diagnose behindert.[26][12]
1967 veröffentlichte Russell die Systematics and Morphology of American Mosasaurs, die eine der frühesten richtigen Diagnosen von Mosasaurus enthielten. Obwohl seine Arbeit als unvollständig angesehen wird, da er ausschließlich an nordamerikanischen Vertretern arbeitete und keine europäischen Vertreter wie M. hoffmannii untersuchte, konnte Russell das Taxon erheblich überarbeiten und eine Diagnose der Gattung erstellen, die klarer war als frühere Beschreibungen. Er identifizierte acht Arten, die er für gültig hielt – M. hoffmannii, M. missouriensis, M. conodon, M. dekayi, M. maximus, M. gaudryi, M. lonzeensis und M. ivoensis.[26][12] Wissenschaftler überarbeiteten dies in den späten 1990er und frühen 2000er Jahren weiter: M. maximus wurde von Mulder (1999) mit M. hoffmannii synonymisiert (obwohl einige Wissenschaftler die Ansicht vertreten, dass es sich um eine eigenständige Art handelt)[26][12], die ehemals ungültige Art M. lemonnieri wurde von Lingham-Soliar (2000) wiederbelebt, M. ivoensis und M. gaudryi wurden von Lindgren und Siverson (2002) bzw. Lindgren (2005) in die Gattung Tylosaurus überführt und M. dekayi und M. lonzeensis wurden Nomina dubia. Während des späten 20. Jahrhunderts beschrieben Wissenschaftler vier weitere Arten anhand von Fossilien, die im Pazifik gefunden wurden – M. mokoroa, M. hobetsuensis, M. flemingi und M. prismaticus.[57][26][12] 1995 veröffentlichte Lingham-Soliar eine der frühesten modernen Diagnosen von M. hoffmannii, die detaillierte Beschreibungen der bekannten Anatomie der Typusart auf der Grundlage einer Vielzahl von Fossilien aus Lagerstätten in der Umgebung von Maastricht lieferte.[41] Es wurde jedoch kritisiert, dass sie sich eher auf andere Exemplare als nur auf den Holotyp stützte (obwohl es normalerweise üblich ist, eine Artendiagnose anhand der Typusproben zu erstellen), insbesondere auf IRSNB R12, einen fossilen Schädel des Royal Belgian Institute, dessen Zuordnung zu Mosasaurus fraglich war.[26][12]

Die 2016 publizierte Dissertation des Paläontologen Halle Street der University of Alberta, betreut von Michael Caldwell, enthielt die erste ordnungsgemäße Beschreibung und Diagnose von M. hoffmannii ausschließlich anhand seines Holotyps seit seiner Benennung vor über zweihundert Jahren. Diese Neubewertung des Holotyp-Exemplars verdeutlichte die Schwierigkeiten, mit denen frühere Forscher konfrontiert waren, und ermöglichte eine signifikante taxonomische Überarbeitung von Mosasaurus. In der Arbeit wurde eine phylogenetische Studie durchgeführt, in der die Beziehungen zwischen M. hoffmannii und zwölf möglichen Mosasaurus-Arten untersucht wurden – M. missouriensis, M. dekayi, M. gracilis, M. maximus, M. conodon, M. lemonnieri, M. beaugei, M. ivoensis, M. Mmokoroa, M. hobetsuensis, M. flemingi und M. prismaticus. Von den zwölf Kandidatenarten erwiesen sich nur M. missouriensis und M. lemonnieri als unterschiedliche Arten innerhalb der Gattung. M. beaugei, M. dekayi und M. maximus wurden als Junior-Synonyme von M. hoffmannii identifiziert. Die Platzierung von M. gracilis und M. ivoensis außerhalb der Unterfamilie Mosasaurinae wurden ebenfalls bestätigt. M. hobetsuensis und M. flemingi wurden als Vertreter von Moanasaurus identifiziert und entsprechend umbenannt. M. mokoroa und M. prismaticus wurden als verschiedene Gattungen identifiziert, die Antipodinectes und Umikosaurus genannt wurden. Es wurde festgestellt, dass Funde von M. conodon aus dem Western Interior Seaway zu M. missouriensis gehören, während Funde von der Ostküste (einschließlich des Holotyps) zu einer neuen Gattung gehören, die später Aktisaurus genannt wurde. Schließlich ergab die Studie, dass der IRSNB R12-Schädel zu einer Mosasaurus-Art gehörte, die M. glycys genannt wurde, wobei das Epitheton eine Romanisierung des altgriechischen Wortes γλυκύς (ɡlykýs, was „süß“ bedeutet) ist (in Bezug auf den Aufenthaltsort des Schädels in Belgien und den Ruf des Landes als Schokoladenproduzent). Street erklärte in ihrer Dissertation, dass der Inhalt als wissenschaftliche Arbeit veröffentlicht werden soll.[12]
Die Diagnose des Mosasaurus-Holotyps wurde in einem von Experten (unter anderem Caldwell) verfassten Artikel aus dem Jahr 2017 veröffentlicht. Die taxonomische Überarbeitung der Gattung muss noch offiziell veröffentlicht werden, in Street und Caldwell (2017)[26] wird jedoch bereits darauf verwiesen und es wurden zwei Zusammenfassungen während des 5. Dreijahres-Mosasaurier-Treffens 2016[58] und des 5. Jahrestreffens der Canadian Society of Vertebrate Palaeontology im Jahr 2017[59] vorgestellt. Street und Caldwell (2017) präsentierten außerdem eine kurze vorläufige taxonomische Übersicht über Mosasaurus, in der fünf wahrscheinlich gültige Arten auf der Grundlage früherer Literatur – M. hoffmannii, M. missouriensis, M. conodon, M. lemonnieri und M. beaugei – identifiziert und die vier pazifischen Arten als möglicherweise gültig betrachtet werden, bis in Zukunft eine formelle Neubewertung erfolgt. M. dekayi wurde in die Liste der möglichen gültigen Taxa aufgenommen, ohne dass sein zweifelhafter Status angesprochen wurde, jedoch als wahrscheinliches Synonym für M. hoffmannii beschrieben.[26]
Systematik und Evolution
Als Typusgattung der Familie Mosasauridae und der Unterfamilie Mosasaurinae gehört Mosasaurus zur Ordnung Squamata (bestehend aus Echsen und Schlangen). Mosasaurus bildet zusammen mit den Gattungen Eremiasaurus, Plotosaurus[60] und Moanasaurus[59] (nach Auffassung mancher Autoren außerdem Prognathodon und Plesiotylosaurus[61], bei denen es sich aber vermutlich um basalere Mosasaurier handelt[62]) einen Tribus, der Mosasaurini oder Plotosaurini genannt wird.[33][60][63]
Verwandtschaft zu Schlangen und Waranen
Die genaue Einordnung der Mosasaurier innerhalb der Schuppenkriechtiere und damit die Beziehung von Mosasaurus zu modernen Reptilien ist von Anfang an umstritten. Cuvier war der erste Wissenschaftler, der die mögliche taxonomische Stellung von Mosasaurus eingehend analysierte. Während seine ursprüngliche Hypothese von 1808, dass die Gattung eine Echse mit Ähnlichkeit zu Waranen war, am beliebtesten blieb, war Cuvier selbst über die Richtigkeit dieser Einordnung unsicher. Er schlug eine Reihe alternativer Hypothesen vor, beispielsweise dass Mosasaurus stattdessen enger mit Leguanen verwandt war, denn beide hatten Pterygoidzähne. Zu Beginn und Mitte des 19. Jahrhunderts gab es wenige Fossilien von Mosasauriern, sodass sich die Wissenschaft hauptsächlich auf stratigraphische Assoziationen und Cuviers Forschungsergebnisse der 1808er Jahre zum Holotyp-Schädel stützte. Daher wurden eingehende Untersuchungen zur Einordnung von Mosasaurus erst durchgeführt, als im späten 19. Jahrhundert vollständigere Mosasaurier-Fossilien entdeckt wurden, die die Forschung zur Stellung von Mosasauriern unter den Schuppenkriechtieren wieder aufleben ließen.
In einer Zeitspanne von etwa 30 bis 40 Jahren im späten 19. bis frühen 20. Jahrhundert diskutierten Paläontologen heftig über das Thema, was zwei wichtige Theorien hervorbrachte: eine, die eine Verwandtschaft zu Waranen unterstützte, und eine, die eine engere Verwandtschaft zu Schlangen unterstützte.[38] Eine solche Hypothese wurde erstmals 1869 von Cope veröffentlicht, der vorschlug, dass Mosasaurier, die er einer Gruppe namens Pythonomorpha zuordnete, die Schwestergruppe der Schlangen waren. Einige Wissenschaftler gingen so weit, Mosasaurier als direkte Vorfahren von Schlangen zu interpretieren.[64] Gegner, die eine Beziehung zu Waranen unterstützten, argumentierten, dass Mosasaurier innerhalb der Teilordnung Anguimorpha platziert werden sollten; entweder als echte Warane innerhalb der Familie Varanidae oder taxonomisch weiter entfernt.[38] Diese Debatten führten zur Gründung höherer taxonomischer Gruppen, um die Mosasaurier einzuschließen (obwohl sich nicht alle als korrekt herausstellten). Eine davon war die Mosasauria, eine lose definierte Gruppe, die 1880 von Marsh gegründet wurde. Der Begriff wird bis heute von einigen Wissenschaftlern verwendet und schließt alle Nachkommen des letzten gemeinsamen Vorfahren von Mosasaurus und einigen anderen Arten (wie Dolichosaurus, Coniasaurus und Adriosaurus) ein.[65] Im Jahr 1923 veröffentlichte Charles Lewis Camp von der University of California in Berkeley die Klassifikation der Echsen, in der er durch Überprüfung früherer Theorien und unter Anwendung seiner eigenen anatomischen Beobachtungen vorschlug, dass alle Taxa, die enger mit Mosasaurus als mit Dolichosaurus verwandt sind, als Mosasauroidea klassifiziert werden sollten, eine Schwester-Überfamilie der Varanoidea.[38][66] Camps Einteilung wurde für ungefähr 70 Jahre überwiegend akzeptiert, wobei fast alle nachfolgenden Studien eine Verwandtschaft zu Waranen unterstützten. Viele Studien ordneten die Mosasaurier dabei jedoch weiterhin innerhalb der Varanoidea ein.[38]
Die Debatte wurde mit der Veröffentlichung einer kladistischen Studie des Paläontologen Michael Lee von der Universität Sydney aus dem Jahr 1997 wiederbelebt, in der er die Mosasauroidea als Schwestertaxon der Schlangenunterordnung Serpentes einordnete.[38][67] Es handelte sich um die erste moderne phylogenetische Studie, in der die Verwandtschaftsverhältnisse zwischen Mosasauriern und Schlangen speziell untersucht wurden. Lee definierte außerdem die nicht mehr bestehende Gruppe Pythonomorpha neu, um die Mosasauroidea und Serpentes darin zu vereinen.[67] Mehrere nachfolgende Studien, die von Wissenschaftlern wie Lee, Caldwell und Alessandro Palci von der Universität Modena und Reggio Emilia durchgeführt wurden, konkretisierten diese Hypothese. In einigen Studien wurde die Mosasauria-Klade verwendet, um Mosasaurier darzustellen;[38][64] hierbei bestand jedoch noch wenig Konsens. Zum Beispiel stellte eine groß angelegte phylogenetische Studie des Paläontologen Jack Conrad vom American Museum of Natural History aus dem Jahr 2008 die Mosasauria-Klade in einer Polytomie oder unkonkreten Schwesterbeziehung mit Waranen und Krustenechsen wieder her;[65] und eine Studie von 2012 unter der Leitung von Jacques Gauthier von der Yale University stellte die Mosasauria als Schwestergruppe sowohl den Waranen, als auch den Schlangen gegenüber.[68]
Mit dem Aufkommen der Molekulargenetik in den 2010er Jahren plädierten einige Wissenschaftler für die Kombination molekularer und morphologischer Daten, um die Beziehungen zwischen Mosasauriern und lebenden Schuppenkriechtieren zu untersuchen.[69][70] Lee (2009) veröffentlichte eine frühe Studie, die auf nuklearer und mitochondrialer DNA lebender Schuppenkriechtiere und morphologischen Daten von Mosasauriern basierte und die Mosasaurier erneut als Stammgruppe der Schlangen darstellte[71] (was einige spätere Autoren als Einordnung der Schlangen innerhalb der Mosasaurier-Klade interpretierten). Eine 2010 von John Weins und mehreren Autoren der Stony Brook University durchgeführte Studie versuchte, Lee (2009) unter Verwendung eines größeren Datensatzes zu replizieren, lieferte jedoch Ergebnisse, die die Mosasauria als Schwesterklade der Warane bestätigten.[69]
Die Diskrepanzen der Ergebnisse sind auf das hohe Maß konvergenter Evolution bei Schuppenkriechtieren zurückzuführen, die viel Raum für die Interpretation molekularer und morphologischer Daten schafft und Widersprüche erzeugt. Aus diesem Grund argumentierten einige Wissenschaftler, dass eine molekulare Perspektive vollständig aufgegeben werden sollte.[70][72] Dennoch versuchten Wissenschaftler, diese Schwierigkeiten zu klären. Ein Ansatz bot eine 2015 von Todd Reeder und mehreren Autoren von der San Diego State University durchgeführten Studie: Sie integrierte morphologische, molekulare und paläontologische Daten eng in einen großen Datensatz, um frühere Konflikte zu überwinden. Dies ergab eine neue morphologische Übereinstimmung mit molekularen Ergebnissen, die die Mosasauria als Schwesterklade der Serpentes bestätigten.[70] Ein anderer Ansatz wurde von dem Biologen R. Alexander Pyron von der George Washington University in einer Studie aus dem Jahr 2016 entwickelt; diese verwendete einen asymmetrischer Ansatz zur Interpretation einiger problematischer morphologischer Datensätze neben molekularen Daten, wodurch die Mosasauria ebenfalls als Schwesterklade der Serpentes bestätigt wurden.[73]
Phylogenie und Evolution der Gattung
.jpg.webp)
Einer der frühesten relevanten Versuche einer evolutionären Studie über Mosasaurus wurde von Russell (1967) durchgeführt[63], der die Ansicht vertrat, dass sich Mosasaurus aus einem Clidastes-ähnlichen Mosasaurier entwickelte und sich in zwei Linien aufspaltete: eine führte zu M. conodon und eine andere erzeugte eine Chronospezies-Sequenz, die in der Reihenfolge des Auftretens M. ivoensis, M. missouriensis und „M. maximus-hoffmanni“ (mit dem Namen schloss er aufgrund ihrer engen Verwandtschaft M. maximus und M. hoffmanni ein) enthielt.[33] Russell verwendete jedoch eine primitive Methode der Phylogenetik, da die Kladistik noch nicht weit verbreitet war.[63]
1997 veröffentlichte Bell dann die erste kladistische Studie über nordamerikanische Mosasaurier. Einige seiner Ergebnisse, die auf Untersuchungen der Arten M. missouriensis, M. conodon, M. maximus und eines unbestimmten Exemplars des State Museum der Universität von Nebraska (UNSM 77040) basieren, stimmen mit Russell (1967) überein, wie beispielsweise dass Mosasaurus und Clidastes von einem gemeinsamen Vorfahren abstammen und M. conodon die basalste Art der Gattung ist. Im Gegensatz zu Russell[33] stellte Bell auch fest, dass Mosasaurus in einer Schwesterbeziehung zu einer anderen Gruppe stand, zu der Globidens und Prognathodon gehörten, und dass M. maximus ein Schwestertaxon von Plotosaurus war. Letzteres machte Mosasaurus paraphyletisch, aber Bell erkannte Plotosaurus dennoch als eigenständige Gattung an.[63] Bell Studie diente als Grundlage für spätere Studien, die die Systematik von Mosasaurus meist unverändert ließen[12][49], obwohl einige spätere Studien je nach Interpretation der Daten Eremiasaurus oder Plesiotylosaurus anstatt von Plotosaurus als Schwestertaxa von Mosasaurus einordneten.[61][60][74] In mindestens einer Studie wurde auch festgestellt, dass M. missouriensis anstelle von M. conodon die basalste Art der Gattung ist.[75] Dies führte zu einer Reihe von Problemen. Erstens war die Gattung stark unterrepräsentiert, weil nur die drei nordamerikanischen Arten M. hoffmannii / M. maximus, M. missouriensis und M. conodon einbezogen und andere Arten wie M. lemonnieri als eine der bekanntesten Arten der Gattung vernachlässigt wurden, was sich auf die phylogenetischen Ergebnisse auswirkte.[12] Zweitens stützten sich die Studien aufgrund des Fehlens einer eindeutigen Holotypdiagnose auf eine unreine und wackelige Taxonomie der Gattung, die möglicherweise die Ursache für den paraphyletischen Status der Gattung ist.[12][49] Drittens fehlten zu dieser Zeit noch vergleichende Studien zur Skelettanatomie großer Mosasaurinae.[12] Diese Probleme wurden in Street (2016) angesprochen, der auch eine aktualisierte phylogenetische Analyse durchführte.[49]


Conrad (2008) berücksichtigte in seiner phylogenetischen Analyse nur M. hoffmannii und M. lemonnieri. Diese stellte M. hoffmannii als basal für eine Vielzahl von Nachkommen-Kladen wie (von basal nach modern geordnet) Globidens, M. lemonnieri, Goronyosaurus und Plotosaurus dar. Dieses Ergebnis würde bedeuten, dass M. hoffmannii und M. lemonnieri verschiedene Gattungen darstellen.[65] Die Studie verwendete jedoch eine Methode, die für traditionelle phylogenetische Studien an Mosasaurierarten unorthodox war, da der Schwerpunkt eher auf einer höheren als auf einer niederen Klassifizierung lag. Infolgedessen warnen einige Paläontologen, dass Conrads Ergebnisse einer niederen Klassifizierung (wie die spezifische Platzierung von Mosasaurus innerhalb der Mosasauria) technische Probleme enthalten können, die sie ungenau machen können.[74]

Das folgende Kladogramm auf der linken Seite (Topologie A) wurde mit einer Bayesschen Analyse in der jüngsten großen phylogenetischen Studie der Mosasaurinae-Unterfamilie von Madzia & Cau (2017) erstellt, die selbst als Weiterentwicklung einer größeren Studie von Simões et al. (2017) beschrieben wurde.[61] Das Kladogramm auf der rechten Seite (Topologie B) ist der Doktorarbeit von Street aus dem Jahr 2016 entnommen, in der eine Überarbeitung der Mosasaurinae vorgeschlagen wird. Da die Arbeit kein Peer-Review-Verfahren durchlaufen hat,[12] wird sie von Madzia & Cau (2017) nicht zitiert.[61]
| Topologie A: nach Madzia & Cau (2017)[61] | Topologie B: nach Street (2016)[12] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Paläobiologie
Muskulatur und Funktionsweise des Kopfs

Ein Großteil des Wissens über die Muskulatur und Mechanik des Kopfes des Mosasaurus basiert auf Lingham-Soliars 1995er Studie über M. hoffmannii-Schädel. Da weiches Gewebe wie Muskeln nicht leicht versteinert, basiert die Rekonstruktion der Kopfmuskulatur weitgehend auf der Struktur des Schädels, der Art der Muskelvernarbung am Schädel und der Muskulatur rezenter Warane.[41]
Bei modernen Echsen ist der mechanische Aufbau des Schädels durch eine geometrische Struktur mit vier Drehpunkten im Schädel gekennzeichnet, die eine flexible Bewegung der Kiefer ermöglicht, was ihnen Vorteile bei der Jagd verschafft. Allerdings zeichnet sich der Schädel von M. hoffmannii durch eine starrere Schädelstruktur mit drei Drehpunkten aus, die darauf hinweist, dass sich die Kiefermechanik von modernen Echsen unterschied; dessen Schädelstrukturen werden durch starke ineinandergreifende Nähte verbunden, die Druck- und Scherkräften widerstehen können, die durch einen Abwärtsschub der Unterkiefermuskulatur oder einen Aufwärtsschub der Beute verursacht werden. Diese starre, aber stark stoßabsorbierende Struktur des Schädels ermöglichte wahrscheinlich eine starke Beißkraft während der Beutejagd.[41]
Wie bei allen Mosasauriern konnten die Unterkiefer von Mosasaurus durch Adduktion vorwärts und rückwärts schwingen. Bei vielen Mosasauriern wie Prognathodon und M. lemonnieri diente diese Funktion hauptsächlich dazu, die Beute mit Pterygoid und Kiefer wie auf einem Förderband in den Rachen zu befördern. Insbesondere im Vergleich zu M. lemonnieri sind die Pterygoidzähne bei M. hoffmannii jedoch relativ klein, was darauf hinweist, dass diese Funktion beim Jagen und Fressen relativ unwichtig war.[41][31] Vielmehr schluckte M. hoffmannii seine Beute vermutlich ganz und nutzte Kieferadduktion, um die Bissstärke zu erhöhen. Die großen Adduktor-Muskeln (Muskeln, die den Unterkiefer am Schädel befestigen und eine wichtige Rolle bei der Beißfunktion spielen) sind massiv, was darauf hinweist, dass M. hoffmannii zu sehr kräftigen Bissen fähig war. Der lange, schmale und schwere Unterkiefer und die Sehnen am den Muskelfortsätzen ermöglichten ein schnelles Öffnen und Schließen des Mauls mit geringem Energieeinsatz unter Wasser, was ebenfalls zur starken Bisskraft von M. hoffmannii beitrug; dies legt nahe, dass die starken Magnus-Depressor-Muskeln (Kieferöffnungsmuskeln), die einige Plesiosaurier hatten, gar nicht nötig wären.[41]
Mobilität und Thermoregulation

Mosasaurus nutzte für die Fortbewegung seinen Schwanz. Vermutlich war der Schwimmstil subcarangiform (wie beispielsweise bei Makrelen).[39][76] Seine länglichen, paddelartigen Gliedmaßen dienten wie bei einem Tragflügelboot zum Manövrieren. Die Lenkfunktion der Paddel wurde durch eine große Muskelbefestigung von der nach außen gerichteten Seite des Humerus zum Radius und zur Ulna sowie durch eine verbesserte Pronationsfähigkeit unterstützt, die durch modifizierte Gelenke ermöglicht wurde. Die starken Kräfte, die die Verwendung der Paddel erzeugten, konnten zu Knochenschäden führen, wie ein M. hoffmannii-Ilium mit erheblichen Trennungsschäden von Gelenkende und Schaft, die wahrscheinlich durch häufige Scherkräfte am Gelenk verursacht wurden, zeigt.[41]
Die Gewebestruktur von Mosasaurus-Knochen legt nahe, dass seine Metabolismusrate viel höher war als bei modernen Schuppenkriechtieren und er einen Grundumsatz zwischen dem der Lederschildkröte und dem von Ichthyosauriern und Plesiosauriern hatte.[77] Gemessen an seinem hohen Energieverbrauch war Mosasaurus wahrscheinlich endotherm. Aus Studien zur Biochemie verwandter endothermer Mosasauriergattungen wie Clidastes kann geschlussfolgert werden, dass wahrscheinlich alle Mosasaurier endotherm waren, auch wenn keine Studien zu Mosasaurus existieren. Ein solches Merkmal ist unter Schuppenkriechtieren einzigartig, die einzige bekannte Ausnahme ist der saisonal endotherme Schwarzweiße Teju.[78] Die Endothermie verschaffte Mosasaurus vermutlich mehrere Vorteile wie eine erhöhte Ausdauer bei der Nahrungssuche in größeren Gebieten und bei der Verfolgung von Beute.[79] Möglicherweise ermöglichte dies Mosasaurus auch, sich in den kälteren Klimazonen wie der Antarktis zu verbreiten.[79][80][81][82]
Sensorische Funktionen

Mosasaurus hatte relativ große Augenhöhlen[41] mit großen Skleralringen, die einen Großteil des Durchmessers der Augenhöhlen einnahmen.[31] Dies deutet darauf hin, dass Mosasaurus auch große Augen und eine gute Sicht hatte. Die Augenhöhlen befanden sich an den Seiten des Schädels, was ein mit etwa 28,5 °[41][83] recht kleines binokulares Blickfeld ermöglichte, jedoch für ein großes Gesamtblickfeld mit hervorragender Verarbeitung einer zweidimensionalen Umgebung sorgte. Da Mosasaurus wahrscheinlich nahe der Oberfläche in offenen Gewässern lebte, war er auf dreidimensionales Sehen kaum angewiesen.[41]
Grigoriev (2016) beschrieb ein Teil des Innenohrs von Mosasaurus anhand eines unvollständigen Fossils. Das Innenohr spielt eine wichtige Rolle für Mobilität, Feingefühl und Gleichgewicht von Tieren. Mosasaurier-Innenohren wurden in der Vergangenheit untersucht, jedoch ausschließlich mit Arten außerhalb der Mosasaurini. Im Mosasaurus sind die Endpunkte des hinteren und seitlichen Bogengangs, die zur Kontrolle des Gleichgewichtssinns beitragen, voneinander getrennt; bei anderen Mosasauriern sind die Enden dagegen miteinander verschmolzen, was jedoch auf eine unvollständige Erhaltung der Fossilien zurückzuführen sein könnte. Der seitliche Bogengang ist groß und misst bei einem Mosasaurus mit 14 Metern Länge 25,3 Millimeter. Im Gegensatz zu modernen Walen, bei denen die Bogenganggröße sich unterscheidet, verursachte dieses Merkmal bei Mosasauriern vermutlich keinen Unterschied in der Innenohrempfindlichkeit, da die Proportionen zwischen Bogenganggröße und Schädellänge bei modernen Waranen und kleineren Mosasauriern wie Platecarpus sehr ähnlich sind.[84]
Gehirnabdrücke mit Mosasaurus-Schädeln zeigen, dass der Riechkolben und das Jacobson-Organ, die die Geruchsfunktion steuern, schlecht entwickelt sind und bei M. hoffmannii eine Reihe von Bestandteilen fehlen, was darauf hindeutet, dass die Art einen extrem schlechten Geruchssinn hatte. Bei M. lemonnieri sind diese Riechorgane, obwohl sie klein sind, besser entwickelt. Dies führt zu der Annahme, dass andere Sinne wie die gut entwickelte visuelle Wahrnehmung nützlicher waren.[41]
Ernährung
Obwohl es kaum direkte Hinweise auf die Ernährungsgewohnheiten von Mosasaurus gibt, sind sich Paläontologen im Allgemeinen einig, dass es sich um ein aktives Raubtier handelte, das eine Vielzahl von Meerestieren gejagt hat, darunter Knochenfische, Haie, Kopffüßer, Vögel und Meeresreptilien wie andere Mosasaurier oder Schildkröten. Aufgrund seines schlechten Geruchssinns ist es unwahrscheinlich, dass Mosasaurus ein Aasfresser war. Mosasaurus gehörte zu den größten Meerestieren seiner Zeit und mit seinen großen, robusten und scharfen Zähnen konnte er ausgewachsen vermutlich nahezu jedes Tier erbeuten. Lingham-Soliar (1995) vermutete, dass Mosasaurus ein eher „wildes“ Jagdverhalten aufwies, wie große Zahnspuren an Rillen der großen Meeresschildkröte Allopleuron hoffmanni und Fossilien von gebrochenen und wieder verheilten Kiefern bei M. hoffmannii zeigten. Die Art jagte wahrscheinlich in der Nähe der Meeresoberfläche, erspähte mit ihren großen Augen die Beute und griff sie aus dem Hinterhalt an.[41][50] Chemische und strukturelle Daten der Fossilien von M. lemonnieri und M. conodon legen nahe, dass sie möglicherweise auch in tieferen Gewässern gejagt haben.[85]
Kohlenstoffisotopstudien an Fossilien mehrerer M. hoffmannii-Individuen haben extrem niedrige Werte von δ13C gefunden, die niedrigsten aller Mosasaurier. Es gibt verschiedene Implikationen für δ13C-Spiegel bei der Ernährung von Mosasauriern. Die Beziehung zwischen den δ13C-Spiegeln bei Mosasauriern und ihren trophischen Spiegeln ist negativ korreliert. Mosasaurier mit niedrigeren δ13C-Werten besetzten tendenziell höhere trophische Werte. Ein Faktor dafür ist die Ernährung; Beute wie Meeresschildkröten und andere große Meeresreptilien, die reich an Lipiden sind, können die δ13C-Werte senken. Das niedrige δ13C-Level von M. hoffmannii deutet auf seine Position als Spitzenprädator hin.[50]
Derzeit ist nur ein Beispiel für einen mit Mageninhalt konservierten Mosasaurus bekannt: ein gut erhaltenes Teilskelett eines kleinen M. missouriensis, das etwa 75 Millionen Jahre alt ist. Bei der Analyse des Mageninhalts wurden die zerstückelten und durchstochenen Überreste eines 1 Meter langen Fisches gefunden. Dieser Fisch ist viel länger als die Länge des 66 Zentimeter langen Mosasaurus-Schädels, was bestätigt, dass M. missouriensis seine Beute zerkleinerte und stückweise verschlang. Die Anwesenheit anderer großer Mosasaurier wie Prognathodon, die sich auf starke Beute spezialisiert haben und mit M. missouriensis koexistierten, deutet stark darauf hin, dass sich die Art als ein Beispiel für Nischendifferenzierung wahrscheinlich mehr auf Beute spezialisiert hat, die er mit seinen zum Schneiden angepassten Zähnen gut erbeuten konnte.[49]
Ein Fund des fossilen Nautiloideen Argonautilus catarinae mit Bissspuren von zwei konspezifischen Mosasauriern, von denen einer von einem juvenilen und der andere von einem adulten Tier stammt, könnte darauf hindeuten, dass Mosasaurus seinen Nachkommen das Jagen beigebracht hat. Die Analyse der Zahnspuren ergab, dass sie entweder von Mosasaurus oder Platecarpus stammen. Die Positionierung beider Bissspuren erfolgt in der Richtung, in die der Nautiloidee zeigte, was darauf hinweist, dass er nicht entkommen konnte und daher bereits während der Angriffe krank oder tot war. Es ist möglich, dass dieses Phänomen von einem Mosasaurier stammt, der seinen Nachkommen beibringt, dass Kopffüßer eine alternative Beutequelle sind und wie man sie jagt. Eine alternative Erklärung ist, dass die Bissspuren von einem einzelnen Mosasaurier stammen, der zuerst leicht in das Tier gebissen und dann wieder mit größerer Kraft zugebissen hat. Unterschiede im Zahnabstand zwischen beiden Bissen weisen jedoch auf unterschiedliche Kiefergrößen hin, was die erste Hypothese wahrscheinlicher macht.[86]
Intraspezifischer Kampf
_(14780145004).jpg.webp)
Es gibt fossile Beweise dafür, dass Mosasaurus aggressive und tödliche Kämpfe mit anderen Individuen derselben Art geführt hat. Ein teilweise erhaltenes M. conodon-Fossil wies mehrere Schnitte, Brüche und Einstiche an verschiedenen Knochen, insbesondere in den hinteren Teilen des Schädels und des Halses, sowie einem Zahn eines anderen M. conodon-Individuums im Os quadratum. Die Verletzungen des Fossils zeigen keine Anzeichen von Heilung, was darauf hinweist, dass der Mosasaurier von seinem Angreifer durch einen Biss in den Schädel getötet wurde.[87] Ein weiteres Beispiel ist ein M. missouriensis-Skelett mit einem Zahn eines anderen M. missouriensis, der im Unterkiefer unter dem Auge steckt. In diesem Fall gab es Anzeichen einer Heilung um die Wunde herum, was darauf hinweist, dass das Opfer den Vorfall überlebt hat.[47] Konishi schlug jedoch eine alternative Erklärung vor, nämlich Bisse in den Kopf während der Balz, wie es bei modernen Echsen der Fall ist.[88] Es gibt mehrere andere bekannte Fossilien von Mosasaurus-Schädeln, die Anzeichen schwerer Verletzungen aufweisen, von denen einige wahrscheinlich tödlich waren oder zu Infektionen führten und die wahrscheinlich durch Angriffe anderer Mosasaurus verursacht wurden. Eine weitere mögliche Erklärung für einige dieser Verletzungen ist der Versuch, harte Schildkrötenpanzer zu zerbbeißen. Es fällt auf, dass viele der Verletzungen im Schädel konzentriert sind; dies könnte darauf hindeuten, dass Mosasaurus während des intraspezifischen Kampfes wie auch moderne Krokodile (die andere Krokodile angreifen, indem sie den Kopf ihres Gegners mit den Kiefern festhalten) Kopfangriffe einsetzte. Viele der Fossilien mit Verletzungen, die möglicherweise auf intraspezifische Kämpfe zurückzuführen sind, stammen von juvenilen oder subadulten Mosasaurus, was die Möglichkeit bietet, dass Angriffe auf kleinere, schwächere Exemplare häufiger aufgetreten sind.[89] Die angreifenden Individuen von M. conodon und M. missouriensis waren jedoch wahrscheinlich ähnlich groß wie die Opfer.[87][47] Einige Wissenschaftler spekulieren, dass Mosasaurus gelegentlich kannibalistisch lebte.[90]
Verlauf des Lebens

Es ist wahrscheinlich, dass Mosasaurus lebendgebärend war. Bei Mosasaurus selbst gibt es keine Hinweise auf Viviparie, aber das ist bei einigen anderen Mosasauriern bekannt: Beispiele sind ein Skelett des schwangeren basalen Mosasauriden Carsosaurus, ein Plioplatecarpus-Fossil, das mit den Fossilien zweier Mosasaurier-Embryonen assoziiert ist, und Fossilien neugeborener Clidastes aus pelagischen Ablagerungen. Solche Fossilienbestände sprechen zusammen mit dem völligen Fehlen jeglicher Hinweise auf eine Eiablage für Viviparie bei Mosasaurus.[91][92] Mikroanatomische Studien an Knochen juveniler Mosasaurus und verwandter Gattungen ergaben, dass ihre Knochenstrukturen mit denen von adulten Tieren vergleichbar sind und keine Zunahme der Knochenmasse zeigten, wie es bei juvenilen primitiven Mosasauriden zur Unterstützung des Auftriebs bei einem Leben in seichtem Wasser festgestellt wurde; das bedeutet, dass Mosasaurus ein Nestflüchter war. Bereits in einem sehr jungen Alter waren sie effizienter Schwimmer mit funktionsfähiger Lebensweise im offenen Wasser; das erforderte keine separaten Aufwuchsgebiete.[93][91] An einigen Orten in Europa und South Dakota wurden jedoch Ansammlungen von juvenilen M. hoffmannii, M. missouriensis und/oder M. lemonnieri gefunden. Diese Orte sind ausschließlich Ablagerungen flacher Ozeane, was darauf hindeutet, dass juvenile Mosasaurus sich möglicherweise in seichtem Wasser aufhielten.[94]
Paläopathologie

Mit seiner offensichtlich „wilden“[89] Lebensweise gibt es eine Reihe bekannter Fossilien von M. hoffmannii, die schwere physisch verursachte Schäden aufweisen. Zwei Beispiele sind IRSNB R25 und IRSNB R27 vom Royal Belgian Institute of Natural Science, die beide Frakturen und andere Beschädigungen in ihren Zahnknochen aufweisen. IRSNB R25 weist eine vollständige Fraktur nahe dem sechsten Zahnfach auf. Um die Fraktur herum befinden sich umfangreiche Mengen knöchernen Kallus´, die fast über das Zahnfach hinauswachsen, sowie verschiedene osteolytische Hohlräume, Abszesskanäle, Schäden am Trigeminus und entzündete Erosionen, die eine schwere bakterielle Infektion anzeigen. Es gibt zwei fein vereiterte Kratzer am Knochenkallus, die sich möglicherweise im Rahmen des Heilungsprozesses entwickelt haben. Die Probe IRSNB R27 weist zwei Frakturen auf: Eine ist fast vollständig verheilt und die andere ist eine offene Fraktur, bei der in der Nähe befindliche Zähne abgebrochen sind. Die Fraktur ist mit einer Pseudarthrose eines Knochenkallus mit flachen Kratzspuren und einer großen Grube bedeckt, die mit einem Abszesskanal verbunden ist. Beide Proben zeigen neben den Frakturen Anzeichen einer tiefen bakteriellen Infektion. Einige Bakterien haben sich möglicherweise auf nahegelegene beschädigte Zähne ausgebreitet und Karies verursacht, der möglicherweise von früheren posttraumatischen oder sekundären Infektionen in tieferes Gewebe eingedrungen ist. Die Zähne vor den Frakturen sind jedoch bei beiden Proben in gutem Zustand, was darauf hindeutet, dass Arterien und Trigeminusnerv nicht beschädigt wurden. Wenn dies der Fall gewesen wäre, wären diese Körperteile wegen Blutmangels nekrotisiert. Der Zustand der Zähne deutet darauf hin, dass möglicherweise ein effizienter Prozess zur Stilllegung der Fraktur während der Heilung stattfand, was dazu beigetragen haben könnte, Schäden an lebenswichtigen Blutgefäßen und Nerven zu verhindern. Dies und die Anzeichen der Heilung bedeuten auch, dass die Frakturen nicht unmittelbar tödlich waren. Die Ursache der Verletzungen kann nicht sicher bestimmt werden; es gibt jedoch zwei Möglichkeiten. Eine Möglichkeit könnte eine Kollateralschädigung durch einen Biss auf einer harte Oberfläche wie einen Schildkrötenpanzer gewesen sein, die eine verstärkte Belastung der Kieferknochen verursacht hätte. Eine andere Möglichkeit ist die Verletzung durch einen Artgenossen während eines Kampfes. Die Grube in IRSNB R27 wurde als „einer Zahnspur ähnlich“ beschrieben, was die Möglichkeit eröffnet, dass es sich um die Folge eines Angriffs eines anderen Mosasauriers handelte.[89]
Im Jahr 2006 veröffentlichten Schulp et al. eine Studie, die ein fossiles Quadratbein von M. hoffmannii mit einer massiven chronischen Infektion beschreibt. Der Knochen war stark geschädigt, hatte mehrere unnatürliche Öffnungen und ein geschätzter halber Liter (0,5 kg) Knochengewebe wurde zerstört. Es ist wahrscheinlich, dass dies das Ergebnis einer schweren Knocheninfektion war, die durch septische Arthritis ausgelöst wurde, die so weit fortgeschritten war, dass ein großer Teil des Quadratbeins zum Abszess reduziert wurde. Es waren auch umfangreiche Mengen an Knochenreparaturgewebe vorhanden, was darauf hindeutet, dass die Infektion und der anschließende Heilungsprozess einige Monate lang angedauert haben könnten. Dieses Ausmaß der Knocheninfektion wäre wahrscheinlich äußerst schmerzhaft gewesen und hätte die Fähigkeit des Tieres, seine Kiefer zu benutzen, stark beeinträchtigt. Der Ort der Infektion könnte auch die Atmung beeinträchtigt haben. In Anbetracht der Tatsache, dass das Individuum in der Lage war, solche Zustände über einen längeren Zeitraum zu überleben, ist es wahrscheinlich, dass es sich anpasste und Beute mit weichem Körper wie Tintenfische, die im Ganzen geschluckt werden konnte, jagte, um den Kiefergebrauch zu minimieren. Die Ursache der Infektion bleibt unbekannt; falls jedoch ein Angriff eines Artgenossen die Ursache war, ist es möglich, dass eine der Öffnungen auf dem Quadratbein die Eintrittswunde eines Zahns war, von dem aus die Infektion eingetreten ist.[90]
In vielen Studien wurde berichtet, dass in jeder untersuchten Probe von M. lemonnieri und M. conodon eine Knochennekrose gefunden wurde.[95][50][96] Bei Untersuchungen von M. conodon-Fossilien aus Alabama und New Jersey sowie von M. lemonnieri-Fossilien aus Belgien beobachteten Rothschild und Martin (2005), dass zwischen 3 und 17 % der Mosasaurus-Wirbel von diesem Zustand betroffen waren.[95] Knochennekrose ist eine häufige Folge einer Dekompressionskrankheit; beim tiefen oder wiederholten Tauchen führt die dekomprimierte Inhalationsluft zur Bildung gasförmiger Stickstoffblasen, die Knochenschäden verursachen. Dies zeigt an, dass beideMosasaurus-Arten entweder häufig tief oder häufig wiederholt tauchten. Agnete Weinreich Carlsen bemerkte, dass es unangemessen wäre, das Auftreten solcher Zustände als Folge einer Nichtanpassung der Anatomie des Tieres zu betrachten, da Fossilien anderer Mosasaurier, die ebenfalls an Knochennekrose leiden, Hinweise auf ein entwickeltes Trommelfell zeigen, was sie bei schnellen Druckänderungen gut schützte.[96]
Paläoökologie
Verbreitung, Ökosystem und ökologische Auswirkungen
Mit Ausnahme der von Street und Caldwell (2017) nicht untersuchten pazifischen Arten, die von Street (2016) als separate Gattungen identifiziert wurden, war Mosasaurus ein transatlantischer Mosasaurier, dessen Fossilien in Meeresablagerungen auf beiden Seiten des Atlantischen Ozeans gefunden wurden. Zu diesen Orten gehören der Mittlere Westen und die Ostküste der Vereinigten Staaten, Kanada, Europa, die Türkei, Russland, die Levante, die afrikanische Küste von Marokko bis Südafrika, Brasilien, Argentinien und die Antarktis.[26][81][97] Während der späten Kreidezeit bildeten die oben genannten Regionen die drei von Mosasaurus besiedelten Seewege: den Atlantik, den Western Interior Seaway und das Tethysmeer.[97] Sie umfassten mehrere ozeanische Klimazonen, einschließlich tropischer, subtropischer, temperater und subpolarer Klimazonen.[97][98][99] Das breite Spektrum des ozeanischen Klimas ergab eine große Vielfalt der Fauna, die mit Mosasaurus koexistierte.
Tethysmeer
Das Tethysmeer befand sich während des Maastrichtiums im heutigen Europa, Afrika und dem Nahen Osten. Jüngere paläographische Studien zeigen, dass es sich auch über den Atlantik, einschließlich Brasilien und dem Ostküstenstaat New Jersey erstreckte. Es ist geografisch in zwei Faunenprovinzen unterteilt, die jeweils den nördlichen und den südlichen Tethys-Rand umfassen. Aus ökologischer Sicht scheinen die beiden Mosasaurier Mosasaurus und Prognathodon die dominierenden Taxa des gesamten Seeweges zu sein, da sie im gesamten Mittelmeerraum verbreitet und ökologisch vielfältig waren. Der nördliche Tethys-Rand befand sich um die Paläobreitengrad von 30–40 °N und bestand aus dem heutigen europäischen Kontinent, der Türkei und New Jersey. Zu dieser Zeit bestand Europa aus einer Ansammlung von Inseln, wobei der größte Teil der heutigen kontinentalen Landmasse unter Wasser lag. Am nördlichen Tethys-Rand bestand ein warm-gemäßigtes Klima mit Lebensräumen, die von Mosasauriern und Meeresschildkröten dominiert wurden. M. hoffmannii und Prognathodon sectorius waren die dominierenden Arten in der nördlichen Provinz.[97] Andere Mosasaurus-Arten wie M. lemonnieri waren in bestimmten Gebieten wie Belgien die dominierende Art.[31] Andere Mosasaurier, die auf der europäischen Seite des nördlichen Tethys-Randes gefunden wurden, umfassen kleinere Gattungen wie Halisaurus, Plioplatecarpus und Platecarpus, den Muschelfresser Carinodens und größere Mosasaurier mit ähnlichen Trophieniveaus, einschließlich Hainosaurus und vier weiteren Prognathodon-Arten. Meeresschildkröten wie Allopleurodon hoffmanni und Glyptochelone suickerbuycki waren in der Region weit verbreitet und andere marine Reptilien, einschließlich unbestimmter Elasmosaurier, wurden gelegentlich gefunden. Marine Reptilien-Funde aus der Region New Jersey entsprechen im Wesentlichen denen in Europa, allerdings ohne M. lemonnieri, Carinodens, Tylosaurus sowie bestimmter Arten von Halisaurus und Prognathodon. Stattdessen sind M. conodon, Halisaurus platyspondylus und Prognathodon rapax enthalten.[97] Viele Haiarten wie Squalicorax, Cretalamna, Serratolamna und Sandhaie,[100] sowie Knochenfische wie Cimolichthys, der mit langen Zähnen ausgestattete Enchodus und die schwertfischartige Protosphyraena lebten am nördlichen Tethys-Rand.[101]

Der südliche Tethys-Rand erstreckte sich entlang des Äquators zwischen 20 °N und 20 °S und umfasste deshalb wärmere tropischen Klimazonen. An den Kratonen in Afrika und Arabien, der sich um das heutige Afrika, Arabien, die Levante und Brasilien befindet, erstreckte sich weitläufig der flache Meeresboden. Diese Region wurde ebenfalls von Mosasauriern und Meeresschildkröten dominiert. Globidens phosphaticus ist unter den Mosasauriern die charakteristische Art der südlichen Region; im afrikanischen und arabischen Bereich waren Halisaurus arambourgi und 'Platecarpus ptychodon' (ein zweifelhaftes Taxon, das verschiedene Mosasaurier wie Gavialimimus oder Platecarpus somenensis umfasst[102]) die häufigsten Mosasaurier. Mosasaurus war hier weniger verbreitet: M. beaugei war auf Marokko und Brasilien beschränkt und isolierte Zähne aus Syrien deuteten auf ein mögliches Vorkommen von M. lemonnieri hin; außerdem kam M. hoffmannii ebenfalls in der gesamten Provinz vor. Weitere Mosasaurier vom südlichen Tethys-Rand sind Goronyosaurus, die Muschelfresser Igdamanosaurus und Carinodens, Eremiasaurus, vier andere Arten von Prognathodon und verschiedene andere Arten von Halisaurus. Abgesehen von Zarafasaura in Marokko waren Plesiosaurier rar, es kamen aber andere Meeresreptilien wie der Meereswaran Pachyvaranus und die Seeschlange Palaeophis vor. Auch Knochenfische wie Enchodus und Stratodus sowie verschiedene Haie waren am südlichen Tethys-Rand verbreitet.[97]
Western Interior Seaway

Viele der frühesten Fossilien des Mosasaurus wurden in der campanischen Stufe in Nordamerika gefunden. Dazu gehört der ehemalige Western Interior Seaway, ein Binnenmeer, das durch die heutigen Vereinigten Staaten und Kanada floss und den Arktischen Ozean mit dem heutigen Golf von Mexiko verband. Die Region war eher flach und hatte am tiefsten Punkt eine Tiefe von etwa 800 bis 900 Metern.[103] Die Austrocknung der benachbarten Kontinente Appalachia und Laramidia erzeugte eine große Mengen an Sedimenten. Kontinentales Süßwasser vermischte sich mit arktischem Wasser aus dem Norden und wärmerem Salzwasser vom südlich gelegenen Tethysmeer. Das warme, nährstoffreiche und tiefe Wasser bot einer Vielzahl unterschiedlicher Meereslebewesen einen Lebensraum.[104][105][106] Die Biogeographie der Region wurde im Allgemeinen in zwei innere Subprovinzen unterteilt, die durch unterschiedliche Klimazonen und Faunen gekennzeichnet waren und an das heutige Kansas grenzten. Das ozeanische Klima der nördlichen Subprovinz war wahrscheinlich kühl und gemäßigt, während die südliche Subprovinz ein warmes, gemäßigtes bis subtropisches Klima hatte. Die fossilen Ansammlungen in diesen Regionen zum Zeitpunkt des Auftretens von M. missouriensis und M. conodon deuten darauf hin, dass Mosasaurus im Western Interior Seaway einen tiefgreifenden Einfluss auf die marinen Ökosysteme hatte. Die Fauna beider Provinzen war vor dem Erscheinen von Mosasaurus im Allgemeinen viel vielfältiger. Diese Perioden der Vielfalt werden als Niobrara-Zeitalter bezeichnet. In dieser Zeit wurde die nördliche Subprovinz von Plesiosauriern, Seevögeln der Hesperornithiformes und der Mosasauriergattung Platecarpus dominiert. In der südlichen Subprovinz, in der alle Tiergruppen deutlich vielfältiger vertreten waren als im Norden, waren dagegen Haie, Schildkröten und eine große Vielfalt von Mosasauriern wie Tylosaurus und Clidastes die dominanten Tiergruppen.[98][107]
Das Auftreten von M. missouriensis und M. conodon im Western Interior Seaway vor 79,5 Millionen Jahren fiel mit dem Übergang in das nachfolgende Navesink-Zeitalter zusammen, das mit dem Zusammenbruch der Niobrara-Fauna und einer vollständigen Erneuerung der marinen Faunenstruktur einherging.[107][108] Im heutigen Alabama in der südlichen Subprovinz verschwanden die meisten Schlüsselgattungen, darunter die Mosasaurier Clidastes, Tylosaurus, Globidens, Halisaurus und Platecarpus sowie Haie wie Cretoxyrhina, und wurden durch Mosasaurus ersetzt.[107][109] Die Vielfalt der marinen Reptilien nahm insgesamt erheblich ab, bis schließlich Mosasaurus die gesamte Region dominierte und rund zwei Drittel der gesamten Vielfalt der Mosasaurier ausmachte, wobei Plioplatecarpus und Prognathodon zusammen das verbleibende Drittel bildeten. In der nördlichen Subprovinz kam es zu Beginn des Navesink-Zeitalters auch zu einer Umstrukturierung der Mosasaurier-Ablagerungen, indem Mosasaurier wie Platecarpus und durch Mosasaurus und Plioplatecarpus ersetzt wurden.[107] Niobrara-Gattungen wie Tylosaurus[110], Cretoxyrhina[111], Hesperornithiformes[112] und Plesiosaurier, darunter Elasmosaurier wie Terminonatator[113] und Polycotylide wie Dolichorhynchops[114], blieben bis gegen Ende des Campaniums präsent, während der gesamte Western Interior Seaway von Norden her zurückging.[104] Mosasaurus war bis zum Ende des Navesink-Zeitalters am Ende der Kreidezeit weiterhin die dominierende Gattung.[107] Es gab dennoch eine Vielfalt von Tieren, die mit Mosasaurus koexistierten. Dazu gehörten Meeresschildkröten wie Protostega[109] und Archelon[115], viele Arten von Seevögeln, einschließlich Baptornis[112], Ichthyornis und Halimornis, Krokodile wie Deinosuchus und viele Fischgattungen, einschließlich Haien wie den Makrelenhaien Cretalamna, Squalicorax, Pseudocorax und Serratolamna, dem koboldhaiartigen Scapanorhynchus, Odontaspis und dem Sägehai Ischyrhiza sowie Knochenfischen wie Enchodus, Protosphyraena, Stratodus und den Ichthyodectiformes Xiphactinus und Saurodon.[109][116]
Antarktis
Mosasaurus ist aus späten Maastricht-Ablagerungen auf der Antarktischen Halbinsel bekannt, insbesondere aus der López-de-Bertodano-Formation auf der Insel Seymour.[81] Es wird geschätzt, dass dieser Ort während des Maastricht-Zeitraums auf etwa 65° südlicher Breite im antarktischen Polarkreis lag und wahrscheinlich ein ziemlich einzigartiges Klima bot.[99] Chemische Studien zu Sauerstoff-18-Isotopen in Schalen und benthischen Foraminiferen ergaben durchschnittliche Tiefen- und Tiefsee-Ozeantemperaturen von 6 °C mit Schwankungen von 4 bis 12 °C im gesamten Maastrichtium; die Meeresoberflächentemperatur könnte allerdings kälter gewesen sein, möglicherweise unter den Gefrierpunkt fallen und zeitweise Meereis gebildet haben.[80][117] Eine Studie mit Daten aus urzeitlichen bakteriellen Membranlipiden ergab für die Zeit vor 66 Millionen Jahren eine etwas wärmere Temperatur von 12 ± 5 °C. Dennoch charakterisieren diese geschätzten Klimate eine hauptsächlich kühl-gemäßigte Umgebung mit möglichen subpolaren und warmen Episoden.[99]
Mindestens zwei Arten von Mosasaurus wurden von der Seymour-Insel beschrieben, aber die tatsächliche Anzahl der Arten ist unbekannt, da Überreste oft fragmentarisch sind und Exemplare ohne genaue Bestimmung beschrieben werden. Zu diesen Arten gehören eine mit Affinität zu M. lemonnieri und eine andere, die mit M. hoffmannii eng verwandt zu sein scheint. Eine Reihe von Mosasaurus-Fossilien, die aus der Region bekannt sind, gelten als zu fragmentarisch, um auf Artebene identifiziert zu werden. Dennoch scheint die Gattung im Maastrichtium die taxonomisch vielfältigste in der Antarktis gewesen zu sein. Mosasaurus ist nicht der einzige Mosasaurier der Seymour-Insel; mindestens vier weitere Gattungen wurden an ähnlichen oder identischen Fundorten entdeckt, darunter Plioplatecarpus, Moanasaurus, Liodon[81] und Kaikaifilu. Viele dieser Funde basieren jedoch hauptsächlich auf isolierten Zähnen und Studien zur dentalen Variabilität von Kaikaifilu zeigten, dass es möglich ist, dass mehr Gattungen identifiziert wurden, als tatsächlich vorhanden waren.[118] Prognathodon und Globidens werden aufgrund ihrer Verbreitungsareale ebenfalls erwartet, obwohl noch keine eindeutigen Fossilien gefunden wurden.[81] Andere Meeresreptilien dieser Region waren elasmosauride Plesiosaurier wie Aristonectes sowie eine weitere unbestimmte Gattung.[119] Der Fischbestand der López-de-Bertodano-Formation wurde von Enchodus und Ichthyodectiformes dominiert, die 21,95 % bzw. 45,6 % der lokalen Fischvielfalt ausmachten. Sandhaie machten 10,5 % aus, der Kammzähnerhai Notidanodon 6,8 %, Seekatzen 3,9 %, Sägehaie 2,7%, verschiedene weitere Knochenfische 2,4 % und die restlichen 6 % teilten sich andere Haie wie Paraorthacodus, Kragenhaie, Protosqualus und Cretalamna.[120]
Bevorzugter Lebensraum

Eine traditionelle Methode zur Bestimmung der Habitatspräferenz fossiler Tiere besteht darin, den Lebensraum zu bestimmen, der durch die Ablagerungen repräsentiert wird, aus denen sie stammen. Bekannte Fossilien von Mosasaurus wurden typischerweise aus Ablagerungen geborgen, die küstennahe Lebensräume während der Kreidezeit repräsentieren, wobei einige Fossilien aus tieferen Meeresschichten stammen.[85][121] Lingham-Soliar (1995) stellte fest, dass Maastricht-Ablagerungen in den Niederlanden, die M. hoffmannii-Fossilien beinhalten, küstennahe Gewässer mit einer Tiefe von etwa 40–50 Metern darstellen. Wechselnde Temperaturen und eine Fülle an Meereslebewesen waren charakteristisch für diese Orte. Der morphologische Aufbau von M. hoffmannii war jedoch am besten für einen pelagischen Oberflächenlebensstil geeignet. Die Tiere hielten sich wahrscheinlich nahe der Oberfläche auf, wo sie von dem reichhaltigen Vorkommen ihrer Beutetiere profitierten.[41]
Ein neuerer Ansatz ist eine biogeochemische Analyse, eine davon ist die Messung von δ13C-Werten im Zahnschmelz. Eine bekannte Korrelation mit δ13C-Werten zeigt, dass die Konzentration der Kohlenstoffisotope typischerweise abnimmt, wenn der Lebensraum des Tieres weiter vom Ufer entfernt ist. Studien an mehreren Mosasaurus-Fossilien deuten konsistent darauf hin, dass Mosasaurus in küstennahen oder offenen Gewässern lebte. Jedoch hatten auch andere Faktoren in der Lebensweise des Tieres einen Einfluss auf die δ13C-Werte, was darauf hindeutet, dass die Isotopenniveaus die tatsächlichen Lebensraumpräferenzen von Mosasaurus falsch darstellen könnten;[121] beispielsweise könnte der der Bohr-Effekt durch das Tauchen bei M. hoffmannii anders als bei M. lemonnieri und M. conodon gewesen sein.[85] Als Lösung führten die Paläontologen T. Lynn Harrell Jr. und Alberto Perez-Huerta 2014 eine Studie durch, die speziell die Konzentrationsverhältnisse von Neodym, Gadolinium und Ytterbium in verschiedenen Mosasaurus-Fossilien aus Alabama und New Jersey untersuchte. Frühere Studien zeigten, dass die Verhältnisse dieser drei Elemente als Anzeiger für die relative Ozeantiefe eines Fossils während der frühen Diagenese ohne Störung durch biologische Prozesse dienen können, wobei jedes der drei Elemente entweder Flach-, Tief- oder Süßwasser bedeutet. Die Verhältnisse der Seltenen Erden waren in den meisten untersuchten Mosasaurus-Fossilien sehr konstant, was auf eine konsistente Habitatpräferenz für küstennahe Lebensräume mit Meerestiefen von mindestens 50–150 Metern hinweist. Einige abweichende Werte wiesen auf flachere Gewässer mit einer Tiefe von 50 Metern oder weniger hin.[121]

Konkurrenz zu verwandten Gattungen
Mosasaurus teilte seinen Lebensraum mit anderen großen räuberischen Mosasauriern, die ebenfalls als Spitzenprädatoren gelten, darunter die Tylosaurinae und Prognathodon.[41][50] Tylosaurus bernardi, die einzige Art der Gattung, die während des Maastricht-Zeitraums noch existierte, maß bis zu 12,2 Meter[122] und die größten Prognathodon-Arten wie P. saturator erreichten ebenfalls über 12 Meter Länge.[50] Diese drei Mosasaurier bevorzugten ähnliche Beutetiere, insbesondere andere Meeresreptilien.[49][41][50]
Eine 2013 von Schulp und Kollegen veröffentlichte Kohlenstoffisotopstudie untersuchte, wie Mosasaurier wie M. hoffmannii und P. saturator in denselben Lebensräumen koexistieren konnten. Durch Unterschiede in den Isotopenwerten konnte das Ausmaß der Ressourcenaufteilung erklärt werden, die von mehreren Umweltfaktoren wie Lebensstil, Ernährung und Lebensraumpräferenz beeinflusst wird. Vergleiche zwischen den δ13C-Gehalten in mehreren Zähnen von M. hoffmannii und P. saturator aus der Maastricht-Formation zeigten, dass zwar eine gewisse Konvergenz zwischen bestimmten Exemplaren bestand, der Durchschnitt der Werte zwischen den beiden Spezies jedoch im Allgemeinen unterschiedlich waren. Dies ist ein Hinweis auf eine Nischendifferenzierung, bei der die beiden Mosasaurier-Gattungen wahrscheinlich in verschiedenen Lebensräumen nach Nahrung suchten oder unterschiedliche Beutevorlieben hatten, um ohne direkte Konkurrenz zusammenzuleben. Der morphologische Aufbau der beiden Arten unterstützt diese Annahme. Die Zähne von P. saturator sind viel robuster als die von M. hoffmannii und waren für die Jagd auf robuste Beutetiere wie Schildkröten geeignet. Auch wenn M. hoffmannii ebenfalls Schildkröten jagte, eigneten sich seine Zähne für die Jagd auf eine größere Auswahl an Beutetieren, die für P. saturator vermutlich ungeeignet waren.[50]
Ein weiterer Fall einer vermuteten Nischendifferenzierung zwischen Mosasaurus und Prognathodon overtoni aus der Bearpaw-Formation in Alberta wurde in einer Studie von Konishi et al. aus dem Jahr 2014 dokumentiert, bei der der fossile Mageninhalt untersucht wurde. Im Magen von P. overtoni wurden Schildkröten und Ammoniten, gefunden, was die These für eine auf härtere Beute spezialisierte Ernährung stützt. Im Gegensatz dazu bestand der Mageninhalt von M. missouriensis aus Fisch, was auf eine auf weichere Beute spezialisierte Ernährung hinweist.[49]
Allerdings ließ sich eine interspezifische Rivalität offenbar nicht ganz vermeiden. So gibt es auch Hinweise auf aggressive Kämpfe zwischen Mosasaurus und anderen großen Mosasaurier-Gattungen. Ein fossiler Schädel eines subadulten M. hoffmannii wies Frakturen auf, die durch einen massiven konzentrierten Schlag auf die Hirnschale verursacht wurden; Lingham-Soliar (1998) argumentierte, dass dieser Schlag durch einen Rammangriff von Tylosaurus bernardi verursacht worden war, da die Bildung der Brüche charakteristisch für einen koordinierten Schlag war (und nicht für einen Unfall oder Schaden bei der Versteinerung) und dass T. bernardi das einzige bekannte koexistierende Tier war, das mit seinem robusten, projektilartigen verlängerten Rostrum wahrscheinlich zu einem solchen Schaden in der Lage war. Diese Art von Angriff wurde mit dem defensiven Verhalten von Großen Tümmlern verglichen, die ihre Schnäbel benutzen, um Zitronenhaie zu töten oder abzuwehren, und es wurde vermutet, dass T. bernardi den Angriff auf Mosasaurus aus dem Hinterhalt ausführte.[123]
Aussterben

Am Ende der Kreidezeit befanden sich Mosasaurier wie Mosasaurus auf einem Höhepunkt der adaptiven Radiation und ihr Aussterben war ein plötzliches Ereignis.[41] Während des späten Maastrichtiums sank der globale Meeresspiegel, was die nährstoffreichen Seewege zwischen den Kontinenten entwässerte und das Nahrungsangebot veränderte, wodurch sich die Anzahl der verfügbaren Lebensräume für Mosasaurus reduzierte. Die Gattung erschloss sich daraufhin neue Lebensräume in offeneren Gewässern.[124][125] Die geologisch jüngsten Fossilien von Mosasaurus, zu denen die von M. hoffmannii und die unbestimmter Arten gehören, kommen bis zur Kreide-Paläogen-Grenze vor. Der Untergang der Gattung war wahrscheinlich eine Folge des Massenaussterbens, das auch die Dinosaurier auslöschte. Zu den Fundorten, an denen Mosasaurus-Fossilien 15 Meter unterhalb der K-P-Grenze oder weniger gefunden wurden, gehören die Maastricht-Formation, die Davutlar-Formation in der Türkei, die Jagüel-Formation in Argentinien, Stevns Klint in Dänemark, die Seymour-Insel und Missouri.[126]
M. hoffmannii-Fossilien wurden innerhalb der K-P-Grenze selbst zwischen der paläozänen Clayton-Formation und der kreidezeitlichen Owl-Creek-Formation im Südosten von Missouri gefunden. Wirbelfossilien aus der Schicht wiesen Brüche auf, die nach dem Tod gebildet wurden. Bei der Ablagerung handelt es sich wahrscheinlich um Tsunamit, der als Ergebnis einer Kombination von seismischen und geologischen Unruhen, gewaltigen Hurrikanen und riesigen Tsunamis als direkte Auswirkungen des Chicxulub-Einschlags entstanden ist, welcher das Massenaussterben einleitete.[124] Abgesehen von den direkten physischen Folgen dieser Ereignisse verursachte der Einschlag auch Umwelteinflüsse wie die Verdunkelung des Sonnenlichts durch aufgewirbelten Staub, die zum Zusammenbruch der marinen Nahrungsketten führten.[127] Mosasaurus-Individuen, die die unmittelbare Katastrophe überlebt haben könnten, indem sie in tieferen Gewässern Zuflucht suchten, wären schließlich aufgrund des vollständigen Verlustes der Beutestrukturen verhungert.[124]
Rätselhaft sind Vorkommen von Mosasaurus-spec.-Fossilien, die in der Hornerstown-Formation gefunden wurden, einer Ablagerung, die aus dem paläozänen Danium-Zeitalter datiert wird, das unmittelbar nach dem Maastricht-Zeitalter lag. Die Fossilien wurden zusammen mit Fossilien von Squalicorax, Enchodus und verschiedenen Ammoniten in einer einzigartigen fossilreichen Grube am Fuß der Hornerstown-Formation gefunden. Dies bedeutet nicht, dass diese Gattungen das K-P-Aussterben überlebt haben; es gibt mehrere alternative Erklärungen, warum diese Tiere im nominellen känozoikischen Ablagerungen gefunden wurden. Eine besagt, dass die Fossilien in Wirklichkeit aus einer früheren kreidezeitlichen Ablagerung stammen, durch Erosion freigelegt und anschließend in die jüngere paläozäne Formation wiederabgelagert wurden. Viele der Mosasaurus-Fossilien aus der Region bestehen aus isolierten Knochen, die abgerieben und abgenutzt sind, was diese These stützt; es wurden dort jedoch auch besser erhaltene Mosasaurus-Überreste entdeckt. Eine andere Vermutung ist, dass die Lagerstätte aus einer kreidezeitlichen Ablagerung mit geringer Sedimentation stammt, die durch natürliche Prozesse allmählich in die darüber liegenden Ablagerungen abgetragen wurde. Eine dritte Hypothese schlägt vor, dass die kreidezeitlichen Sedimente der Schicht durch ein starkes Einschlagsereignis wie ein Tsunami herausgedrückt und anschließend mit känozoischen Fossilien wieder aufgefüllt wurden.[19]
Quellen
Einzelnachweise
- William D. Conybeare: Fossil crocodiles and other saurian animals. In: James Parkinson: Outlines of oryctology. An introduction to the study of fossil organic remains; especially those found in the British strata: intended to aid the student in his enquiries respecting the nature of fossils, and their connection with the formation of the earth. Printed for the author, London 1822, S. 284–304, hier S. 298.
- Gideon Mantell: A Tabular Arrangement of the Organic Remains of the County of Sussex. In: A Tabular Arrangement of the Organic Remains of the County of Sussex. In: Transactions of the Geological Society of London. Series 2, Bd. 3, Nr. 1, 1829, ZDB-ID 352250-7, S. 201–216, hier S. 207, doi:10.1144/transgslb.3.1.201
- M. van Marum: Beschrijving der beenderen van den kop van eenen visch, gevonden in den St Pietersberg bij Maastricht, en geplaatst in Teylers Museum (Dutch), Band 9. Verhandelingen Teylers Tweede Genootschap, 1790, S. 383–389.
- Mike Everhart: Mosasaurus hoffmanni-The First Discovery of a Mosasaur?. In: Oceans of Kansas. 1999. Archiviert vom Original am 4. September 2019. Abgerufen am 6. November 2019.
- Florence F. J. M. Pieters, Peggy G. W. Rompen, John W. M. Jagt, Nathalie Bardet: A new look at Faujas de Saint-Fond’s fantastic story on the provenance and acquisition of the type specimen of Mosasaurus hoffmanni Mantell, 1829. In: Bulletin de la Société Géologique de France. Band 183, Nr. 1, 1. Januar 2012, ISSN 0037-9409, S. 55–65, doi:10.2113/gssgfbull.183.1.55 (geoscienceworld.org [abgerufen am 18. Februar 2021]).
- Peter Camper: XXVI. Conjecture relative to the petrifactions found in St. Peter's Mountain, near Maestricht. In: Philosophical Transactions of the Royal Society of London. Band 76, 1. Januar 1786, S. 443–456, doi:10.1098/rstl.1786.0026 (royalsocietypublishing.org [abgerufen am 18. Februar 2021]).
- Florence F. J. M. Pieters: Natural history spoils in the Low Countries in 1794/95: the looting of the fossil Mosasaurus from Maastricht and the removal of the cabinet and menagerie of stadholder William V. In: Napoleon's legacy: the rise of national museums in Europe, 1794–1830, Band 27. Berlin: G+H Verlag, 2009, ISBN 978-3-940939-11-1, S. 55–72.
- Nathalie Bardet: The Mosasaur collections of the Muséum National d’Histoire Naturelle of Paris. In: Bulletin de la Société Géologique de France. Band 183, Nr. 1, 1. Januar 2012, ISSN 0037-9409, S. 35–53, doi:10.2113/gssgfbull.183.1.35 (geoscienceworld.org [abgerufen am 18. Februar 2021]).
- Eric Mulder: Maastricht Cretaceous finds and Dutch pioneers in vertebrate palaeontology. Royal Netherlands Academy of Arts and Sciences, 2004, S. 165–176.
- E. W. A. Mulder, B. Theunissen: Hermann Schlegel's investigation of the Maastricht mosasaurs. In: Archives of Natural History. Band 13, Nr. 1, Februar 1986, ISSN 0260-9541, S. 1–6, doi:10.3366/anh.1986.13.1.1 (euppublishing.com [abgerufen am 19. Februar 2021]).
- Mark Evans: The roles played by museums, collections and collectors in the early history of reptile palaeontology. In: Geological Society, London, Special Publications. 343, Nr. 1, 2010, S. 5–29. bibcode:2010GSLSP.343....5E. doi:10.1144/SP343.2.
- Hallie P. Street: A re-assessment of the genus Mosasaurus (Squamata: Mosasauridae). 2016, abgerufen am 19. Februar 2021 (englisch).
- Mike Everhart: The Goldfuss Mosasaur. In: Oceans of Kansas. 2001. Archiviert vom Original am 2. Juni 2019. Abgerufen am 10. November 2019.
- September 10, 1804. In: Journals of the Lewis & Clark Expedition. Archiviert vom Original am 11. November 2019. Abgerufen am 10. November 2019.
- Richard Ellis: Sea dragons : predators of the prehistoric oceans. University Press of Kansas, Lawrence, Kan. 2003, ISBN 0-7006-1269-6, S. 216.
- Robert W. Meredith; James E. Martin; Paul N. Wegleitner (2007). The largest mosasaur (Squamata: Mosasauridae) from the Missouri River area (Late Cretaceous; Pierre Shale Group) of South Dakota and its relationship to Lewis and Clark. The Geological Society of America. S. 209–214.
- James Ellsworth De Kay (1830). "On the Remains of Extinct Reptiles of the genera Mosasaurus and Geosaurus found in the secondary formation of New-Jersey; and on the occurrence of the substance recently named Coprolite by Dr. Buckland, in the same locality". Annals of the Lyceum of Natural History of New York. 3: 134–141.
- H. G. Bronn: Lethaea geognostica oder Abbildungen und Beschreibungen der für die Gebirgs-Formationen bezeichnendsten Versteinerungen. Stuttgart 1834, doi:10.5962/bhl.title.59080 (biodiversitylibrary.org [abgerufen am 19. Februar 2021]).
- W. B. Gallagher: Recent mosasaur discoveries from New Jersey and Delaware, USA: stratigraphy, taphonomy and implications for mosasaur extinction. In: Netherlands Journal of Geosciences. Band 84, Nr. 3, September 2005, ISSN 0016-7746, S. 241–245, doi:10.1017/S0016774600021028 (cambridge.org [abgerufen am 19. Februar 2021]).
- Eric W.A. Mulder: Transatlantic latest Cretaceous mosasaurs (Reptilia, Lacertilia) from the Maastrichtian type area and New Jersey. In: Geologie en Mijnbouw. Band 78, Nr. 3, 1. September 1999, ISSN 1573-9708, S. 281–300, doi:10.1023/A:1003838929257.
- Richard Harlan: Notice of the Discovery of the Remains of the Ichthyosaurus in Missouri, N. A. In: Transactions of the American Philosophical Society. Band 4, 1834, ISSN 0065-9746, S. 405–408, doi:10.2307/1004839.
- Richard Harlan: Notice of the discovery of Basilosaurus and Batrachotherium. In: Proceedings of the Geological Society of London. 3, 1839, S. 23–24.
- Richard Harlan: (Letter regarding Basilosaurus and Batrachotherium). In: Bulletin de la Société Géologique de France. 1, Nr. 10, 1839, S. 89–90.
- Mark Witton: The science of the Crystal Palace Dinosaurs, part 2: Teleosaurus, pterosaurs and Mosasaurus. In: Mark Witton.com. 2019. Archiviert vom Original am 3. Juni 2019.
- Mosasaurus. In: Friends of the Crystal Palace Dinosaurs. 2020. Archiviert vom Original am 18. Juni 2020.
- Hallie P. Street, Michael W. Caldwell: Rediagnosis and redescription of Mosasaurus hoffmannii (Squamata: Mosasauridae) and an assessment of species assigned to the genus Mosasaurus. In: Geological Magazine. Band 154, Nr. 3, Mai 2017, ISSN 0016-7568, S. 521–557, doi:10.1017/S0016756816000236 (cambridge.org [abgerufen am 19. Februar 2021]).
- Edward Drinker Cope: A new species of Clidastes from New Jersey. In: American Naturalist. 15, 1881, S. 587–588.
- T. Ikejiri, S.G. Lucas: Osteology and taxonomy of Mosasaurus conodon Cope 1881 from the Late Cretaceous of North America. In: Netherlands Journal of Geosciences - Geologie en Mijnbouw. Band 94, Nr. 1, März 2015, ISSN 0016-7746, S. 39–54, doi:10.1017/njg.2014.28 (cambridge.org [abgerufen am 19. Februar 2021]).
- Ben Creisler: Mosasauridae Translation and Pronunciation Guide. In: Dinosauria On-line. 2000. Archiviert vom Original am 2. Mai 2008.
- Louis Dollo: Première note sur les Mosasauriens de Mesvin. In: Bulletin de la Société belge de géologie, de paléontologie et d'hydrologie. 3, 1889, ISSN 0037-8909, S. 271–304.
- Theagarten Lingham-Soliar (2000). "The Mosasaur Mosasaurus lemonnieri (Lepidosauromorpha, Squamata) from the Upper Cretaceous of Belgium and The Netherlands". Paleontological Journal. 34 (suppl. 2): S. 225–237.
- Pablo González Ruiz, Marta S. Fernández, Marianella Talevi, Juan M. Leardi, Marcelo A. Reguero: A new Plotosaurini mosasaur skull from the upper Maastrichtian of Antarctica. Plotosaurini paleogeographic occurrences. In: Cretaceous Research. Band 103, November 2019, S. 104166, doi:10.1016/j.cretres.2019.06.012 (elsevier.com [abgerufen am 19. Februar 2021]).
- Dale A. Russell (1967). Systematics and morphology of American mosasaurs (PDF). 23. Bulletin of the Peabody Museum of Natural History. pp. 1–124.
- Daniel Madzia: Dental variability and distinguishability in Mosasaurus lemonnieri (Mosasauridae) from the Campanian and Maastrichtian of Belgium, and implications for taxonomic assessments of mosasaurid dentitions. In: Historical Biology. Band 32, Nr. 10, 25. November 2020, ISSN 0891-2963, S. 1340–1354, doi:10.1080/08912963.2019.1588892 (tandfonline.com [abgerufen am 19. Februar 2021]).
- N. Bardet, X. Pereda Suberbiola, S. Jouve, E. Bourdon, P. Vincent: Reptilian assemblages from the latest Cretaceous – Palaeogene phosphates of Morocco: from Arambourg to present time. In: Historical Biology. Band 22, Nr. 1-3, März 2010, ISSN 0891-2963, S. 186–199, doi:10.1080/08912961003754945 (tandfonline.com [abgerufen am 19. Februar 2021]).
- Nathalie Bardet, Xabier Pereda Suberbiola, Mohamed Iarochene, Fatima Bouyahyaoui, Baadi Bouya: Mosasaurus beaugei Arambourg, 1952 (Squamata, Mosasauridae) from the Late Cretaceous phosphates of Morocco. In: Geobios. Band 37, Nr. 3, Mai 2004, S. 315–324, doi:10.1016/j.geobios.2003.02.006 (elsevier.com [abgerufen am 19. Februar 2021]).
- Johan Lindgren, Michael W. Caldwell, Takuya Konishi, Luis M. Chiappe: Convergent Evolution in Aquatic Tetrapods: Insights from an Exceptional Fossil Mosasaur. In: PLoS ONE. Band 5, Nr. 8, 9. August 2010, ISSN 1932-6203, S. e11998, doi:10.1371/journal.pone.0011998, PMID 20711249 (plos.org [abgerufen am 2. März 2021]).
- Michael W. Caldwell: A challenge to categories: “What, if anything, is a mosasaur?” In: Bulletin de la Société Géologique de France. Band 183, Nr. 1, 1. Januar 2012, ISSN 1777-5817, S. 7–34, doi:10.2113/gssgfbull.183.1.7 (geoscienceworld.org [abgerufen am 2. März 2021]).
- Johan Lindgren, Michael J. Polcyn, Bruce A. Young: Landlubbers to leviathans: evolution of swimming in mosasaurine mosasaurs. In: Paleobiology. Band 37, Nr. 3, 2011, ISSN 0094-8373, S. 445–469, doi:10.1666/09023.1 (cambridge.org [abgerufen am 28. Februar 2021]).
- D.V. Grigoriev: Giant Mosasaurus hoffmanni (Squamata, Mosasauridae) from the Late Cretaceous (Maastrichtian) of Penza, Russia. In: Proceedings of the Zoological Institute RAS. 318, Nr. 2, 2014, S. 148–167.
- Theagarten Lingham-Soliar: Anatomy and functional morphology of the largest marine reptile known, Mosasaurus hoffmanni (Mosasauridae, Reptilia) from the Upper Cretaceous, Upper Maastrichtian of The Netherlands. In: Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. Band 347, Nr. 1320, 30. Januar 1995, S. 155–180, doi:10.1098/rstb.1995.0019 (royalsocietypublishing.org [abgerufen am 20. Februar 2021]).
- Federico Fanti, Andrea Cau, Alessandra Negri: A giant mosasaur (Reptilia, Squamata) with an unusually twisted dentition from the Argille Scagliose Complex (late Campanian) of Northern Italy. In: Cretaceous Research. Band 49, 1. Mai 2014, ISSN 0195-6671, S. 91–104, doi:10.1016/j.cretres.2014.01.003 (sciencedirect.com [abgerufen am 20. Februar 2021]).
- Michael Everhart; John W.M. Jagt; Eric W.A. Mulder; Anne S. Schulp (2016), Mosasaurs- how large did they really get?, 5th Triennial Mosasaur Meeting – a global perspective on Mesozoic marine amniotes
- Louis Dollo: Nouvelle note sur l'osteologie des mosasauriens. In: Bulletin de la Société belge de géologie, de paléontologie et d'hydrologie. 6, 1892, ISSN 0037-8909, S. 219=259.
- Michael J. Polcyn, Louis L. Jacobs, Ricardo Araújo, Anne S. Schulp, Octávio Mateus: Physical drivers of mosasaur evolution. In: Palaeogeography, Palaeoclimatology, Palaeoecology. Band 400, April 2014, S. 17–27, doi:10.1016/j.palaeo.2013.05.018 (elsevier.com [abgerufen am 20. Februar 2021]).
- Michael D. D'Emic, Kathlyn M. Smith, Zachary T. Ansley: Unusual histology and morphology of the ribs of mosasaurs (Squamata). In: Palaeontology. Band 58, Nr. 3, Mai 2015, ISSN 0031-0239, S. 511–520, doi:10.1111/pala.12157 (wiley.com [abgerufen am 20. Februar 2021]).
- Carolyn Gramling: Ancient sea monster battle revealed in unusual fossil. In: Science. 26. Oktober 2016, ISSN 0036-8075, doi:10.1126/science.aal0310 (sciencemag.org [abgerufen am 20. Februar 2021]).
- M.W. Caldwell, G.L. Bell: Of German princes and North American rivers: Harlan’s lost mosasaur snout rediscovered. In: Netherlands Journal of Geosciences. Band 84, Nr. 3, September 2005, ISSN 0016-7746, S. 207–211, doi:10.1017/S0016774600020989 (cambridge.org [abgerufen am 21. Februar 2021]).
- Takuya Konishi, Michael G. Newbrey, Michael W. Caldwell: A small, exquisitely preserved specimen of Mosasaurus missouriensis (Squamata, Mosasauridae) from the upper Campanian of the Bearpaw Formation, western Canada, and the first stomach contents for the genus. In: Journal of Vertebrate Paleontology. Band 34, Nr. 4, 7. Juni 2014, ISSN 0272-4634, S. 802–819, doi:10.1080/02724634.2014.838573 (tandfonline.com [abgerufen am 21. Februar 2021]).
- A.S. Schulp, H.B. Vonhof, J.H.J.L. van der Lubbe, R. Janssen, R.R. van Baal: On diving and diet: resource partitioning in type-Maastrichtian mosasaurs. In: Netherlands Journal of Geosciences - Geologie en Mijnbouw. Band 92, Nr. 2-3, September 2013, ISSN 0016-7746, S. 165–170, doi:10.1017/S001677460000010X (cambridge.org [abgerufen am 28. Februar 2021]).
- Anne S. Schulp; Michael J. Polcyn; Octavio Mateus; Louis L. Jacobs; Maria Lusia Morais; Tatiana da Silva Tavares (2006). "New mosasaur material from the Maastrichtian of Angola, with notes on the phylogeny, distribution, and paleoecology of the genus Prognathodon" (PDF; 1023 kB). Publicaties van Het Natuurhistorisch Genootschap in Limburg: 57–67. ISSN 0374-955X.
- Clint A. Boyd (2017). "A New Addition to the Cretaceous Seaway of North Dakota" (PDF; 14 MB). Geo News. Vol. 44 no. 1. North Dakota Geological Society. pp. 20–23.
- Mike Everhart: Samuel Wilson's Mosasaurus horridus. In: Oceans of Kansas. 2001. Abgerufen am 23. November 2019.
- M. W. Caldwell: Ontogeny, anatomy and attachment of the dentition in mosasaurs (Mosasauridae: Squamata). In: Zoological Journal of the Linnean Society. Band 149, Nr. 4, April 2007, ISSN 1096-3642, S. 687–700, doi:10.1111/j.1096-3642.2007.00280.x (oup.com [abgerufen am 28. Februar 2021]).
- Anusuya Chinsamy, Cemal Tunoǧlu, Daniel B. Thomas: Dental microstructure and geochemistry of Mosasaurus hoffmanni (Squamata: Mosasauridae) from the Late Cretaceous of Turkey. In: Bulletin de la Société Géologique de France. Band 183, Nr. 2, 1. März 2012, ISSN 1777-5817, S. 85–92, doi:10.2113/gssgfbull.183.2.85 (geoscienceworld.org [abgerufen am 28. Februar 2021]).
- Johan Lindgren, Hani F. Kaddumi, Michael J. Polcyn: Soft tissue preservation in a fossil marine lizard with a bilobed tail fin. In: Nature Communications. Band 4, Nr. 1, Dezember 2013, ISSN 2041-1723, S. 2423, doi:10.1038/ncomms3423 (nature.com [abgerufen am 28. Februar 2021]).
- Theagarten Lingham-Soliar: Unusual death of a Cretaceous giant. In: Lethaia. Band 31, Nr. 4, 29. März 2007, S. 308–310, doi:10.1111/j.1502-3931.1998.tb00520.x (wiley.com [abgerufen am 1. März 2021]).
- Halle P. Street; Michael W. Caldwell (2016), A reexamination of Mosasaurini based on a systematic and taxonomic revision of Mosasaurus (PDF; 9,6 MB). 5th Triannual Mosasaur Meeting- a global perspective on Mesozoic marine amonites. May 16–20. Abstract. p. 43–44.
- Halle P. Street. "Reassessing Mosasaurini based on a systematic revision of Mosasaurus". Vertebrate Anatomy Morphology Palaeontology. 4: 42. ISSN 2292-1389.
- Aaron R. H. Leblanc, Michael W. Caldwell, Nathalie Bardet: A new mosasaurine from the Maastrichtian (Upper Cretaceous) phosphates of Morocco and its implications for mosasaurine systematics. In: Journal of Vertebrate Paleontology. Band 32, Nr. 1, Januar 2012, ISSN 0272-4634, S. 82–104, doi:10.1080/02724634.2012.624145 (tandfonline.com [abgerufen am 1. März 2021]).
- Daniel Madzia, Andrea Cau: Inferring ‘weak spots’ in phylogenetic trees: application to mosasauroid nomenclature. In: PeerJ. Band 5, 15. September 2017, ISSN 2167-8359, doi:10.7717/peerj.3782, PMID 28929018 (peerj.com [abgerufen am 1. März 2021]).
- Tiago R. Simões, Oksana Vernygora, Ilaria Paparella, Paulina Jimenez-Huidobro, Michael W. Caldwell: Mosasauroid phylogeny under multiple phylogenetic methods provides new insights on the evolution of aquatic adaptations in the group. In: PLOS ONE. 12, Nr. 5, 3. Mai 2017, ISSN 1932-6203, S. e0176773. bibcode:2017PLoSO..1276773S. doi:10.1371/journal.pone.0176773. PMID 28467456. PMC 5415187 (freier Volltext).
- Gorden L. Bell: A Phylogenetic Revision of North American and Adriatic Mosasauroidea. In: Ancient Marine Reptiles. Elsevier, 1997, ISBN 978-0-12-155210-7, S. 293–332, doi:10.1016/b978-012155210-7/50017-x (elsevier.com [abgerufen am 1. März 2021]).
- Alessandro Palci: On the Origin and Evolution of the Ophidia. 2014, doi:10.7939/R3NG4H314 (ualberta.ca [abgerufen am 2. März 2021]).
- Jack L. Conrad: Phylogeny And Systematics Of Squamata (Reptilia) Based On Morphology. In: Bulletin of the American Museum of Natural History. Band 310, 3. Juni 2008, ISSN 0003-0090, S. 1–182, doi:10.1206/310.1 (bioone.org [abgerufen am 2. März 2021]).
- Charles Lewis Camp (1923). "Classification of the Lizards". Bulletin of the American Museum of Natural History. 48 (11): 289–481. hdl:2246/898.
- Michael S. Y. Lee: The phylogeny of varanoid lizards and the affinities of snakes. In: Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. Band 352, Nr. 1349, 29. Januar 1997, ISSN 0962-8436, S. 53–91, doi:10.1098/rstb.1997.0005, PMC 1691912 (freier Volltext) – (royalsocietypublishing.org [abgerufen am 2. März 2021]).
- Jacques A. Gauthier, Maureen Kearney, Jessica Anderson Maisano, Olivier Rieppel, Adam D.B. Behlke: Assembling the Squamate Tree of Life: Perspectives from the Phenotype and the Fossil Record. In: Bulletin of the Peabody Museum of Natural History. Band 53, Nr. 1, April 2012, ISSN 0079-032X, S. 3–308, doi:10.3374/014.053.0101 (bioone.org [abgerufen am 2. März 2021]).
- John J. Wiens, Caitlin A. Kuczynski, Ted Townsend, Tod W. Reeder, Daniel G. Mulcahy: Combining Phylogenomics and Fossils in Higher-Level Squamate Reptile Phylogeny: Molecular Data Change the Placement of Fossil Taxa. In: Systematic Biology. Band 59, Nr. 6, 1. Dezember 2010, ISSN 1076-836X, S. 674–688, doi:10.1093/sysbio/syq048 (oup.com [abgerufen am 2. März 2021]).
- Tod W. Reeder, Ted M. Townsend, Daniel G. Mulcahy, Brice P. Noonan, Perry L. Wood: Integrated Analyses Resolve Conflicts over Squamate Reptile Phylogeny and Reveal Unexpected Placements for Fossil Taxa. In: PLOS ONE. Band 10, Nr. 3, 24. März 2015, ISSN 1932-6203, S. e0118199, doi:10.1371/journal.pone.0118199, PMID 25803280, PMC 4372529 (freier Volltext) – (plos.org [abgerufen am 2. März 2021]).
- M. S. Y. Lee: Hidden support from unpromising data sets strongly unites snakes with anguimorph ‘lizards’. In: Journal of Evolutionary Biology. Band 22, Nr. 6, Juni 2009, S. 1308–1316, doi:10.1111/j.1420-9101.2009.01751.x (wiley.com [abgerufen am 2. März 2021]).
- N. B. Ananjeva: Current State of the Problems in the Phylogeny of Squamate Reptiles (Squamata, Reptilia). In: Biology Bulletin Reviews. Band 9, Nr. 2, 1. März 2019, ISSN 2079-0872, S. 119–128, doi:10.1134/S2079086419020026.
- R. Alexander Pyron: Novel Approaches for Phylogenetic Inference from Morphological Data and Total-Evidence Dating in Squamate Reptiles (Lizards, Snakes, and Amphisbaenians). In: Systematic Biology. 11. August 2016, ISSN 1063-5157, S. syw068, doi:10.1093/sysbio/syw068 (oup.com [abgerufen am 2. März 2021]).
- Tiago R. Simões, Oksana Vernygora, Ilaria Paparella, Paulina Jimenez-Huidobro, Michael W. Caldwell: Mosasauroid phylogeny under multiple phylogenetic methods provides new insights on the evolution of aquatic adaptations in the group. In: PLOS ONE. Band 12, Nr. 5, 3. Mai 2017, ISSN 1932-6203, S. e0176773, doi:10.1371/journal.pone.0176773, PMID 28467456, PMC 5415187 (freier Volltext) – (plos.org [abgerufen am 3. April 2021]).
- Dimitry V. Grigoriev (2013). "Redescription of Prognathodon lutugini (Squamata, Mosasauridae)" (PDF; 2,7 MB). Proceedings of the Zoological Institute RAS. 317 (3): 246–261.
- Theagarten Lingham-Soliar (1991). "Locomotion in mosasaurs". Modern Geology. 16: 229–248.
- Alexandra Houssaye, Johan Lindgren, Rodrigo Pellegrini, Andrew H. Lee, Damien Germain: Microanatomical and Histological Features in the Long Bones of Mosasaurine Mosasaurs (Reptilia, Squamata) – Implications for Aquatic Adaptation and Growth Rates. In: PLoS ONE. Band 8, Nr. 10, 16. Oktober 2013, ISSN 1932-6203, S. e76741, doi:10.1371/journal.pone.0076741, PMID 24146919, PMC 3797777 (freier Volltext) – (plos.org [abgerufen am 5. April 2021]).
- Glenn J. Tattersall, Cleo A. C. Leite, Colin E. Sanders, Viviana Cadena, Denis V. Andrade: Seasonal reproductive endothermy in tegu lizards. In: Science Advances. Band 2, Nr. 1, 1. Januar 2016, ISSN 2375-2548, S. e1500951, doi:10.1126/sciadv.1500951, PMID 26844295, PMC 4737272 (freier Volltext) – (sciencemag.org [abgerufen am 5. April 2021]).
- T. Lynn Harrell, Alberto Pérez-Huerta, Celina A. Suarez: Endothermic mosasaurs? Possible thermoregulation of Late Cretaceous mosasaurs (Reptilia, Squamata) indicated by stable oxygen isotopes in fossil bioapatite in comparison with coeval marine fish and pelagic seabirds. In: Palaeontology. Band 59, Nr. 3, Mai 2016, S. 351–363, doi:10.1111/pala.12240 (wiley.com [abgerufen am 5. April 2021]).
- Vanessa C. Bowman, Jane E. Francis, James B. Riding: Late Cretaceous winter sea ice in Antarctica? In: Geology. Band 41, Nr. 12, Dezember 2013, ISSN 1943-2682, S. 1227–1230, doi:10.1130/G34891.1 (geoscienceworld.org [abgerufen am 5. April 2021]).
- James E. Martin: Biostratigraphy of the Mosasauridae (Reptilia) from the Cretaceous of Antarctica. In: Geological Society, London, Special Publications. Band 258, Nr. 1, 2006, ISSN 0305-8719, S. 101–108, doi:10.1144/GSL.SP.2006.258.01.07 (lyellcollection.org [abgerufen am 5. April 2021]).
- Marta S. Fernández, Zulma Gasparini: Campanian and Maastrichtian mosasaurs from Antarctic Peninsula and Patagonia, Argentina. In: Bulletin de la Société Géologique de France. Band 183, Nr. 2, 1. März 2012, ISSN 1777-5817, S. 93–102, doi:10.2113/gssgfbull.183.2.93 (geoscienceworld.org [abgerufen am 5. April 2021]).
- Takuya Konishi, Michael W. Caldwell, Tomohiro Nishimura, Kazuhiko Sakurai, Kyo Tanoue: A new halisaurine mosasaur (Squamata: Halisaurinae) from Japan: the first record in the western Pacific realm and the first documented insights into binocular vision in mosasaurs. In: Journal of Systematic Palaeontology. Band 14, Nr. 10, 2. Oktober 2016, ISSN 1477-2019, S. 809–839, doi:10.1080/14772019.2015.1113447 (tandfonline.com [abgerufen am 6. April 2021]).
- D. V. Grigoriev: Reconstruction of inner ear shape and size of Mosasaurus. 2016, doi:10.13140/RG.2.1.1346.9040 (rgdoi.net [abgerufen am 6. April 2021]).
- Southern Methodist University. Geological Sciences: Investigating holocene climate change on the northern channel islands and cretaceous mosasaur ecology using stable isotopes. 72-03B. Southern Methodist University, Dallas, Tex. 2010, ISBN 978-1-124-43286-1.
- Erle G. Kauffman: Mosasaur Predation on Upper Cretaceous Nautiloids and Ammonites from the United States Pacific Coast. In: PALAIOS. Band 19, Nr. 1, 1. Februar 2004, ISSN 0883-1351, S. 96–100, doi:10.1669/0883-1351(2004)0192.0.CO;2 (geoscienceworld.org [abgerufen am 6. April 2021]).
- ABSTRACTS OF PAPERS. In: Journal of Vertebrate Paleontology. Band 15, sup3, März 1995, ISSN 0272-4634, S. 1–66, doi:10.1080/02724634.1995.10011277 (tandfonline.com [abgerufen am 6. April 2021]).
- Takuya Konishi. "Anything Mosasaur". Takuya Konishi, PhD. Archived from the original on March 24, 2021.
- Theagarten Lingham-Soliar: Palaeopathology and injury in the extinct mosasaurs (Lepidosauromorpha, Squamata) and implications for modern reptiles. In: Lethaia. Band 37, Nr. 3, September 2004, S. 255–262, doi:10.1080/00241160410006519 (wiley.com [abgerufen am 6. April 2021]).
- Anne S. Schulp; Geert H.I.M. Walenkamp; Paul A.M. Hofman; Yvonne Stuip; Bruce M. Rothschild (2006). "Chronic bone infection in the jaw of Mosasaurus hoffmanni (Squamata)" (PDF; 4,2 MB). Oryctos. 6 (2006): 41–52. ISSN 1290-4805.
- Daniel J. Field, Aaron LeBlanc, Adrienne Gau, Adam D. Behlke: Pelagic neonatal fossils support viviparity and precocial life history of Cretaceous mosasaurs. In: Palaeontology. Band 58, Nr. 3, Mai 2015, ISSN 0031-0239, S. 401–407, doi:10.1111/pala.12165 (wiley.com [abgerufen am 6. April 2021]).
- ABSTRACTS OF PAPERS. In: Journal of Vertebrate Paleontology. Band 16, sup003, 19. September 1996, ISSN 0272-4634, S. 1–80, doi:10.1080/02724634.1996.10011371 (tandfonline.com [abgerufen am 6. April 2021]).
- Alexandra Houssaye, Paul Tafforeau: What vertebral microanatomy reveals about the ecology of juvenile mosasaurs (Reptilia, Squamata). In: Journal of Vertebrate Paleontology. Band 32, Nr. 5, September 2012, ISSN 0272-4634, S. 1042–1048, doi:10.1080/02724634.2012.680999 (tandfonline.com [abgerufen am 6. April 2021]).
- James E. Martin (2002). "Juvenile marine reptiles from the Late Cretaceous of the Antarctic peninsula and their relationships to other such occurrences in central South Dakota and Belgium" (PDF). Proceedings of the South Dakota Academy of Science. 81 (2002): 53–57.
- B.M. Rothschild, L.D. Martin: Mosasaur ascending: the phytogeny of bends. In: Netherlands Journal of Geosciences. Band 84, Nr. 3, September 2005, ISSN 0016-7746, S. 341–344, doi:10.1017/S0016774600021120 (cambridge.org [abgerufen am 6. April 2021]).
- Agnete Weinreich Carlsen: Frequency of decompression illness among recent and extinct mammals and “reptiles”: a review. In: The Science of Nature. Band 104, Nr. 7-8, August 2017, ISSN 0028-1042, S. 56, doi:10.1007/s00114-017-1477-1 (springer.com [abgerufen am 6. April 2021]).
- Nathalie Bardet: Maastrichtian marine reptiles of the Mediterranean Tethys: a palaeobiogeographical approach. In: Bulletin de la Société Géologique de France. Band 183, Nr. 6, 1. Dezember 2012, ISSN 1777-5817, S. 573–596, doi:10.2113/gssgfbull.183.6.573 (geoscienceworld.org [abgerufen am 12. April 2021]).
- Elizabeth L. Nicholls, Anthony P. Russell: Paleobiogeography of the Cretaceous Western Interior Seaway of North America: the vertebrate evidence. In: Palaeogeography, Palaeoclimatology, Palaeoecology. Band 79, Nr. 1-2, Juli 1990, S. 149–169, doi:10.1016/0031-0182(90)90110-S (elsevier.com [abgerufen am 12. April 2021]).
- David B. Kemp, Stuart A. Robinson, J. Alistair Crame, Jane E. Francis, Jon Ineson: A cool temperate climate on the Antarctic Peninsula through the latest Cretaceous to early Paleogene. In: Geology. Band 42, Nr. 7, Juli 2014, ISSN 1943-2682, S. 583–586, doi:10.1130/G35512.1 (geoscienceworld.org [abgerufen am 12. April 2021]).
- Upper Maastrichtian shallow marine environments and neoselachian assemblages in North Iberian palaeomargin (Castilian Ramp, Spain). In: Cretaceous Research. Band 57, 1. Januar 2016, ISSN 0195-6671, S. 639–661, doi:10.1016/j.cretres.2015.08.001 (sciencedirect.com [abgerufen am 23. April 2021]).
- Matt Friedman (2012). "Ray-finned fishes (Osteichthyes, Actinopterygii) from the type Maastrichtian, the Netherlands and Belgium". Scripta Geologica (8): 113–142.
- Catherine R. C. Strong, Michael W. Caldwell, Takuya Konishi, Alessandro Palci: A new species of longirostrine plioplatecarpine mosasaur (Squamata: Mosasauridae) from the Late Cretaceous of Morocco, with a re-evaluation of the problematic taxon ‘ Platecarpus ’ ptychodon. In: Journal of Systematic Palaeontology. Band 18, Nr. 21, 1. November 2020, ISSN 1477-2019, S. 1769–1804, doi:10.1080/14772019.2020.1818322 (tandfonline.com [abgerufen am 23. April 2021]).
- Steven M. Stanley: Earth system history. W.H. Freeman, New York 1998, ISBN 0-7167-2882-6.
- Michael J. Everhart: Oceans of Kansas, Second Edition : a Natural History of the Western Interior Sea. 2nd ed Auflage. Indiana University Press, Bloomington, IN 2017, ISBN 978-0-253-02715-3.
- S. He, T.K. Kyser, W.G.E. Caldwell: Paleoenvironment of the Western Interior Seaway inferred from δ18O and δ13C values of molluscs from the Cretaceous Bearpaw marine cyclothem. In: Palaeogeography, Palaeoclimatology, Palaeoecology. Band 217, Nr. 1-2, Februar 2005, S. 67–85, doi:10.1016/j.palaeo.2004.11.016 (elsevier.com [abgerufen am 25. April 2021]).
- Cynthia G Fisher, Michael A Arthur: Water mass characteristics in the Cenomanian US Western Interior seaway as indicated by stable isotopes of calcareous organisms. In: Palaeogeography, Palaeoclimatology, Palaeoecology. Band 188, Nr. 3-4, Dezember 2002, S. 189–213, doi:10.1016/S0031-0182(02)00552-7 (elsevier.com [abgerufen am 25. April 2021]).
- Caitlin R. Kiernan: Stratigraphic distribution and habitat segregation of mosasaurs in the Upper Cretaceous of western and central Alabama, with an historical review of alabama mosasaur discoveries. In: Journal of Vertebrate Paleontology. Band 22, Nr. 1, 14. März 2002, ISSN 0272-4634, S. 91–103, doi:10.1671/0272-4634(2002)022[0091:SDAHSO]2.0.CO;2 (tandfonline.com [abgerufen am 25. April 2021]).
- Andrew D. Gentry, James F. Parham, Dana J. Ehret, Jun A. Ebersole: A new species of Peritresius Leidy, 1856 (Testudines: Pan-Cheloniidae) from the Late Cretaceous (Campanian) of Alabama, USA, and the occurrence of the genus within the Mississippi Embayment of North America. In: PLOS ONE. Band 13, Nr. 4, 18. April 2018, ISSN 1932-6203, S. e0195651, doi:10.1371/journal.pone.0195651, PMID 29668704, PMC 5906092 (freier Volltext) – (plos.org [abgerufen am 25. April 2021]).
- Jun Ebersole; Takehito Ikejiri; Harry Lyon Blewitt; Sandy Ebersole (2013). "An Overview of Late Cretaceous Vertebrates from Alabama". Bulletin of the Alabama Museum of Natural History. 31 (1): 46–70.
- Paulina Jiménez-Huidobro, Michael W. Caldwell: A New Hypothesis of the Phylogenetic Relationships of the Tylosaurinae (Squamata: Mosasauroidea). In: Frontiers in Earth Science. Band 7, 27. März 2019, ISSN 2296-6463, S. 47, doi:10.3389/feart.2019.00047 (frontiersin.org [abgerufen am 25. April 2021]).
- Todd D. Cook, Eric Brown, Patricia E. Ralrick, Takuya Konishi: A late Campanian euselachian assemblage from the Bearpaw Formation of Alberta, Canada: some notable range extensions. In: Canadian Journal of Earth Sciences. Band 54, Nr. 9, September 2017, ISSN 0008-4077, S. 973–980, doi:10.1139/cjes-2016-0233 (nrcresearchpress.com [abgerufen am 25. April 2021]).
- Tim T. Tokaryk, C. R. Harington: Baptornis sp. (Aves: Hesperornithiformes) from the Judith River Formation (Campanian) of Saskatchewan, Canada. In: Journal of Paleontology. Band 66, Nr. 6, November 1992, ISSN 0022-3360, S. 1010–1012, doi:10.1017/S002233600002093X (cambridge.org [abgerufen am 25. April 2021]).
- Tamaki Sato: Terminonatator ponteixensis , a new elasmosaur (Reptilia; Sauropterygia) from the Upper Cretaceous of Saskatchewan. In: Journal of Vertebrate Paleontology. Band 23, Nr. 1, 11. April 2003, ISSN 0272-4634, S. 89–103, doi:10.1671/0272-4634(2003)23[89:TPANES]2.0.CO;2 (tandfonline.com [abgerufen am 25. April 2021]).
- Tamaki Sato: A NEW POLYCOTYLID PLESIOSAUR (REPTILIA: SAUROPTERYGIA) FROM THE UPPER CRETACEOUS BEARPAW FORMATION IN SASKATCHEWAN, CANADA. In: Journal of Paleontology. Band 79, Nr. 5, September 2005, ISSN 0022-3360, S. 969–980, doi:10.1666/0022-3360(2005)079[0969:ANPPRS]2.0.CO;2 (bioone.org [abgerufen am 25. April 2021]).
- John W. Hoganson; Brett Woodward (2004). "Skeleton of the Rare Giant Sea Turtle, Archelon, Recovered from the Cretaceous DeGrey Member of the Pierre Shale near Cooperstown, Griggs County, North Dakota" (PDF). North Dakota Geological Society Newsletter. 32 (1): 1–4. Archived from the original (PDF) on June 3, 2020.
- David J. Cicimurri; Gorden L. Bell, Jr.; Philip W. Stoffer (1999). "Vertebrate Paleontology of the Pierre Shale and Fox Hills Formations (Late Campanian-Late Maastrichtian) of Badlands National Park, South Dakota" (PDF; 3,1 MB). National Park Service Paleontological Research. 4: 1–7.
- Thomas S. Tobin, Peter D. Ward, Eric J. Steig, Eduardo B. Olivero, Isaac A. Hilburn: Extinction patterns, δ18 O trends, and magnetostratigraphy from a southern high-latitude Cretaceous–Paleogene section: Links with Deccan volcanism. In: Palaeogeography, Palaeoclimatology, Palaeoecology. Band 350-352, September 2012, S. 180–188, doi:10.1016/j.palaeo.2012.06.029 (elsevier.com [abgerufen am 3. Juni 2021]).
- Rodrigo A. Otero, Sergio Soto-Acuña, David Rubilar-Rogers, Carolina S. Gutstein: Kaikaifilu hervei gen. et sp. nov., a new large mosasaur (Squamata, Mosasauridae) from the upper Maastrichtian of Antarctica. In: Cretaceous Research. Band 70, Februar 2017, S. 209–225, doi:10.1016/j.cretres.2016.11.002 (elsevier.com [abgerufen am 3. Juni 2021]).
- José P. O’Gorman, Karen M. Panzeri, Marta S. Fernández, Sergio Santillana, Juan J. Moly: A new elasmosaurid from the upper Maastrichtian López de Bertodano Formation: new data on weddellonectian diversity. In: Alcheringa: An Australasian Journal of Palaeontology. Band 42, Nr. 4, 2. Oktober 2018, ISSN 0311-5518, S. 575–586, doi:10.1080/03115518.2017.1339233 (tandfonline.com [abgerufen am 3. Juni 2021]).
- Alberto L. Cione, Sergio Santillana, Soledad Gouiric-Cavalli, Carolina Acosta Hospitaleche, Javier N. Gelfo: Before and after the K/Pg extinction in West Antarctica: New marine fish records from Marambio (Seymour) Island. In: Cretaceous Research. Band 85, Mai 2018, S. 250–265, doi:10.1016/j.cretres.2018.01.004 (elsevier.com [abgerufen am 3. Juni 2021]).
- T.L. Harrell, A. Pérez-Huerta: Habitat preference of mosasaurs indicated by rare earth element (REE) content of fossils from the Upper Cretaceous marine deposits of Alabama, New Jersey, and South Dakota (USA). In: Netherlands Journal of Geosciences - Geologie en Mijnbouw. Band 94, Nr. 1, März 2015, ISSN 0016-7746, S. 145–154, doi:10.1017/njg.2014.29 (cambridge.org [abgerufen am 3. Juni 2021]).
- Theagarten Lingham-Soliar: Unusual death of a Cretaceous giant. In: Lethaia. Band 31, Nr. 4, 29. März 2007, S. 308–310, doi:10.1111/j.1502-3931.1998.tb00520.x (wiley.com [abgerufen am 3. Juni 2021]).
- Theagarten Lingham-Soliar: Unusual death of a Cretaceous giant. In: Lethaia. Band 31, Nr. 4, 29. März 2007, S. 308–310, doi:10.1111/j.1502-3931.1998.tb00520.x (wiley.com [abgerufen am 3. Juni 2021]).
- William B. Gallagher, Carl E. Campbell, John W. M. Jagt, Eric W. A. Mulder: Mosasaur (Reptilia, Squamata) material from the Cretaceous-Tertiary boundary interval in Missouri. In: Journal of Vertebrate Paleontology. Band 25, Nr. 2, 27. Juni 2005, ISSN 0272-4634, S. 473–475, doi:10.1671/0272-4634(2005)025[0473:MRSMFT]2.0.CO;2 (tandfonline.com [abgerufen am 4. Juni 2021]).
- "GEOL 104 Lecture 38: The Cretaceous-Tertiary Extinction III: Not With a Bang, But a Whimper". University of Maryland Department of Geology. 2006. Archived from the original on March 13, 2012.
- John W. Jagt; Dirk Cornelissen; Eric W. Mulder; Anne S. Schulp; Jacques Severinjns; Louis Verding (2008). "The youngest in situ record to date of Mosasaurus hoffmannii (Squamata, Mosasauridae) from the Maastrichtian type area, The Netherlands". Proceedings of the Second Mosasaur Meeting: 73–80.
- Kunio Kaiho, Naga Oshima, Kouji Adachi, Yukimasa Adachi, Takuya Mizukami: Global climate change driven by soot at the K-Pg boundary as the cause of the mass extinction. In: Scientific Reports. Band 6, Nr. 1, September 2016, ISSN 2045-2322, S. 28427, doi:10.1038/srep28427, PMID 27414998, PMC 4944614 (freier Volltext) – (nature.com [abgerufen am 4. Juni 2021]).
Literatur
- Richard Ellis: Sea Dragons. Predators of the Prehistoric Oceans. University Press of Kansas, Lawrence KS 2003, ISBN 0-7006-1269-6.
Weblinks
- The Paleobiology Database
- Mosasaurus – The Ultimate Mosasaur. In: Oceansofkansas.com
- Der Schädelbau des Mosasaurus. In: Oceansofkansas.com (englische Übersetzung der Arbeit von Goldfuss, 1845)
- Mosasaurus hoffmanni – The First Discovery of a Mosasaur? In: Oceansofkansas.com
- Dinoschädel nach 170 Jahren wieder vollständig. Informationsdienst Wissenschaft, 5. Februar 2007