Aussterben
Aussterben (fachsprachlich auch Extinktion) bezeichnet das Ende einer evolutionären Stammlinie infolge des Tods aller Nachkommen. Die Bezeichnung Aussterben kann sich sowohl auf eine Population als auch auf eine Art beziehen. Solange Populationen derselben Art an anderen Orten weiter existieren, handelt es sich um ein lokales Aussterben. Eine biologische Art stirbt aus, wenn das letzte Individuum der Art stirbt. Dies hat zur Folge, dass ihre genetische Information verlorengeht und die Biodiversität vermindert wird.

Die Abgrenzung der Bezeichnungen Artensterben und Massenaussterben ist unscharf. Artensterben bezieht sich vor allem auf das menschengemachte Verschwinden von Arten durch Umweltzerstörung oder Ausrottung in der Gegenwart. Massenaussterben (auch Faunenwechsel) bezeichnet hingegen ein auffallend großes, weit zurückliegendes Verschwinden von Arten im Verlauf von einigen tausend bis mehreren hunderttausend Jahren ohne anthropogenen Einfluss.
Das Aussterben von Arten gilt mit Blick auf geologische Zeitspannen als unausweichliches Schicksal der meisten Populationen und Arten. Die begrenzte Lebensspanne von Arten resultiert allerdings nicht ausschließlich auf Aussterbevorgängen: Häufig spalten sich Arten durch das Einwirken von Evolutionsfaktoren in zwei oder mehr – von der Ursprungsart unterscheidbare – Tochterarten auf (siehe: Artbildung); auch kann es zur Hybridisierung einer Art mit einer verwandten Art kommen.[1]
Definition durch die Weltnaturschutzunion IUCN
Die International Union for Conservation of Nature and Natural Resources (IUCN) hat im Februar 2000 folgende Definition für die Einordnung einer Art als „ausgestorben“ (extinct) in der von ihr publizierten Rote Liste gefährdeter Arten veröffentlicht:
- „Ein Taxon ist ausgestorben, wenn es keinen vernünftigen Zweifel daran gibt, dass das letzte Individuum gestorben ist. Ein Taxon gilt als ausgestorben, wenn gründliche Untersuchungen in bekannten und/oder vermuteten Habitaten während geeigneter Zeiten (täglich, saisonal, jährlich) in seinem historischen Verbreitungsgebiet kein Individuum haben nachweisen können. Die Untersuchungen sollten sich über ein Zeitfenster erstrecken, das dem Lebenszyklus und der Lebensweise des Taxons entspricht.“[2]
Ursachen und Mechanismen
Damit eine Population ausstirbt, muss ihre Wachstumsrate negativ werden (unter Null fallen). Eine dauerhaft negative Wachstumsrate durch deterministische Faktoren, z. B. durch neu eingewanderte überlegene Konkurrenten oder Prädatoren (einschließlich des Menschen) führt unweigerlich zum Aussterben, egal wie groß die Population am Anfang war. Zeitweilige negative Wachstumsraten sind allerdings nicht selten und in den meisten Populationen von Zeit zu Zeit zu beobachten. Ist die Population sehr groß, ist sie länger in der Lage, solche Schrumpfungsphasen zu überdauern. Bevor eine Art ausstirbt, nimmt ihre Populationsgröße meist schon längere Zeit vorher ab.
Die Gründe für den Populationsschwund und für das endgültige Aussterben müssen dabei nicht identisch sein. Die Gründe für das (nicht deterministisch vorgegebene) Aussterben lassen sich in verschiedene Kategorien einteilen, die für das Aussterberisiko der betreffenden Population unterschiedliche Wirkungen haben.[3][4]
- demographische Zufallsschwankungen. Die Populationsgröße einer Art unterliegt ständigen zufälligen Schwankungen von Generation zu Generation und von Jahr zu Jahr. Bei kleinen Populationen kann so einfach per Zufall, in einer Reihe von schlechten Jahren, die aufeinander folgen, die Populationsgröße auf Null absinken. Sind nur sehr wenige Individuen vorhanden, können z. B. zufällig alle Nachkommen demselben Geschlecht angehören. Aussterben wegen demographischer Zufallsschwankungen ist vor allem bei sehr kleinen Populationen bedeutsam. Das Aussterberisiko durch diesen Faktor steigt fast exponentiell mit schrumpfender Populationsgröße.
- Schwankungen der Umweltbedingungen. Die Umweltbedingungen sind für eine Art in unterschiedlichen Jahren unterschiedlich günstig, beispielsweise hängt die Fortpflanzungsrate der meisten Arten stark von den Wetterbedingungen ab. Schwankungen der Umweltbedingungen treten in unterschiedlicher Amplitude auf. Typischerweise sind dabei kleine Ausschläge erheblich häufiger als große. Sehr große Abweichungen von den normalen Bedingungen werden meist als Katastrophen bezeichnet. Katastrophen sind definitionsgemäß selten, treten aber innerhalb der langen Lebensdauer einer Population oder Art in langen Zeiträumen fast mit Sicherheit immer wieder einmal auf, was bei der Vorhersage der Überlebenswahrscheinlichkeit oft übersehen wird.[5] Das Risiko für Aussterben wegen Umweltschwankungen hängt weniger von der Populationsgröße als solcher als von der Größe des Verbreitungsgebiets und der Anzahl der Lokalpopulationen einer Art ab.
- reduzierte genetische Fitness. In sehr kleinen Populationen steigt das Aussterberisiko auch aus genetischen Gründen an. Einerseits können weniger Individuen auch nur weniger Varianten ihrer Gene (Fachbegriff: Allele) tragen. Deswegen wird die Art uniformer und verliert Reaktionsmöglichkeiten bei veränderten Bedingungen. Andererseits sind in sehr kleinen Populationen meist sehr viele Individuen miteinander verwandt. Durch Paarung unter Verwandten (Inzucht) sinkt die Verschiedenheit der Allele in den Nachkommen (Heterozygotie) ab, da sie zunehmend von beiden Elternteilen dieselben Allele erhalten. Homozygote Individuen sind in verschiedener Hinsicht genetisch benachteiligt. Einerseits sinkt die Effektivität ihrer Immunabwehr und damit der Widerstand gegen Krankheiten, andererseits können (durch Fixierung rezessiver Allele) schädliche Mutationen in den Vordergrund treten (Inzuchtdepression). Seltene, ungünstige Mutationen können durch Gendrift aus Zufall oder wegen der verminderten Effektivität der Selektion[6] die Population viel leichter als in großen Populationen dominieren. Unter ungünstigen Bedingungen kommt so eine Kettenreaktion in Gang: In der verkleinerten Population kommt es häufiger zu Paarungen unter Verwandten. Damit sinkt die genetische Verschiedenheit (Heterozygotie) der Nachkommen. Dies führt zur Anhäufung und verstärkten Wirkung nachteiliger rezessiver Allele. Deswegen sinken die Fruchtbarkeit und die Vitalität der Individuen ab. In einer dadurch weiter verkleinerte Population verstärkt sich dieser Prozess immer weiter bis zum Aussterben. Dieses Szenario wird als „Aussterbestrudel“ (engl. extinction vortex) bezeichnet. Auch wenn die Population dem Aussterbestrudel entgehen kann, ist nach einer Erholungsphase ihre genetische Variabilität geringer als vorher, weswegen ihr Aussterberisiko bei gleicher Populationsgröße höher liegen kann. Dieser Effekt wird als Genetischer Flaschenhals bezeichnet.
Der Effekt, dass geringe Populationsgrößen, unabhängig von den jeweils im Einzelnen wirksamen Mechanismen, das Aussterberisiko von Populationen deutlich erhöhen können, wird als Allee-Effekt beschrieben. Ist ein solcher Effekt wirksam, muss dies bei der Vorhersage des Aussterberisikos unbedingt berücksichtigt werden, weil ansonsten das Risiko massiv unterschätzt wird.[7]
Bevor die angeführten Mechanismen eine Art bedrohen können, muss zuvor ihre Populationsgröße unter einen je nach Art verschiedenen Schwellenwert abgefallen sein (Ausnahme: Massenaussterben wegen global wirkender Katastrophen). In allen direkt beobachtbaren Fällen von Aussterbeereignissen geht dies auf Einwirkungen durch den Menschen zurück. Die Auswertung von Fossilien ergab zwar, dass im Prinzip zu jeder Zeit, also auch in der Gegenwart, einige Arten aus natürlichen Gründen aussterben werden. Die Höhe dieser Basis-Aussterberate ist nicht sicher bekannt, sie liegt aber mit Sicherheit sehr niedrig. Der amerikanische Paläontologe Jack Sepkoski hat sie in einer Hochrechnung auf im globalen Durchschnitt etwa drei Arten im Jahr abgeschätzt.[8] Tatsächlich ist in der Wissenschaft nicht eine einzige lebende (d. h. nicht nur fossil bekannte) Art sicher identifiziert worden, die in der gegenwärtigen Zeit aus rein natürlichen Gründen ausgestorben wäre. Der Populationsschwund geht dabei dem eigentlichen Aussterben voraus.[9] In vielen Fällen bleiben bei dem Schwund einige kleine Reliktpopulationen zunächst noch verschont, wenn die Art bereits den größten Teil ihrer ehemaligen Populationsgröße und ihres Verbreitungsgebiets verloren hat. Im Falle von Wirbeltieren sind die letzten Überlebenden manchmal auch vom Menschen gehaltene Tiere in Zoos oder Gehegen.[10] Das Aussterben der Reliktpopulationen erfolgt meist aus einem der oben genannten Gründe, auch wenn der eigentlich zum Aussterben führende Populationsrückgang andere Ursachen hatte. Die wesentlichen Ursachen für den Populationsschwund selbst fallen meist in eine der folgenden Kategorien:[11]
- Overkill. Ausrottung durch Jagd, Fischfang und direkte Verfolgung.
- Habitatzerstörung und Habitatfragmentierung (Verinselung)
- Prädation oder Konkurrenz eingeführter Arten (Neobiota)[12]
- Aussterbeketten. Folge-Aussterben, nachdem andere Arten, die wesentlich für das Überleben der Art waren, ausgestorben sind.
Aussterben durch direkte Verfolgung
Infolge direkter Verfolgung sterben vor allem Arten, meist Wirbeltierarten mit niedriger intrinsischer Wachstumsrate, aus, die vom Menschen auf der Jagd oder im Fischfang genutzt werden. Von weitaus geringerer Bedeutung, obwohl in einigen Fällen nachgewiesen und öffentlich stark beachtet, sind Bedrohungen für Populationen, die von Raritätenliebhabern, für wissenschaftliche Sammlungen oder für die Haltung in Gehegen und Zoologischen Gärten besammelt werden. In vielen Fällen greifen direkte Verfolgung, Habitatänderung und Einschleppung fremder Arten in schwer durchschaubarer Weise ineinander, vor allem beim Aussterben von Arten auf kleinen ozeanischen Inseln.[13] Historisch gut belegte Fälle von Aussterben als Folge von Übernutzung sind z. B. Stellers Seekuh oder Riesenalk. Die durch Habitatzerstörung in kleine Reservate verdrängten letzten Populationen vieler großer und charismatischer Wirbeltierarten sind hier von Wilderei bis zur Ausrottung bedroht. In vielen Fällen ist aber auch bei Übernutzung, die eine Population stark reduziert, der direkte Nachweis der Ausrottung infolge Bejagung schwer zu führen. So ist z. B. bei keiner im Meer lebenden Fischart die globale Ausrottung durch Überfischung wirklich nachgewiesen, obwohl die Bestände vieler Arten stark zurückgegangen sind und auch die Gesamterträge seit Jahren abnehmenden Trend zeigen.[14] Steigende Preise bei Seltenheit und ökonomisches Kalkül (es kann rein ökonomisch rational sein, eine Art mit sehr langsam wachsender Population lieber jetzt auszurotten, als auf den zukünftigen Ertrag zu warten: Abdiskontierung, vgl. Abzinsung und Aufzinsung)[15] sind eine unmittelbare Bedrohung für viele Arten, deswegen ist z. B. der Südliche Blauflossen-Thunfisch akut vom Aussterben bedroht.
Neben der Ausrottung infolge Bejagens in der Neuzeit wird auch eine Ausrottung vieler Arten in prähistorischen Zeiten durch diesen Faktor diskutiert. Fast zweifelsfrei belegt ist die Ausrottung fast aller großen Landwirbeltiere auf den großen Inseln Neuseeland und Madagaskar nach der Einwanderung von Menschen, die hier erst vor wenigen tausend Jahren erfolgte. Ebenfalls diskutiert, aber stark umstritten ist auch das Aussterben von Arten wie das Amerikanische Mastodon oder das Wollnashorn mit menschlicher Bejagung zu begründen (zu dieser Hypothese vgl. unter Quartäre Aussterbewelle).
Aussterben durch Habitatzerstörung
Es ist unmittelbar einsichtig, dass Arten aussterben, wenn ihr Lebensraum, z. B. durch menschliche Nutzung, zerstört wird. Vielfach reicht es schon aus, wenn der Lebensraum als solcher erhalten bleibt, aber in der Folge von Nutzungseinflüssen verändert (degradiert) wird. Wenn für unsere Zeit ein Massenaussterben mit Aussterberaten vorhergesagt wird, die um das Tausendfache bis Zehntausendfache über der natürlichen Aussterberate liegen,[16] wird dafür an erster Stelle der Effekt von Habitatzerstörungen verantwortlich gemacht.[17] Im Einzelnen sind die Verhältnisse allerdings verwickelter. Verliert eine Art einen Teil ihres Lebensraums, so kann der verbleibende Anteil unter Umständen für ein sehr langes, möglicherweise sogar ein fast unbegrenztes, Überleben ausreichen. Arten können auch auf neue, von menschlicher Einwirkung veränderte Lebensräume übergehen, wenn die Art nicht zu selten und der neue Lebensraum dem bisherigen Habitat ähnlich genug ist.[18] Außerdem ist es sehr schwierig, den Nachweis zu führen, dass eine Art auf diese Weise tatsächlich ausgestorben ist: Möglicherweise existieren ja an anderen, bisher nicht untersuchten Stellen noch weitere Populationen. Die Wiederentdeckung ausgestorben geglaubter Arten wird als Lazarus-Effekt bezeichnet, sie ist bei Habitatzerstörung als Ursache häufiger als in anderen Fällen.[19] Von den meisten Arten global ist weder ihr Verbreitungsgebiet noch ihre Biologie bekannt, nicht wenige tropische Insektenarten sind nur von einer einzigen Lokalität (oft genug nur einem einzigen Exemplar) beschrieben worden. Der tatsächliche Nachweis des Aussterbens solcher Arten ist beinahe unmöglich zu führen, selbst wenn die Wahrscheinlichkeit dafür überwältigend ist. Dieses Problem betrifft in besonderer Weise die tropischen Regenwälder, die zugleich die artenreichsten und die am schlechtesten erforschten Lebensräume weltweit sind. Obwohl auch hier in vielen Fällen durchaus das Aussterben von Arten direkt nachweisbar ist,[20] wird hier meist vom Ausmaß der Lebensraumzerstörung und dessen durchschnittlichem Artenreichtum indirekt auf den Artenverlust geschlossen.
Besonders stark erhöht der Lebensraumverlust das Aussterberisiko von Arten mit sehr kleinem Verbreitungsgebiet, diese werden Endemiten genannt. Regionen, die zahlreiche endemische Arten aufweisen und deswegen besonders artenreich sind, versucht man als Biodiversitäts-Hotspots zu identifizieren. Zerstörung eines solchen Hotspots führt zu besonders hohen Artenverlusten. So sind z. B. als Folge der Entwaldung der nur 20 Quadratkilometer großen Centinella-Bergkette in Ecuador allein 100 endemische Pflanzenarten ausgestorben.[21] Ecuador allein besitzt etwa 20.000 Pflanzenarten, davon ca. 4000 Endemiten. Im deutlich größeren Deutschland leben insgesamt nur gut 4000 Pflanzenarten.
Verinselung und Metapopulationen
Viele Arten haben keinen zusammenhängenden Lebensraum, sondern leben in räumlich getrennten Teilhabitaten. Findet zwischen diesen selten, aber regelmäßig Individuenaustausch statt, wird dies als Metapopulation beschrieben.[22] In einer Metapopulation können die lokalen Subpopulationen aus stochastischen Gründen (vgl. o.) aussterben. Die dann frei gewordene Habitat-Insel kann anschließend aber eventuell von wandernden (migrierenden) Individuen derselben Art aus einer anderen Subpopulation neu kolonisiert werden. Dies wird als „rescue effect“ (Übersetzung wäre: Rettungs-Effekt) bezeichnet. Die als Modell in der Ökologie sehr einflussreiche Gleichgewichtstheorie der Biogeographie von Inseln (vgl. Inselbiogeographie)[23] sagt für den Artenbestand von Inseln einen Artenbestand voraus, der sich als Gleichgewicht zwischen Aussterben und Neubesiedlung einstellt. Entscheidend für den Artenbestand sind die Größe der Insel (beeinflusst das Aussterben) und ihre Isolation von anderen Inseln (beeinflusst die Wiederbesiedlung). Trifft dieses Modell zu, führt neben der flächenmäßigen Verkleinerung von Lebensräumen auch ihre Isolation (oder Verinselung) selbst bei gleichbleibender Gesamtfläche zu erhöhter Aussterberate. Um diese Arten zu retten, versucht der Naturschutz einen Biotopverbund einzurichten.
Der Metapopulations-Ansatz stellt eine Modellvorstellung über Wahrscheinlichkeit und Ablauf von Aussterbevorgängen dar. Dabei stirbt jede einzelne Subpopulation aus einem bestimmten, aber auf längere Sicht betrachteten eher zufälligen Grund aus. Erst bei der großräumigen oder übergeordneten Betrachtung wäre das Muster erkennbar. Innerhalb der Ökologie sind in den vergangenen Jahrzehnten viele Indizien zusammengetragen worden, dass Zerschneidung (Habitatfragmentierung) zusammenhängender Lebensräume und deren räumliche Isolation das Aussterberisiko erhöhen.[24]
Aussterbeschuld
Dem Metapopulations-Ansatz zufolge sterben bei Habitatverkleinerung und Isolation die betroffenen Arten nicht sofort aus. Vielmehr erlöschen erst nach und nach immer mehr Subpopulationen, die nicht mehr über den Rettungseffekt neu begründet werden. Wird ein vorher zusammenhängender Lebensraum in kleinere Teilhabitate zerschnitten, ist es dann wahrscheinlich, dass die verbleibenden Habitatinseln zunächst fast alle Arten des Ursprungshabitats enthalten. Dieser hohe Artbestand ist dann aber nicht mehr im Gleichgewicht mit den neuen Bedingungen. Es ist zu erwarten, dass im Laufe der Zeit zahlreiche Arten nach und nach aussterben werden. Für einen lokalen Beobachter wäre dieses Aussterben unerklärlich, weil sich die Größe und Habitatqualität der von ihm untersuchten Insel (z. B. eines Schutzgebiets) gar nicht verschlechtert hätte. Für diesen, von der Theorie vorhergesagten Arten-Überhang wurde der Begriff der Aussterbeschuld eingeführt.[25][26] Dieses Modell für Aussterbevorgänge gilt als plausibel, wenn auch nicht von allen Forschern akzeptiert.[27][28]
Aussterben durch Neobiota
Eingeschleppte oder absichtlich in neue Regionen eingeführte Tierarten und Pathogene gehören zu den wichtigsten Ursachen für das Aussterben von Tier- und Pflanzenarten. Aussterben durch eingeschleppte Pflanzenarten (Neophyten) scheint hingegen selten zu sein. Das Aussterben wird in der Regel von Prädation oder Parasitismus, nur selten von der Konkurrenz der Arten verursacht. Eingeschleppte, konkurrenzüberlegene Arten verdrängen vorhandene in der Regel nicht vollkommen, sondern lassen ihnen eine Teilnische, die zumindest für Reliktvorkommen ausreicht, übrig. Möglicherweise reichte aber bisher in vielen Fällen auch einfach die verstrichene Zeit nicht zur völligen Verdrängung aus, so dass für die Zukunft hier noch weitere Fälle zu erwarten sind.[29] Exotische Pathogene sind eine starke Bedrohung, weil die betroffenen Arten nicht, wie die ursprünglichen Wirte im Originalverbreitungsgebiet des Pathogens, mit dem Erreger koevolviert sind. Prädatoren bedrohen besonders stark die Fauna von ozeanischen Inseln, die aufgrund ihrer geringen Größe oft keine eigenen Prädatoren besaßen, weswegen die Arten keine Schutzmechanismen besitzen (oder früher besessene rückgebildet haben) und so besonders anfällig sind. So sind etwa auffallend viele Vogelarten auf kleinen Inseln flugunfähig.
Aussterben durch Prädatoren
Ein klassisches Beispiel für die Ausrottung durch eingeführte Prädatoren bilden die pazifischen Inseln. Auf der Insel Guam[30] verursachte die in den 1940er Jahren eingeschleppte Braune Nachtbaumnatter (Boiga irregularis) bis heute das Aussterben von zehn der ursprünglich zwölf einheimischen Vogelarten. Mit der Bekämpfung der Schlangen und über Nachzuchten gelang es, die endemische Guamralle (Rallus owstoni) gerade noch vor dem Aussterben zu bewahren. Auf der Lord-Howe-Insel 570 km vor Australien rotteten von Schiffsbesatzungen ausgesetzte Schweine und andere Säugetiere die endemische Lord-Howe-Waldralle (Gallirallus sylvestris) bis auf eine Reliktpopulation auf einem unzugänglichen Felsenplateau aus, die Art konnte nur mit Nachzuchten und Zurückdrängen der Schweine (durch Bejagung) gerettet werden. Die meisten pazifischen Vogelarten, insbesondere die flugunfähigen Rallen, hatten nicht soviel Glück. Funde von subfossilen Knochen[31] stützen die Annahme, dass nahezu jede pazifische Insel ihre eigene endemische Rallenart (neben zahllosen weiteren Vogelarten) hatte. Hauptursache des Aussterbens waren hier wohl meist die von den eingewanderten Polynesiern eingeschleppten Ratten, insbesondere die Pazifische Ratte (Rattus exulans) (wobei sicherlich direkte Verfolgung auch eine Rolle spielte). Die Verluste werden auf ca. 50 % des gesamten Artenbestands abgeschätzt.[32] Damit könnten allein hier 20 % der Vogelarten weltweit ausgestorben sein.
Aussterben durch Pathogene
Der wahrscheinlich schlimmste Fall von Aussterben durch eingeschleppte Pathogene bildet das weltweite Amphibiensterben infolge der Chytridiomykose, einer Hautpilzerkrankung. Der Ursprung des Erregers liegt im Dunkeln. Wahrscheinlich geht er auf die Kreuzung mehrerer weniger pathogener Stämme zurück, die durch Amphibientransporte miteinander in Kontakt geraten waren.[33] Eine wichtige Rolle könnten afrikanische Krallenfrösche (Xenopus) spielen, die früher für einen Schwangerschaftstest weltweit gezüchtet und gehandelt worden waren. Das Ausmaß des Artensterbens ist kaum abschätzbar, betrifft aber vermutlich Hunderte von Arten und kann zum Aussterben ganzer bisher artenreicher Gattungen führen.
Aussterben in geologischen Zeitepochen
Über Aussterbevorgänge in früheren Epochen sind wir ausschließlich durch Auswertung von Fossilien informiert. Da Aussagen über Populationen und Populationsstrukturen hier naturgemäß unmöglich sind, ist die Basis der Betrachtung hier die Morphospezies. Eine Morphospezies gilt als ausgestorben, wenn Exemplare mit vergleichbarer Morphologie weder in späteren fossilen Horizonten noch an lebenden (extanten oder auch rezenten) Exemplaren vorkommen. Eine Morphospezies stirbt also durch „echtes“ Aussterben oder durch evolutionären Formwechsel (Anagenese), mit oder ohne Artenaufspaltung (Kladogenese), aus. Die Lebensdauer einer Art (oder einer höheren taxonomischen Einheit) ist extrem variabel. So lebte eine Ammonitenart im Erdmittelalter durchschnittlich nur 0,5 Millionen Jahre, eine Gattung 0,7 Millionen Jahre.[34] Die durchschnittliche Lebensdauer von Arten ist einmal auf eine Größenordnung von etwa 4 Millionen Jahren abgeschätzt worden.[35] Arten oder Gattungen mit extrem langer Lebensdauer, die z. T. hunderte von Millionen Jahren ohne erkennbare morphologische Änderung bestehen, werden als Lebendes Fossil bezeichnet. Alle übrigen fossil nachgewiesenen Morphospezies, das sind weit mehr als 99 %, sind irgendwann ausgestorben.
Betrachtet man die Aussterberate von Arten oder höheren taxonomischen Einheiten über die geologischen Epochen, so ist diese nicht gleichmäßig. Die Aufteilung in Erdzeitalter (vgl. Geologische Zeitskala) beruht ja gerade darauf, dass die verschiedenen Epochen jeweils durch einen markanten Faunenwechsel gegeneinander abgesetzt sind. Dies ist nur durch erhöhte Aussterberaten am Ende des jeweiligen Zeitalters möglich. Trägt man die Lebensdauer aller fossil überlieferten Arten über die geologische Zeit auf, so ragen fünf Massenaussterben mit gegenüber dem Hintergrund massiv erhöhter Aussterberate heraus.[36] Das bekannteste Massenaussterben an der Kreide-Paläogen-Grenze mit dem Aussterben der Dinosaurier wird heute mit dem Einschlag eines Meteoriten in Verbindung gebracht. Für das größte Aussterbeereignis in der Erdgeschichte an der Perm-Trias-Grenze gelten überwiegend die großflächigen Magmaausflüsse des Sibirischen Trapps als Hauptursache.[37] Aber auch in den übrigen Zeiträumen starben Arten nicht mit gleichmäßiger Rate, sondern in bestimmten Epochen mehr oder weniger stark gehäuft, aus. Obwohl zahlreiche Forscher der Ansicht sind, die Massenaussterben wären einfach die markantesten dieser Aussterbepulse, herrscht heute die Ansicht vor, dass Aussterbevorgänge während eines Massenaussterbens sich in irgendeiner Form von normalen Aussterbevorgängen unterschieden. So sind z. B. Faktoren, die in normalen Zeiten die Wahrscheinlichkeit des Aussterbens einer Linie vermindern, während eines Massenaussterbens offenbar unwirksam.[38]
Nach einem Massenaussterben steigt, mit einer gewissen Verzögerung, die Rate der Neuentstehung von Arten stark an, so dass nach etwa fünf bis zehn Millionen Jahren die frühere Anzahl (bei allerdings möglicherweise stark veränderter Zusammensetzung) wieder erreicht sein kann.[39][40]
Intrinsische Ursachen für Aussterben
Vor der Durchsetzung der synthetischen Evolutionstheorie waren auf der Theorie der Orthogenese gründende Vorstellungen weit verbreitet, dass Arten so etwas wie eine „natürliche Lebensspanne“ besitzen, und dass sie durch „Stammesalterung“ aussterben, wenn ihre Lebenskraft verbraucht ist. Diese Vorstellungen haben in der modernen Theorie keine Basis mehr. Es werden aber nach wie vor Mechanismen vorgeschlagen, nach denen eine Art möglicherweise doch aus inneren Gründen, das heißt nicht durch Änderung der Umweltbedingungen oder Interaktion mit anderen Arten wie z. B. Konkurrenz oder Prädation, aussterben könnte. Diese Theorien sind mehr oder weniger spekulativ.
Diskutiert werden z. B. die folgenden Mechanismen:
- Evolutionary Suicide: selektionsgetriebenes Aussterben durch Fehlanpassung aufgrund intraspezifischer Konkurrenz.
- Telomer Erosion des Erbgutes: Aussterben durch sukzessive Verkürzung der Telomere über Generationen.[41][42]
Populäre Beispiele ausgestorbener Arten seit Ende des Pleistozäns

- Europa
- Mammute: große, stark behaarte nahe Verwandte des Elefanten. Sie kamen in Europa, Asien, Afrika und Nordamerika vor.
- Säbelzahnkatzen der Gattung Homotherium starben vor ca. 30.000 Jahren im Gebiet der damals trockenen Nordsee aus und in Nordamerika vor 10.000 Jahren
- Neandertaler starb vor ca. 30.000 Jahren aus
- Auerochse, die wild vorkommende Stammform des Hausrinds, ausgestorben 1627
- Wollnashorn starb vor ca. 12.000 Jahren aus
- Höhlenlöwe (Panthera spelaea) und Mosbacher Löwe (Panthera fossilis): beides sind Großwildkatzen und Verwandte des in Afrika und Asien lebenden und durchschnittlich kleineren Löwen
- Höhlenbär (Ursus spelaeus): die Kopf-Rumpf-Länge betrug bis zu 3,5 Meter, seine Schulterhöhe ungefähr 1,70 Meter
- Riesenalk (Alca impennis, ehem. Pinguinus impennis): der „Pinguin“ der Nordhalbkugel, ein flugunfähiger Seevogel wurde im 18. Jahrhundert durch Bejagung ausgerottet
- Riesenhirsch (Megaloceros): eine Gattung von Hirschen, die eine Schulterhöhe von zwei Metern erreichte und ein Geweih mit einer Spannweite von 3,6 Metern aufwies
- Tarpan: europäische Unterarten des Wildpferds
- Asien
- Säbelzahnkatzen der Gattung Megantereon starben vor ca. 500.000 Jahren aus
- Australien
- Riesenbeuteltier (Diprotodon): eine Gattung von Beuteltieren, die einem Nashorn ohne Horn ähneln. Sie erreichten eine Schulterhöhe von 2 Metern, eine Länge von 3 Metern und ein Gewicht von rund 2,8 Tonnen.
- Beutellöwe (Thylacoleonidae): eine ganze Familie von Beuteltieren
- Schwarzer Emu (Dromaius ater): eine Laufvogelart, die auf King Island bis 1805 wild vorkam. Das letzte Exemplar starb 1822 im Pariser Zoo.
- Donnervögel (Dromornithidae): flugunfähige große Vögel, die aber eher den Entenvögeln zuzuordnen sind. Sie wurden bis zu 3 Metern hoch und eine halbe Tonne schwer.

- Neuseeland
- Moas (Dinornithidae): eine Familie der Laufvögel ähnlich dem heutigen Vogelstrauß
- Haastadler (Harpagornis moorei): ein 10–14 Kilogramm schwerer Greifvogel mit einer Spannweite von bis zu 3 Metern. Es wird angenommen, dass er der natürliche Räuber der Moas war.

- Nordamerika
- Säbelzahnkatzen der Gattungen Smilodon und Homotherium starben vor ca. 10.000 Jahren aus
- Wandertaube (Ectopistes migratorius): eine massenhaft vorkommende und erst in jüngster Zeit ausgerottete Taube
- Karolinasittich (Conuropsis carolinensis): ähnlich wie die Wandertaube erst kürzlich durch Bejagung ausgerottet
- Cervalces scotti: vergleichbar mit dem europäischen Riesenhirsch
- Süd- und Mittelamerika
- Jamaika-Affe (Xenothrix mcgregori): endemische Affenart, lebte wahrscheinlich bis ins 18. Jahrhundert
- Karibische Mönchsrobbe (Monachus tropicalis): tropische und subtropische Robbenart. Wahrscheinlich durch Verproviantierung in jüngerer Zeit ausgerottet.
- Nebengelenktiere wie die großen Bodenfaultiere („Riesenfaultiere“), etwa Megatherium, oder die gesamte Gruppe der Glyptodontidae, nähere Verwandte der Gürteltiere, verschwinden zum Ende des Pleistozäns
- Madagaskar
- Elefantenvögel (Aepyornithidae): eine ganze Familie von großen Laufvögeln, die eine Kopfhöhe von 3,5 Metern bei einem Gewicht von 500 Kilogramm erreichten. Letzte Arten dieser Familie sollen bis ins 17. Jahrhundert gelebt haben.
- Riesenlemuren: drei Arten von Primaten, die aber aus zwei unterschiedlichen Familien stammen, den Koalalemuren und den Faultierlemuren. Sie lebten wahrscheinlich bis ins 15. Jahrhundert
- Mauritius
- Dodo oder auch Dronte (Raphus cucullatus): ein flugunfähiger Vogel, der gegen 1690 ausgerottet wurde.
- Nordpolarmeer
- Stellers Seekuh oder auch Stellersche Seekuh, Riesenseekuh, Borkentier (Hydrodamalis gigas): eine Seekuhart, die wegen ihres Fleisches gefangen und binnen weniger Jahre nach ihrer Entdeckung ausgerottet wurde.
Aktuelle Situation
Neueste Erhebungen gehen davon aus, dass die derzeitige Aussterberate von 3 bis 130 Arten pro Tag um den Faktor 100 bis 1.000 über dem natürlichen Wert liegt.[44] Nach einer Studie des Stockholm Resilience Centre von 2009 ist der ermittelte Grenzwert für das verkraftbare Aussterben von Arten bereits um über 1.000 % überschritten und ist damit noch vor dem Klimawandel das größte ökologische Problem; es ist damit auch ein wesentliches Merkmal des Anthropozäns.
Ursprünglich wollte die UNO mit ihrer Biodiversitätskonvention von 1992 das weltweite Artensterben bis ins Jahr 2010 gestoppt haben, dem internationalen Jahr der Biodiversität. Mit dem Nagoya-Protokoll allerdings wurde dieses Ziel auf das Jahr 2020 verschoben. Mittlerweile sterben laut dem Bericht der Vereinten Nationen zur Artenvielfalt bis zu 130 Tier- und Pflanzenarten täglich. Als entscheidende Einflüsse werden dabei genannt:[45]
- die Art der Landnutzung (Land- und Forstwirtschaft) mit ihrem rasanten Flächenverbrauch und der damit einhergehenden Waldvernichtung und Bodendegeneration
- die so genannten invasiven Arten, welche einheimische Arten verdrängen
- der aktuelle Klimawandel
- die chemische Belastung unserer Umwelt und der Landwirtschaft.
Ein im Auftrag der „UN-Biodiversitätskommission“ im Frühjahr 2010 veröffentlichte Bericht zieht eine katastrophale Bilanz: ein Autor vergleicht die heutige Situation mit der vor dem Aussterben der Dinosaurier vor 65 Millionen Jahren. Man sehe „die Vorboten des 6. Massenaussterbens während der Erdgeschichte“ und befürchtet „Tipping Points“: plötzliche, unvorhersehbare Situationen oder Ereignisse, welche umgehend eine ganze Kaskade von nicht kalkulierbaren Folgen innerhalb komplexer, ganzer Systeme, auch für die Menschheit, auslösen können. Es wird der Übergang von einem graduellen Artensterben zu einem mit Verlusten katastrophalen Ausmaßes beschrieben, das nur sehr schwer umkehrbar sei. Die Auswirkungen unserer Bevölkerungsentwicklung und Konsummuster müssten in die Bilanz unseres ökonomischen Handelns integriert werden. Biodiversität und Biologie sollten zu den maßgeblichen Richtlinien auch der Klimapolitik werden. Als Gegenstrategie wird ein radikales Umsteuern mit der Einführung einer globalen Kohlenstoffsteuer sowie u. A. die Schaffung eines Weltbiodiversitätsrates IPBES analog der Institution des "Weltklimarates" IPCC vorgeschlagen. Allerdings sei die dort angepeilte Beschränkung der Erderwärmung von maximal zwei Grad Celsius zu viel für unser Ökosystem. Der Bericht wurde im Herbst 2010 vor der UN-Vollversammlung diskutiert, kurz vor dem Welt-Biodiversitätsgipfel in Japan.[46]
Nach einer Studie der Brown University vom September 2014 könnte die aktuelle Aussterberate um Einiges schlimmer sein als bisher angenommen: Die Hintergrund-Aussterberate sei um den Faktor 10 niedriger als bisher angenommen (die aktuell bedingte Aussterberate also entsprechend höher).[47][48] Durch die globale Erwärmung wird das Aussterben von Arten deutlich beschleunigt: Werden keine Maßnahmen zur Bekämpfung des Klimawandels getroffen, sind weltweit 16 % aller Spezies vom Aussterben bedroht, wie eine 2015 in Science erschienene Reviewstudie ergab. Die dieser Studie zugrunde liegenden Einzelwerte lagen bei bis zu 54 %. Bei Einhaltung des Zwei-Grad-Ziels könnte diese Rate auf 5,2 % reduziert werden.[49]
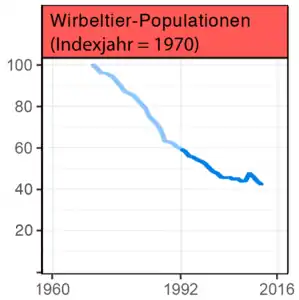
Der Jahresbericht 2014[50] der Umweltstiftung World Wide Fund For Nature (WWF) bekundet eine teilweise dramatisch zunehmende Verschlechterung der Lage vieler Arten wie zum Beispiel Nashörner (Von einer Unterart, dem „Nördlichen Breitmaulnashorn“, gebe es nur noch fünf Exemplare), Elefanten (Wilderer in Afrika erlegten mehr Elefanten, als Nachwuchs geboren werde), Löwen (in Westafrika stünden sie vor dem Aussterben, in Indien gebe es nur noch Restbestände) sowie Walrösser (sie würden Opfer des Klimawandels, ihre Ruheplätze auf Eisschollen verschwänden mit dem Rückgang des arktischen Packeises). Auch viele andere Tiere verlören ihren Lebensraum, Menschenaffen wie die Bonobos verlören ihre letzten Schutzgebiete, so sei zum Beispiel in einem Nationalpark im Kongo Erdölförderung geplant. Bei den Primaten fänden sich inzwischen 94 % auf der Roten Liste in einer der drei höchsten Gefährdungskategorien (Stand 2014). Insgesamt habe die Artenvielfalt seit den 1970er-Jahren stark gelitten und die Anzahl der Säugetiere, Vögel, Reptilien und Fische sich seitdem im Schnitt halbiert.[51]
„Der Mensch verursacht gerade das größte globale Artensterben seit dem Verschwinden der Dinosaurier“
Der alle zwei Jahre vom WWF zusammen mit der Zoologischen Gesellschaft London (ZSL) und dem Global Footprint Network (GFN) erstellte Living Planet Report (Lebender-Planet-Report) vermeldete Ende Oktober 2016 bei über 14.000 untersuchten Tierpopulationen einen weltweiten Rückgang der Tierbestände um fast 60 % während der vergangenen 40 Jahre;[52] die Bestände der Tiere in Flüssen und Seen seien weltweit im Schnitt um 81 Prozent zurückgegangen.[53]
Der im Mai 2019 erschienene Report des Weltbiodiversitätsrats (IPBES-Artenschutzkonferenz in Paris) sieht zwischen einer halben und einer Million Arten weltweit vom Aussterben bedroht. Ein Viertel aller katalogisierten Tier- und Pflanzenarten sei bereits verloren. Der Artenschwund verlaufe gegenwärtig zehn bis hundertmal schneller als im Durchschnitt während der letzten zehn Millionen Jahre. Die Wildtierpopulation hat sich laut WWF seit 1970 weltweit um 60 Prozent verringert, in Mittel- und Südamerika sogar um 89 Prozent.[54]
Artenschutz
Um die Artenvielfalt zu erhalten oder wiederherzustellen, wird der Bestand bedrohter Arten durch Schutzgebiete, Prozessschutz und Artenschutzprogramme – zum Beispiel in Zoologischen Gärten – zu sichern versucht; weitere Maßnahmen im Rahmen von Artenschutz-Programmen sind das Anlegen von Erhaltungszuchten und Erhaltungskulturen (zum Beispiel in Botanischen Gärten) und der Aufbau von Genbanken, in denen DNA-Proben dieser Arten eingelagert werden.
Erhaltungszuchten
Viele in einigen Ländern Europas oder in ganz Europa in historischer Zeit ausgestorbene Arten, werden, wenn die Art noch nicht weltweit ausgestorben ist, in Zuchtprogramme aufgenommen und in geeigneten Lebensräumen wieder ausgewildert. Außerdem versucht man die ausgestorbenen europäischen Stammformen der Haustiere durch Rückzüchtungen zu ersetzen.
„Wiederbelebung“ ausgestorbener Tierarten
Im März 2013 gelang es der University of New South Wales, lebende Embryos des Südlichen Magenbrüterfrosches (Rheobatrachus silus), einer Art aus der Gattung der Magenbrüterfrösche, durch Einnistung aufgetauter („abgestorbener“) Genome aus Tiefkühlkonservierung in Eizellen einer entfernt verwandten Froschart heranwachsen zu lassen. Zwar haben die entstandenen Embryos das Frühstadium nicht überlebt, jedoch sollen ihre Zellen im weiteren Verlauf des „Lazarus-Projekts“ dazu dienen, mittels Klonen erstmals eine ausgestorbene Tierart „wiederzubeleben“.[55]
Veröffentlichungen
Presse
- Michael Miersch: Konjunktur für Käferzähler. Sterben stündlich drei Arten aus? In: Die Zeit. Nr. 50, 2001, S. 37, abgerufen am 29. Dezember 2011
Filme
- Monsters we met in der Internet Movie Database (englisch), dt. Menschen gegen Monster – Der Kampf um unseren Planeten, behandelt das Aussterben vieler Großtierarten in Bezug auf die Ausbreitung des Menschen.
- Hubert Sauper: Darwin’s Nightmare, dt. Darwins Alptraum, F/ B/ AU, 2004, dokumentiert vielfach preisgekrönt die ökologische und wirtschaftliche Katastrophe am ostafrikanischen Viktoriasee nach dem wirtschaftlich motivierten Aussetzen des Nilbarsches und dem darauf folgenden Aussterben von über 400 verschiedenen Fischarten.
Hörfunk
- Der Rückzug der Vielfalt – Schwerpunkt zum Internationalen Jahr der Biodiversität. In: Aktuell, 20. September 2010, dradio.de, abgerufen am 29. Dezember 2011
- Susan Weber: Glanrind, Bronzepute und Sattelschwein. Immer mehr Nutztiere sind vom Aussterben bedroht. In: SWR2 Wissen, 28. Mai 2008, swr.de (mit Text- und Audio-Datei), abgerufen am 29. Dezember 2011
Siehe auch
- Tiere, die es einmal gab (Fernsehserie)
- Washingtoner Artenschutzübereinkommen
- Listen ausgestorbener Lebewesen:
- Liste ausgestorbener Tiere und Pflanzen
- ausschließlich seit dem Jahr 1500 n. Chr.:
- Liste der neuzeitlich ausgestorbenen Amphibien
- Liste der neuzeitlich ausgestorbenen Fische
- Liste der neuzeitlich ausgestorbenen Insekten
- Liste der neuzeitlich ausgestorbenen Reptilien
- Liste der neuzeitlich ausgestorbenen Säugetiere
- Liste der neuzeitlich ausgestorbenen Tiere
- Liste der neuzeitlich ausgestorbenen Vögel
- Liste der neuzeitlich ausgestorbenen Weichtiere
- Liste der neuzeitlich ausgestorbenen Pflanzen und Pilze
Liste vom Aussterben bedrohter Arten:
- Liste vom Aussterben bedrohter Arten der Niederlande
- Liste vom Aussterben bedrohter Arten im Mittel- und Schwarzen Meer
- Liste vom Aussterben bedrohter Arten im Nordostatlantik
- Liste vom Aussterben bedrohter Arten im Nordostpazifik
- Liste vom Aussterben bedrohter Arten im antarktischen Indischen Ozean
- Liste vom Aussterben bedrohter Arten im mittleren Ostatlantik
- Liste vom Aussterben bedrohter Arten im mittleren Westatlantik
Weblinks
- Global Biodiversity Outlook 2 – Bericht der Vereinten Nationen zur Entwicklung der Artenvielfalt (englisch)
- wie vor, Version 3, 2010, englisch, aufgerufen am 16. Mai 2010, 20:05 MESZ
- Artikel der Süddeutschen Zeitung zum Thema Aussterben mit interaktiver Grafik
- Liste des NABU über ausgestorbene, gefährdete Arten in Deutschland und weltweit (PDF; 268 kB)
- UN-Bericht. Eine Million Arten vom Aussterben bedroht am 6. Mai 2019 auf tagesschau.de, abgerufen am 6. Mai 2019
- swr.teleakademie vom 8. März 2020
- Können Artensterben nicht aufhalten, ORF.at, 8. Juli 2020
- Initiativen
- Artenschutz.info – Artenvielfalt bedeutet Lebensqualität, über die Ursachen des Artensterbens und die Möglichkeiten des Artenschutzes
- Artenschutzbrief – Zeitschrift für Vogel- und Artenschutz
- www.zeroextinction.org – Alliance for Zero Extinction (etwa: Allianz für Null-Artensterben, englisch)
- Aktionsgemeinschaft Artenschutz e.V.
Einzelnachweise
- Übersicht in: Judith M. Rhymer, Daniel Simberloff: Extinction by hybridization and introgression. In: Annual Review of Ecology and Systematics. Band 27, 1996, S. 83–109. doi:10.1146/annurev.ecolsys.27.1.83
- IUCN Red List Categories and Criteria, Version 3.0, S. 14.
- Russell Lande: Risks of population extinction from demographic and environmental stachasticity and random catastrophes. In: American Naturalist. Band 142, Nr. 6 1993, S. 911–927.
- Graeme Caughley: Directions in conservation biology. In: Journal of Animal Ecology. Band 63 1994, S. 215–244.
- John H. Lawton: The science and non-science of conservation biology. In: New Zealand Journal of Ecology. 21(2), 1997, S. 117–120.
- Russell Lande: Risk of population extinction from fixation of new deleterious mutations. In: Evolution. Band 48, Nr. 5, 1994, S. 1460–1469.
- Ling-ling Chen, Cang Hui: Habitat destruction and the extinction debt revisited: The Allee effect. In: Mathematical Biosciences. Band 221, Nr. 1, 2009, S. 26–32. doi:10.1016/j.mbs.2009.06.003
- J. John Sepkoski Jr.: Rates of speciation in the fossil record. In: Philosophical Transactions of the Royal Society London. Series B, 353, 1998, S. 315–326. doi:10.1098/rstb.1998.0212
- für Säugetiere vgl. Gerardo Ceballos, Paul R. Ehrlich: Mammal Population Losses and the Extinction Crisis. In: Science. Band 296, 2002, S. 904–907.
- bei den Säugetieren sind das zurzeit zwei Arten: Säbelantilope und Davidshirsch Jan Schipper et al.: The Status of the World’s Land and Marine Mammals: Diversity, Threat, and Knowledge. In: Science. Band 322, 2008, S. 225–230. doi:10.1126/science.1165115
- Jared Diamond: Overview of recent extinctions. In: D. Western, M. Pearl (Hrsg.): Conservation for the Twenty-first Century. Oxford University Press, New York 1989, S. 37–41.
- Miguel Clavero, Emili Garcıa-Berthou: Invasive species are a leading cause of animal extinctions. In: Trends in Ecology and Evolution. Band l20, Nr. 3, 2005, S. 110.
- vgl. z. B. für den Dodo: Samuel T. Turveya, Anthony S. Cheke: Dead as a dodo: the fortuitous rise to fame of an extinction icon. In: Historical Biology. Band 20, Nr. 2, 2008, S. 149–163. doi:10.1080/08912960802376199
- J. D. Reynolds, N. K. Dulvy, C. R. Roberts: Exploitation and other threats to fish conservation. In: P. J. B. Hart, J. D. Reynolds (Hrsg.): Handbook of Fish Biology and Fisheries. Volume 2: Fisheries. Blackwell Publishing, Oxford 2002, S. 319–341.
- C. W. Clark: Mathematical Bioeconomics: The Optimal Management of Renewable Resources. John Wiley & Sons, New York 1976.
- Stuart L. Pimm, Gareth J. Russell, John L. Gittleman, Thomas M. Brooks: The Future of Biodiversity. In: Science. 269, 1995, S. 347–350. doi:10.1126/science.269.5222.347
- W. V. Reid, H. A. Mooney, A. Cropper, D. Capistrano, S. R. Carpenter, K. Chopra, P. Dasgupta, T. Dietz, A. K. Duraiappah, R. Hassan, R. Kasperson, R. Leemans, R. M. May, A. J. McMichael, P. Pingali, C. Samper, R. Scholes, R. T. Watson, A. H. Zakri, Z. Shidong, N. J. Ash, E. Bennett, P. Kumar, M. J. Lee, C. Raudsepp-Hearne, H. Simons, J. Thonell, M. B. Zurek: Millennium Ecosystem Assessment. Synthesis Report. Island Press, Washington D.C. 2005, ISBN 1-59726-040-1.
- vgl. Richard Gomulkiewicz, Robert D. Holt: When does evolution by natural selection prevent extinction? In: Evolution. 49(1), 1995, S. 201–207.
- Diana O. Fisher, Simon P. Blomberg: Correlates of rediscovery and the detectability of extinction in mammals. In: Proceedings of the Royal Society. Series B, Vol. 278, No. 1708, 2010, S. 1090–1097. doi:10.1098/rspb.2010.1579
- z. B. Barry W. Brook, Navjot S. Sodhi, Peter K. L. Ng: Catastrophic extinctions follow deforestation in Singapore. In: Nature. 424, 2003, S. 420–423.
- Norman Myers: Threatened biotas: hot spots in tropical forests. In: Environmentalist. 8(3), 1988, S. 187–208.
- I. Hanski: Single-species metapopulation dynamics: concepts, models and observations. In: Biological Journal of the Linnean Society. 42, 1991, S. 17–38. doi:10.1111/j.1095-8312.1991.tb00549.x
- Robert H. MacArthur, Edward O. Wilson: The Theory of Island Biogeography. Princeton University Press, Princeton 1967.
- eine Übersicht in Laura R. Prugh, Karen E. Hodges, Anthony R. E. Sinclair, Justin S. Brashares: Effect of habitat area and isolation on fragmented animal populations. In: Proceedings of the National Academy of Sciences USA. vol. 105 no. 52, 2008, S. 20770–20775. doi:10.1073/pnas.0806080105
- David Tilman, Robert M. May, Clarence L. Lehman, Martin A. Nowak: Habitat destruction and the extinction debt. In: Nature. 371, 1994, S. 65–66. doi:10.1038/371065a0
- Ilkka Hanski, Otso Ovaskainen: Extinction Debt at Extinction Threshold. In: Conservation Biology. Band 16, Nr. 3, 2002, S. 666–673. doi:10.1046/j.1523-1739.2002.00342.x
- Fangliang He, Stephen P. Hubbell: Species–area relationships always overestimate extinction rates from habitat loss. In: Nature. Band 473, 2011, S. 368–371. doi:10.1038/nature09985
- Carsten Rahbeck, Robert K. Colwell: Species loss revisited. In: Nature. Band 473, 2011, S. 288–289.
- Dov F. Sax, Steven D. Gaines: Species invasions and extinction: The future of native biodiversity on islands. In: Proceedings of the National Academy of Sciences USA. vol. 105, no. Supplement 1, 2008, S. 11490–11497. doi:10.1073/pnas.0802290105
- Julie A. Savidge: Extinction of an Island Forest Avifauna by an Introduced Snake. In: Ecology. Vol. 68, No. 3, 1987, S. 660–668.
- David W. Steadman: Prehistoric Extinctions of Pacific Island Birds: Biodiversity Meets Zooarchaeology. In: Science. Vol. 267, no. 5201, 1995, S. 1123–1131. doi:10.1126/science.267.5201.1123
- Stuart L. Pimm, Michael P. Moulton, Lenora J. Justice, N. J. Collar, D. M. J. S. Bowman, W. J. Bond: Bird Extinctions in the Central Pacific. In: Philosophical Transactions of the Royal Society London. Series, vol. 344, no. 1307, 1994, S. 27–33. doi:10.1098/rstb.1994.0047.
- R. A. Farrer, L. A. Weinert et al.: Multiple emergences of genetically diverse amphibian-infecting chytrids include a globalized hypervirulent recombinant lineage. In: Proceedings of the National Academy of Sciences. 108, 2011, S. 18732. doi:10.1073/pnas.1111915108.
- Steven M. Stanley: Evidence from ammonoids and conodonts for multiple Early Triassic mass extinctions. In: Proceedings of the National Academy of Sciences USA. vol. 106, no. 36, 2009, S. 15264–15267. doi:10.1073/pnas.0907992106
- David M. Raup: A kill curve for Phanerozoic marine species. In: Paleobiology. 17(1), 1991, S. 37–48.
- Richard J. Twitchett: The palaeoclimatology, palaeoecology and palaeoenvironmental analysis of mass extinction events. (PDF) In: Palaeogeography, Palaeoclimatology, Palaeoecology. 232, Nr. 2–4, März 2006, S. 190–213. doi:10.1016/j.palaeo.2005.05.019.
- David P. G. Bond, Paul B. Wignall: Large igneous provinces and mass extinctions: An update. (PDF) In: The Geological Society of America (GSA) Special Paper. 505, September 2014, S. 29–55. doi:10.1130/2014.2505(02).
- David Jablonski: Background and Mass Extinctions: The Alternation of Macroevolutionary Regimes. In: Science. Vol. 231, No. 4734, 1986, S. 129–133. doi:10.1126/science.231.4734.129
- John Alroy et al. (2008): Phanerozoic Trends in the Global Diversity of Marine Invertebrates. In: Science. 321: 97 doi:10.1126/science.1156963
- John Alroy: Dynamics of origination and extinction in the marine fossil record. In: Proceedings of the National Academy of Sciences USA. vol. 105, suppl. 1, 2008, S. 11536–11542. doi:10.1073/pnas.0802597105
- Reinhard Stindl: Is Telomere Erosion a Mechanism of Species Extinction. In: Molecular and Developmental Evolution, Journal of Experimental Zoology. Part B 302B, 2004, S. 111–120. doi:10.1002/jez.b.20006
- Reinhard Stindl: The telomeric sync model of speciation: species-wide telomere erosion triggers cycles of transposon-mediated genomic rearrangements, which underlie the saltatory appearance of nonadaptive characters. In: Naturwissenschaften. Springer Open Access, 2014. doi:10.1007/s00114-014-1152-8
- William J. Ripple, Christopher Wolf, Thomas M. Newsome, Mauro Galetti, Mohammed Alamgir, Eileen Crist, Mahmoud I. Mahmoud, William F. Laurance und 15.364 Biowissenschaftler aus 184 Ländern: World Scientists’ Warning to Humanity: A Second Notice. In: BioScience. Band 67, Nr. 12, 2017, S. 1026–1028, doi:10.1093/biosci/bix125.
- WWF-Info über das Artensterben
- Joachim Spangenberg, interviewt von Mario Dobovisek: Genetische Vielfalt ist ganz entscheidend für unser Überleben. In: Interview, dradio.de, 29. Dezember 2011.
- Marc Engelhardt: Alarmstufe Rot – UN-Bericht warnt vor dramatischen Verlusten der Artenvielfalt. In: Umwelt und Verbraucher. 11. Mai 2010, abgerufen am 3. Juni 2010.
- David Orenstein: Extinctions during human era worse than thought. Brown University, 2. September 2014, abgerufen am 5. September 2014 (englisch).
- J. M. de Vos, L. N. Joppa, J. L. Gittleman, P. R. Stephens, S. L. Pimm: Estimating the Normal Background Rate of Species Extinction. In: Conservation Biology. 2014. online before print (open access) doi:10.1111/cobi.12380
- Mark C. Urban, Accelerating extinction risk from climate change. In: Science. Band 348, Nr. 6234, 2015, S. 571–573, doi:10.1126/science.aaa4984
- wwf.de: Gewinner und Verlierer 2014
- WWF-Jahresbericht „Größtes Artensterben seit Dinosauriern“. auf: tagesschau.de.
- Living Planet Report 2016. auf: wwf.de, 27. Oktober 2016.
- Tierbestand ist in Deutschland, aber auch weltweit zurückgegangen. In: badische-zeitung.de. Panorama, 28. Oktober 2016, abgerufen am 30. Oktober 2016.
- Der Spiegel Nr. 19, 4. Mai 2019, S. 101.
- UNSW Newsroom: Scientists produce cloned embryos of extinct frog, 15. März 2013.