Dinosaurier
Die Dinosaurier (Dinosauria, von altgriechisch δεινός deinós, deutsch ‚schrecklich, gewaltig‘ und altgriechisch σαῦρος sauros, deutsch ‚Eidechse‘)[1] sind eine Gruppe der Landwirbeltiere, die im Erdmittelalter von der Oberen Trias vor rund 235 Millionen Jahren bis zur Kreide-Paläogen-Grenze vor etwa 66 Millionen Jahren die festländischen Ökosysteme dominierte.
| Dinosaurier | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Skelette verschiedener Nicht-Vogel-Dinosaurier | ||||||||||||
| Zeitliches Auftreten | ||||||||||||
| Obertrias bis Oberkreide (Vögel bis Gegenwart) | ||||||||||||
| 235 bis 66 (bzw. 0) Mio. Jahre | ||||||||||||
| Fundorte | ||||||||||||
| ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Dinosauria | ||||||||||||
| Owen, 1842 | ||||||||||||
| Ordnungen | ||||||||||||
| ||||||||||||
In der klassischen Systematik werden die Dinosaurier als ausgestorbener Zweig der Reptilien betrachtet, obwohl sie sich in der Morphologie von den rezenten, also heute lebenden Reptilien deutlich unterscheiden und mit den meisten rezenten Reptilien, insbesondere Echsen und Schlangen, nicht besonders eng verwandt sind.
Aus kladistischer Sicht, die heute wissenschaftlicher Standard ist, schließen sowohl die Sauropsiden (manchmal alternativ insgesamt als Reptilien bezeichnet[2]) als auch die Dinosaurier die Vögel, die aus kleinen theropoden Dinosauriern hervorgingen, mit ein.[3] Somit sind nicht alle Dinosaurier während des Massenaussterbens am Ende des Erdmittelalters ausgestorben, sondern mit den Vögeln überlebte bis heute eine spezielle Entwicklungslinie der Dinosaurier. Diese Linie erwies sich als außerordentlich anpassungsfähig und erfolgreich: Die Vögel stellen etwa ein Drittel aller rezenten Landwirbeltierarten, sind in allen terrestrischen Ökosystemen vertreten und weisen zudem mit den Pinguinen eine Gruppe auf, die stark an ein Leben an und im Wasser angepasst ist.
In der Zoologie, die sich vorwiegend mit rezenten Tieren beschäftigt, und speziell in der Vogelkunde, werden die Vögel jedoch nach wie vor meist als eigenständige Klasse und nicht als Dinosaurier oder Reptilien betrachtet. Gleiches gilt für den allgemeinen Sprachgebrauch. Auch in der modernen Wirbeltierpaläontologie ist eine informelle Trennung von Vögeln und Dinosauriern im klassischen Sinn üblich. Letztgenannte werden, um der kladistischen Sichtweise gerecht zu werden, auch als Nichtvogeldinosaurier (engl. non-avian dinosaurs) bezeichnet.
Das Wissen über die Dinosaurier erhalten Paläontologen durch die Untersuchung von Fossilien, die in Form von versteinerten Knochen, Haut- und Gewebeabdrücken überliefert sind, und durch Spurenfossilien, also Fußspuren, Eier, Nester, Magensteine oder versteinerten Kot. Überreste von Dinosauriern sind auf allen Kontinenten gefunden worden, einschließlich der Antarktis, da die Dinosaurier zu einer Zeit entstanden, als das gesamte Festland im Superkontinent Pangaea vereinigt war.
In der ersten Hälfte des 20. Jahrhunderts galten Dinosaurier als wechselwarme, träge und wenig intelligente Tiere. Zahlreiche Studien seit den 1970er Jahren haben jedoch gezeigt, dass es sich um aktive Tiere mit erhöhten Stoffwechselraten und soziale Interaktionen ermöglichenden Anpassungen handelte.
Dinosaurier sind zu einem Teil der weltweiten Popkultur geworden und spielen in einigen außergewöhnlich erfolgreichen Büchern und Filmen wie der Jurassic-Park-Reihe eine Rolle.
Beschreibung der Dinosaurier

Der englische Anatom Richard Owen stellte das Taxon „Dinosauria“ im April 1842 auf. Nach der heutigen kladistischen Auffassung schließen die Dinosaurier alle Nachfahren des letzten gemeinsamen Vorfahren von Triceratops und der Vögel ein.[4] Alternativ wurde vorgeschlagen, die Dinosaurier als alle Nachfahren des jüngsten gemeinsamen Vorfahren von Megalosaurus und Iguanodon zu definieren, da dies zwei der drei Gattungen sind, die Owen bei seiner Erstbeschreibung der Dinosaurier nannte.[5] Beide Definitionen fassen dieselben Taxa zur Gruppe der Dinosaurier zusammen: die Theropoda (zweibeinige Karnivoren), Sauropodomorphen (mehrheitlich große Pflanzenfresser mit langen Hälsen und Schwänzen), Ankylosaurier (vierbeinige Pflanzenfresser mit massiven Hautpanzern), Stegosaurier (vierbeinige, Knochenplatten tragende Pflanzenfresser), Ceratopsia (vierbeinige Pflanzenfresser mit Hörnern und Nackenschilden) und Ornithopoden (zwei- oder vierbeinige Pflanzenfresser).[6]
Die bekannten ausgestorbenen Dinosauriergruppen wiesen eine immense Formenvielfalt auf. Einige waren Pflanzenfresser, andere Fleischfresser; einige waren quadruped (vierbeinig), andere biped (zweibeinig), und wieder andere, wie zum Beispiel Iguanodon, konnten sich sowohl biped als auch quadruped fortbewegen. Viele hatten eine Panzerung, Hörner, Knochenplatten, Schilde oder Rückensegel. Obwohl sie für eine gigantische Größe bekannt sind, variierte ihre Größe beträchtlich; so waren viele Dinosaurier nur so groß wie ein Mensch oder kleiner.
Jedoch beschränkte sich diese Formenvielfalt faktisch ausschließlich auf terrestrische Lebensräume. Nur einige wenige Arten zeigen gewisse Anpassungen an ein Leben an und in Süßgewässern.[7] Auch den Luftraum beherrschten die Nichtvogeldinosaurier wahrscheinlich nicht (die Flugsaurier sind eine eigenständige Gruppe). Wie gut der oft als erster Vogel bezeichnete, aber noch recht dinosaurierhafte Archaeopteryx aktiv fliegen (das heißt dynamischen Auftrieb erzeugen) konnte, ist umstritten. Entsprechend muss davon ausgegangen werden, dass seine bislang unbekannten, möglicherweise schon relativ vogelähnlichen unmittelbaren Vorfahren nicht gut oder gar nicht aktiv fliegen konnten. Auch die einer anderen Entwicklungslinie als Archaeopteryx angehörenden „vier-flügeligen Dinosaurier“ der Unterkreide (Microraptor, Changyuraptor) konnten wahrscheinlich nicht aktiv fliegen, sondern sich nur von Baum zu Baum gleitend fortbewegen.
Bis 2006 wurden 527 Gattungen von Nichtvogeldinosauriern von einer geschätzten Gesamtzahl von etwa 1850 Gattungen wissenschaftlich beschrieben.[8] Eine Studie von 1995 schätzt die Gesamtanzahl auf 3400, wovon jedoch viele nicht als Fossilien überliefert seien.[9] Im Mittel kommen gegenwärtig pro Monat zwei neue Gattungen[10] und pro Jahr mindestens 30 neue Arten hinzu.[11]
Gruppenspezifische Merkmale
Gegenüber ihren nächsten Verwandten innerhalb der Archosaurier (Lagosuchus, Scleromochlus und den Flugsauriern) zeichnen sich die Vertreter aller Dinosauriergruppen durch eine Anzahl gemeinsamer abgeleiteter Merkmale (Synapomorphien) aus:[12]
- Schädelmerkmale: Das Postfrontale fehlt; im Gaumen überlappt das Ectopterygoid das Flügelbein (Pterygoid); der Kopf des Quadratums ist in seitlicher Ansicht exponiert; Verkleinerung der Posttemporalöffnung (Fenestra posttemporalis, einer Hinterhauptsöffnung).
- Merkmale des postkranialen Skeletts (das Skelett ohne den Schädel (cranium)): Die Schultergelenkpfanne ist rückwärtig orientiert; die Hand ist asymmetrisch mit verkürzten äußeren Fingern (IV und V), bei höheren Theropoden fehlen diese völlig; das Schienbein zeigt am vorderen oberen Ende eine kammartige Erhebung (Cnemialkamm); der Astragalus (ein Fußwurzelknochen) weist einen aufwärts abgehenden Fortsatz auf; der mittlere Mittelfußknochen (an dem Zehe III ansetzt) ist S-förmig gebogen.
Während urtümliche Dinosaurier alle diese Merkmale aufweisen, kann der Knochenbau späterer Formen stark abweichen, so dass manche der aufgeführten Charakteristika nicht mehr vorhanden oder nachzuvollziehen sind.
Darüber hinaus gibt es verschiedene weitere Merkmale, die viele Dinosaurier gemeinsam haben, aber nicht als gemeinsam abgeleitete Merkmale bezeichnet werden, da sie sich gleichfalls bei einigen Nicht-Dinosauriern finden oder nicht bei allen frühen Dinosauriern auftreten. Dies sind unter anderem das verlängerte Schulterblatt (Scapula), drei oder mehr Kreuzbein-Wirbel im Bereich des Beckengürtels (drei Kreuzbeinwirbel wurden bei einigen anderen Archosauriern gefunden, jedoch nur zwei bei Herrerasaurus)[13] oder eine offene (perforierte) Hüftgelenkpfanne (geschlossen bei Saturnalia).[14]
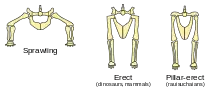
Bei den Dinosauriern standen die Beine senkrecht unter dem Körper, ähnlich wie bei den meisten Säugetieren, aber anders als bei den meisten anderen Reptilien, deren Beine gespreizt nach außen hin abstehen (Spreizgang). Durch ihre aufrechte Haltung konnten Dinosaurier beim Bewegen leichter atmen, was wahrscheinlich Ausdauer- und Aktivitätslevel erlaubte, welche die anderer Reptilien mit gespreizten Beinen übertrafen.[15] Außerdem hat die gerade Stellung der Beine eventuell die Evolution des Gigantismus unterstützt, da so die Beine entlastet wurden.[16]
Fossilbelege

Das Wissen über die Dinosaurier erhalten Paläontologen durch die Untersuchung von Fossilien; dabei spielen Knochenfunde eine herausragende Rolle, durch sie werden wichtige Daten über Verwandtschaftsbeziehungen, Anatomie und Körperbau, Biomechanik und vieles mehr gewonnen.
Weitere Hinweise, besonders über das Verhalten der Dinosaurier, liefern die Spurenfossilien, etwa Zahnabdrücke an Knochen von Beutetieren, Hautabdrücke, Schwanzabdrücke, und vor allem fossile Fußspuren, die mit Abstand häufigsten Spurenfossilien. Spurenfossilien ermöglichen es, Dinosaurier aus einer anderen Perspektive zu studieren, da das Tier lebte, als die Spuren hinterlassen wurden, während Knochen immer von toten Tieren stammen. Weitere Informationen werden aus fossilen Eiern und Nestern, aus Koprolithen (versteinertem Kot) und Gastrolithen (Magensteinen, die zur Zerkleinerung der Nahrung von einigen Dinosauriern verschluckt wurden) gewonnen.
Evolution und Systematik
Ursprung
Viele Wissenschaftler dachten lange, Dinosaurier seien eine polyphyletische Gruppe und bestünden aus miteinander nicht näher verwandten Archosauriern[17][18] – heute werden Dinosaurier als selbstständige Gruppe angesehen.[13][19]

Die ersten Dinosaurier gingen möglicherweise schon während der mittleren Trias vor etwa 245 Millionen Jahren aus ursprünglichen Vertretern der Avemetatarsalier-/Ornithodiren-Linie der Archosaurier hervor, wie der ostafrikanische Nyasasaurus bezeugt, der entweder als der früheste Dinosaurier oder als der nächste bekannte Verwandte der Dinosaurier in Frage kommt.[20] Die Fossilien der ältesten unzweifelhaften Dinosaurier Eoraptor und Herrerasaurus entstammen der etwa 230 Millionen Jahre (späte Trias) alten Ischigualasto-Formation in Argentinien. Eoraptor gilt als der ursprünglichste Vertreter und sah wahrscheinlich dem gemeinsamen Vorfahren aller Dinosaurier sehr ähnlich.[21] Somit dürften die ersten Dinosaurier kleine, bipede Fleischfresser gewesen sein.[22] Diese Sichtweise wird bestätigt durch Funde primitiver, dinosaurierähnlicher Ornithodiren wie Marasuchus und Lagerpeton. Diese Gattungen werden zwar außerhalb der Dinosaurier klassifiziert, waren aber wahrscheinlich mit dem gemeinsamen Vorfahren aller Dinosaurier nahe verwandt.
Als die ersten Dinosaurier erschienen, waren die Nischen der terrestrischen Ökosysteme von verschiedenen Arten urtümlicher Archosaurier und Therapsiden besetzt: Aetosaurier, Cynodonten, Dicynodonten, Ornithosuchiden, Rauisuchier sowie Rhynchosaurier. Die meisten dieser Gruppen starben noch in der Trias aus; so gab es am Übergang zwischen Karnium und Norium ein Massenaussterben, bei dem die Dicynodonten und verschiedene basale Archosauromorphen wie die Prolacertiformen und Rhynchosaurier verschwanden. Darauf folgte ein weiteres Massenaussterben am Übergang zwischen Trias und Jura, bei dem die meisten anderen frühen Archosauriergruppen, wie Aetosaurier, Ornithosuchier, Phytosaurier und Rauisuchier ausstarben. Diese Verluste hinterließen eine Landfauna, die aus Crocodylomorphen, Dinosauriern, Säugetieren, Pterosauriern und Schildkröten bestand.[13]
Die frühen Dinosaurier besetzten wahrscheinlich die Nischen, die durch die ausgestorbenen Gruppen frei wurden. Früher wurde davon ausgegangen, dass die Dinosaurier die älteren Gruppen in einem langen Konkurrenzkampf zurückdrängten – dies wird heute aus mehreren Gründen als unwahrscheinlich angesehen: Die Zahl der Dinosaurier nahm nicht allmählich zu, wie es bei einem Verdrängen anderer Gruppen der Fall gewesen wäre; vielmehr machte ihre Individuenzahl im Karnium lediglich 1–2 % der Fauna aus, während sie nach dem Aussterben einiger älterer Gruppen im Norium bereits 50–90 % ausmachte. Ferner war die senkrechte Stellung der Beine, die lange als Schlüsselanpassung der Dinosaurier galt, ebenso in anderen zeitgenössischen Gruppen ausgeprägt, die nicht so erfolgreich waren (Aetosaurier, Ornithosuchier, Rauisuchier und einige Crocodylomorphen).[13]
Systematik und Phylogenese


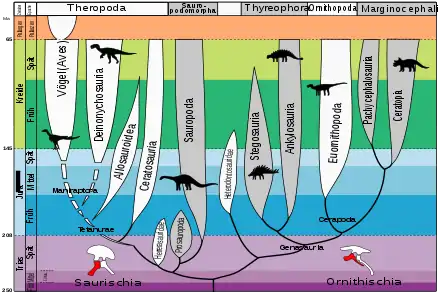
Die Überordnung der Dinosaurier wird, wie die meisten heutigen Reptilien, zu den Diapsiden gezählt. Diese unterscheiden sich von den Synapsiden (aus denen die Säugetiere hervorgingen) und von den Anapsiden (die heutigen Schildkröten) durch zwei paarweise angeordnete Schädelfenster hinter den Augen. Innerhalb der Diapsiden werden sie zu den Archosauriern („Herrscherreptilien“) gezählt, die mit zwei weiteren Schädelfenstern ausgestattet sind. Heutige Überbleibsel dieser Reptiliengruppe sind neben den Krokodilen die Vögel. Die Dinosaurier selber werden traditionell in zwei Ordnungen, Saurischia (auch Echsenbeckendinosaurier) und Ornithischia (auch Vogelbeckendinosaurier), aufgeteilt. Diese unterscheiden sich vorrangig an der Beckenstruktur. Die Saurischia haben die Beckenstruktur ihrer Vorfahren beibehalten und sind durch voneinander abstehende Pubis- und Ischiumknochen zu erkennen. Die Pubis- und Ischiumknochen der Ornithischia jedoch verlaufen beide parallel zueinander schräg nach hinten.
Es folgt eine vereinfachte Klassifikation von Dinosauriern auf Familienebene. Eine detailliertere Aufstellung bis auf die Ebene der Gattungen findet sich im Artikel Systematik der Dinosaurier.
Dinosauria
- Saurischia (Echsenbeckendinosaurier: Theropoden und Sauropoden)
- Herrerasauria (frühe, bipede Fleischfresser)
- Theropoda (bipede Dinosaurier, zum Großteil Fleischfresser)
- Coelophysoidea (Coelophysis und enge Verwandte)
- Ceratosauria (Ceratosaurus und Abelisauriden – letztere waren wichtige Prädatoren der späten Kreide in den südlichen Kontinenten)
- Spinosauroidea (Fleisch- und eventuell Fischfresser; einige hatten einen krokodilähnlichen Schädel und knöcherne Rückensegel)
- Carnosauria (Allosaurus und enge Verwandte, wie zum Beispiel Carcharodontosaurus)
- Coelurosauria (Gruppe verschiedenartiger Theropoden)
- Tyrannosauroidea (klein bis gigantisch, oft mit reduzierten Armen)
- Ornithomimosauria (straußenähnlich, zahnlos, Fleisch- oder Pflanzenfresser)
- Therizinosauria (bipede Pflanzenfresser mit langen Armen und kleinen Köpfen)
- Oviraptorosauria (zahnlos; ihre Ernährung und Lebensgewohnheiten sind ungewiss)
- Alvarezsauridae (kleine, bipede und langbeinige Dinosaurier mit kurzen Armen)
- Dromaeosauridae (wie die klassischen Raptoren, zum Beispiel Velociraptor)
- Troodontidae (ähnlich wie die Dromaeosauriden, aber leichter gebaut, und möglicherweise Allesfresser)
- Aves (die Vögel, die einzigen rezenten Dinosaurier)
- Sauropodomorpha (Gruppe oft sehr langhalsiger Pflanzenfresser)
- Prosauropoda (frühe Verwandte der Sauropoden; klein bis recht groß; einige waren eventuell Allesfresser, biped und quadruped)
- Sauropoda (sehr groß, meistens über 15 Meter lang)
- Diplodocoidea (verlängerte Schädel und Schwänze; Zähne sind nach vorne gerichtet und stiftartig)
- Macronaria (diverse Gruppe teils riesiger Sauropoden)
- Brachiosauridae (sehr lange Hälse; Vorderbeine sind länger als Hinterbeine)
- Titanosauria (divers; besonders häufig in der späten Kreide der südlichen Kontinente)
- Ornithischia (Vogelbeckendinosaurier: diverse Gruppe bipeder oder quadrupeder Pflanzenfresser)
- Heterodontosauridae (kleinere Pflanzen- oder Allesfresser mit großen Eckzähnen)
- Thyreophora (Gepanzerte Dinosaurier, meistens quadruped)
- Ankylosauria (Panzerung aus Knochenplatten, einige hatten eine knöcherne Keule am Schwanzende)
- Stegosauria (quadruped, mit Knochenplatten und Stacheln)
- Ornithopoda (divers, waren gleichzeitig quadruped und biped, entwickelten Fähigkeit zu kauen, große Anzahl von Zähnen)
- Hadrosauridae (die „Entenschnäbel“)
- Pachycephalosauria („Dickkopfsaurier“, mit verdicktem Schädeldach und Kopfornamenten)
- Ceratopsia (quadrupede Dinosaurier mit Hörnern und Nackenschildern, obwohl frühe Formen nur Andeutungen dieser Merkmale hatten)
Evolution, Paläobiogeographie und Paläoökologie
Die Evolution der Dinosaurier nach der Trias wurde durch Veränderungen der Vegetation und der Lage der Kontinente beeinflusst. In der späten Trias und im frühen Jura waren alle Kontinente zu der großen Landmasse Pangaea vereinigt, wodurch es eine weltweit einheitliche Dinosaurierfauna gab, die sich hauptsächlich aus karnivoren Coelophysoideen und herbivoren Prosauropoden zusammensetzte.[23] Nacktsamige Pflanzen, insbesondere Koniferen, verbreiteten sich während der späten Trias als mögliche Futterquelle. Prosauropoden konnten das Pflanzenmaterial nicht im Mund verarbeiten und waren auf andere Mittel zur Aufschlüsselung der Nahrung im Verdauungstrakt angewiesen.[24] Die Homogenität der Dinosaurierfaunen setzte sich bis in den mittleren und späten Jura fort: Unter den karnivoren Theropoden dominierten die Ceratosaurier, die Spinosauroideen und die Carnosaurier, während unter den Herbivoren die Stegosaurier, die Ornithischier und die Sauropoden verbreitet waren. Wichtige, gut bekannte Faunen des späten Jura schließen die der Morrison-Formation in Nordamerika und der Tendaguru Beds in Tansania mit ein. Faunen aus China zeigen jedoch bereits einige Unterschiede wie die spezialisierten Sinraptoriden unter den Karnivoren und ungewöhnliche, langhalsige Sauropoden wie Mamenchisaurus unter den Herbivoren.[23] Ankylosaurier und Ornithopoden verbreiteten sich zunehmend, die Prosauropoden jedoch starben aus. Koniferen und andere Pflanzengruppen wie Farne und Schachtelhalme waren die dominierenden Pflanzen. Anders als Prosauropoden und Sauropoden haben die Ornithischier Mechanismen entwickelt, die eine Verarbeitung von Nahrung im Mund erlaubten. So hielten backenähnliche Organe die Nahrung im Mund, und durch Kieferbewegungen konnte die Nahrung zermahlen werden.[24]
Während der frühen Kreide setzte sich das Auseinanderbrechen Pangaeas fort, wodurch sich die Dinosaurierfaunen verschiedener Kontinente mehr und mehr unterschieden. Die Ankylosaurier, Iguanodonten und Brachiosauriden verbreiteten sich über Europa, Nordamerika und Nordafrika. Später kamen besonders in Afrika Theropoden wie die großen Spinosauriden und Carcharodontosauriden hinzu; außerdem gewannen Sauropodengruppen wie die Rebbachisauriden und die Titanosaurier an Bedeutung. In Asien wurden Maniraptoren wie die Dromaeosauriden, Troodontiden und Oviraptorosaurier häufig, Ankylosaurier und frühe Ceratopsier wie Psittacosaurus wurden wichtige Herbivoren. Währenddessen wurde Australien die Heimat ursprünglicher Ankylosaurier, Hypsilophodonten und Iguanodonten.[23] Die Stegosaurier sind anscheinend in der späten Unterkreide oder der frühen Oberkreide ausgestorben. Eine große Veränderung in der Unterkreide brachte das Auftreten der Blütenpflanzen. Zur selben Zeit entwickelten verschiedene Gruppen von Herbivoren Zahnbatterien, die aus übereinander gestapelten Ersatzzähnen bestanden. Den Ceratopsiern dienten die Zahnbatterien zum Schneiden, während sie besonders bei Hadrosauriden zum Mahlen eingesetzt wurden.[24] Einige Sauropoden haben ebenfalls Zahnbatterien entwickelt, am deutlichsten sind sie bei Nigersaurus ausgeprägt.[25]
In der Oberkreide gab es drei große Dinosaurierfaunen. In Nordamerika und Asien dominierten unter den Karnivoren die Tyrannosaurier und verschiedene Typen kleinerer Maniraptoren, die Herbivoren waren überwiegend Ornithischier und setzten sich aus Hadrosauriden, Ceratopsiern, Ankylosauriern und Pachycephalosauriern zusammen. In den südlichen Kontinenten waren die Abelisauriden die vorherrschenden Predatoren und Titanosaurier die vorherrschenden Herbivoren. Die Fauna Europas schließlich setzte sich aus Dromaeosauriden, Rhabdodontiden (Iguanodontia), Nodosauriden (Ankylosauria) und Titanosauriern zusammen.[23] Blütenpflanzen breiteten sich weiter aus,[24] und die ersten Gräser tauchten am Ende der Kreide auf.[26] Hadrosauriden, welche Nahrung zermahlten, und Ceratopsier, welche Nahrung lediglich abschnitten, erlangten gegen Ende der Kreide in Nordamerika und Asien eine große Häufigkeit und Vielfalt. Einige Theropoden entwickelten sich derweil zu Herbivoren oder Omnivoren (Allesfressern), wie die Therizinosaurier und die Ornithomimosaurier.[24]
Gefiederte Dinosaurier und Ursprung der Vögel
Der erste als Vogel geltende Dinosaurier, Archaeopteryx, lebte im späten Jura Mitteleuropas (siehe Solnhofener Plattenkalk). Er entwickelte sich wahrscheinlich aus frühen Vertretern der Maniraptoren,[27] einer Gruppe sehr vogelähnlicher Theropoden aus der relativ modernen Untergruppe Coelurosauria. Archaeopteryx weist ein Mosaik aus Merkmalen der Vögel und der Nichtvogeltheropoden auf, ähnelt letzteren jedoch so sehr, dass mindestens ein Fossil ohne klar erkennbare Federabdrücke fälschlicherweise dem Compsognathus, einem kleinen Nichtvogeldinosaurier, zugeschrieben wurde. Obwohl das erste fast vollständige Exemplar von Archaeopteryx bereits im Jahr 1861 gefunden wurde, fand die Idee, dass Vögel von Dinosauriern abstammen bzw. ein Teil dieser Gruppe sind, erst wesentlich später allgemeine Anerkennung, nachdem sie 1970 von John Ostrom neu aufgegriffen worden war.[28] Bis heute wurden zahlreiche anatomische Gemeinsamkeiten zwischen theropoden Dinosauriern und Archaeopteryx nachgewiesen.[29] Ähnlichkeiten zeigen sich besonders im Bau der Halswirbelsäule, des Schambeins (Pubis), des Handgelenks, des Schultergürtels, des Gabelbeins und des Brustbeins.
Ab den 1990er Jahren wurde eine Reihe von gefiederten coelurosauriden Theropoden entdeckt, die weitere Anhaltspunkte auf die enge Verwandtschaft zwischen Dinosauriern und Vögeln liefern. Die meisten dieser Funde stammen aus der Jehol-Gruppe im Nordosten Chinas, einer mächtigen Sedimentabfolge, die durch exzellent erhaltene Fossilien berühmt ist. Einige der in der Jehol-Gruppe gefundenen Vertreter mit daunenartigen Federn (Protofedern) sind relativ ursprüngliche und mit den Vögeln nicht sonderlich nahe verwandte Coelurosaurier, zum Beispiel der Compsognathide Sinosauropteryx, der Therizinosauroide Beipiaosaurus sowie die Tyrannosauroiden Dilong[30] und Yutyrannus; letzterer der nach heutigem Kenntnisstand (Stand Juni 2015) mit Abstand größte gefiederte Dinosaurier, der aus der Yixian-Formation (Barremium bis frühes Aptium) der Provinz Liaoning stammt. Dies zeigt, dass ein primitives Gefieder ein ursprüngliches Merkmal der Theropoden, zumindest aber der Coelurosaurier zu sein scheint und dass viele andere Theropoden, von denen heute nur Skelettteile bekannt sind, zu Lebzeiten ebenfalls gefiedert waren, ihr Gefieder jedoch nicht fossil überliefert wurde. Daran ändert auch nichts, dass die Sedimente der Jehol-Gruppe erst in der Unterkreide abgelagert worden sind und damit geologisch jünger als der Solnhofener Plattenkalk und Archaeopteryx sind. Funde „gefiederter Dinosaurier“ sind generell selten, was sehr wahrscheinlich daran liegt, dass Weichteile wie Haut und Federn nur unter besonders günstigen Bedingungen, wie sie in den Sedimenten der Jehol-Gruppe und im Solnhofener Plattenkalk offenbar herrschten, fossilieren. Viele der gefiederten Nichtvogeldinosaurier in der Jehol-Gruppe wären demnach die ältesten mit Gefieder überlieferten Vertreter ihrer Entwicklungslinien, obwohl alle geologisch älteren Vertreter dieser Linien sowie deren gemeinsamer Vorfahr ebenfalls Federn hatten.
Die für Vögel so typischen Konturfedern finden sich jedoch nur bei Vertretern der Coelurosaurier-Untergruppe Maniraptora, welche die Oviraptorosaurier, die Troodontiden, die Dromaeosauriden und die Vögel umfasst.[27][31] Protofedern entwickelten sich ursprünglich wahrscheinlich zur Wärmeisolierung, die Konturfedern speziell für die optische Kommunikation mit Artgenossen. Die Funktion des Erzeugens von Auftrieb beim Fliegen oder Segeln durch die Luft übernahmen sie erst später in der Evolution.[32][33] Bei Microraptor gui, einem etwa huhngroßen Dinosaurier aus der Jehol-Gruppe, sind nicht nur die Arme und Hände, sondern auch die Beine als mit Konturfedern bestückte Flügel ausgebildet, und es wird angenommen, dass Microraptor auf diesen vier Schwingen von Baum zu Baum gesegelt ist.[34] Allerdings gilt Microraptor, obwohl geologisch jünger als Archaeopteryx, nicht als Vogel. Sein vogelähnliches Äußeres geht stattdessen auf eine Parallelentwicklung (Konvergenz) innerhalb der Maniraptora zurück. Mit Jeholornis gab es aber auch einen frühen „echten“ Vogel in der Jehol-Gruppe. Dass Microraptor nicht als Vogel betrachtet wird, liegt nicht daran, dass er lediglich zur Fortbewegung per Gleitflug fähig war, sondern an seiner Skelettanatomie, die ihn als Dromaeosauriden ausweist. Schließlich sind auch die fliegerischen Fähigkeiten von Archaeopteryx durchaus umstritten. Eine Hypothese zur Entwicklung der Flugfähigkeit der „echten“ Vögel besagt, dass diese sich aus dem Gleitflug entwickelt hat. Die Vorfahren von Archaeopteryx, möglicherweise sogar Archaeopteryx selbst, wären demnach ebenfalls Gleitflieger gewesen.
Paläobiologie
Größe
Obwohl Dinosaurier in der Größe erheblich variierten, waren sie als Gruppe groß. Nach einer Schätzung wog der durchschnittliche Dinosaurier ein bis zehn Tonnen,[35] das durchschnittliche Säugetier des Känozoikums nur zwei bis fünf Kilogramm.[36] Einige Dinosaurier waren gigantisch, insbesondere die langhalsigen Sauropoden, zu denen die größten Landtiere der Erdgeschichte gehörten.
Laut der Cope’schen Regel besteht im Laufe der Evolution einer Tiergruppe infolge von zwischen- und innerartlicher Konkurrenz eine generelle Tendenz zur Zunahme der Körpergröße ihrer Vertreter. Dies allein erklärt jedoch nicht den in der Erd- und Evolutionsgeschichte beispiellosen Gigantismus der Dinosaurier. Diesbezüglich stellt sich sowohl die Frage, warum die Tiere so groß wurden, als auch, wie diese Größe erreicht werden konnte. Hinsichtlich des Warum wird für die Sauropoden angenommen, dass ihr Riesenwachstum Vorteile für die Verdauung brachte. Da Sauropoden ihre eher schwer verdauliche pflanzliche Nahrung nicht kauten, ermöglichte ein längeres Verweilen in einem ausladenden Verdauungstrakt eine intensivere Nutzung (einen besseren Aufschluss) der Nahrung als bei kleineren Pflanzenfressern. Dies hätte eine Spezialisierung auf sehr nährstoffarme Pflanzenkost erlaubt.[37] Hinsichtlich des Wie haben ein vogelähnliches Luftsacksystem einschließlich luftgefüllter Knochen (Pneumatisierung, bei den großen Theropoden besonders im Schädel) den Gigantismus der Dinosaurier ermöglicht. Die Sauropoden hätten zudem durch die Nahrungsaufnahme ohne Kauen Kiefermuskulatur eingespart, was einen verhältnismäßig kleinen leichten Kopf zuließ, wodurch wiederum die Hälse so lang werden konnten, wobei die Halslänge als Merkmal unter anderem möglicherweise einer sexuellen Selektion unterworfen war, d. h., Männchen mit den längsten Hälsen hätten den höchsten Paarungserfolg gehabt (eine Form von innerartlicher Konkurrenz).[38] Des Weiteren sei bei den Sauropoden eine Gewichtszunahme von bis zu 30 Tonnen in 20 Jahren nur realisierbar, wenn die Stoffwechselraten bei Jungtieren sehr hoch (vogel- oder säugerähnlich) gewesen seien, mit zunehmender Körpergröße aber immer weiter abgenommen hätten, um eine Überhitzung zu vermeiden (vgl. Oberflächenregel; siehe auch Dinosaurier-Physiologie).[38]
Welche die größten oder kleinsten Dinosaurier waren, wird wahrscheinlich nie mit Sicherheit gesagt werden können. Die Überlieferung durch Fossilien ist oft sehr unvollständig, nur die wenigsten Dinosaurier sind durch vollständige Skelette bekannt – von vermutlich besonders großen Arten werden meist lediglich Knochenfragmente gefunden. Paläontologen können zwar die Form und Größe der Knochen mit denen besser bekannter Arten vergleichen, um die Größe zu schätzen – dies ist allerdings ungenau. Noch schlechter lässt sich das Gewicht der Tiere schätzen, da es unter anderem davon abhängt, wie ein Modell mit Muskeln und Sehnen versehen wird, deren Lage Paläontologen anhand von Muskelansatzstellen an den Knochen herausfinden müssen.[39]

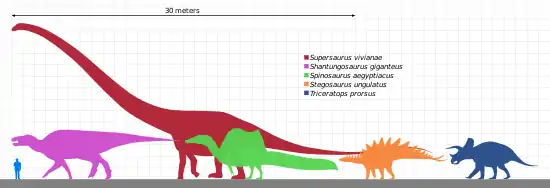
Der größte und schwerste Dinosaurier, der durch gute Skelettfunde bekannt ist, ist der Sauropode Brachiosaurus (auch bekannt als Giraffatitan). Ein Skelett, das aus den Knochen verschiedener etwa gleich großer Individuen besteht,[40] ist im Berliner Naturkundemuseum ausgestellt und hat eine Höhe von über 13 Metern und eine Länge von mehr als 23 Metern; ein solches Tier hätte wahrscheinlich ein Gewicht von 30 bis 60 Tonnen gehabt. Der längste durch vollständige Skelette bekannte Dinosaurier ist Diplodocus, ein Skelettfund zeigt eine Länge von 27 Metern. Noch größere Sauropoden sind nur durch Skelettfragmente bekannt. Einer der größten Dinosaurier könnte Argentinosaurus gewesen sein, der manchmal auf ein Gewicht von bis zu hundert Tonnen geschätzt wird; der 33,5 Meter lange Diplodocus hallorum[37] (früher Seismosaurus) könnte zusammen mit dem 33 Meter langen Supersaurus[41] vielleicht zu den längsten Dinosauriern gehört haben.
Unter den fleischfressenden Dinosauriern gab es ebenfalls Riesen. Der größte durch fast vollständige Skelettfunde bekannte Theropode ist der etwa 12 Meter lange Tyrannosaurus rex, jedoch gibt es hier ebenso Skelettfragmente, die auf noch größere Gattungen schließen lassen. Der größte bekannte Theropode war vielleicht Spinosaurus mit einer Länge von 16 bis 18 Metern und einem Gewicht von acht Tonnen,[42] weitere sehr große Theropoden schließen Giganotosaurus, Mapusaurus und Carcharodontosaurus mit ein.
Die kleinsten Dinosaurier hatten die Größe eines Huhns, so waren die Theropoden Microraptor und Parvicursor beide weniger als 60 Zentimeter lang. Die kleineren Dinosaurier ernährten sich fast ausschließlich karnivor.
Verhalten
Aussagen über das Verhalten der Dinosaurier basieren auf der Haltung von Skelettfunden, auf Spurenfossilien wie fossilen Fußspuren, auf dem Habitat, in welchem die Tiere lebten, auf Computersimulationen der Biomechanik und auf Vergleichen mit rezenten Tieren ähnlicher ökologischer Nischen. Viele Hypothesen über das Verhalten der Dinosaurier werden in der Fachliteratur kontrovers diskutiert. Es gibt aber auch eine mit der Zeit größer werdende Reihe von Annahmen zum Verhalten, denen die meisten Forscher zustimmen.
Der Fund eines Iguanodon-Massengrabs in Bernissart (Belgien) im Jahr 1878 gab einen ersten Hinweis auf Herdenleben bei Dinosauriern.[43] Heute sind viele weitere Hinweise auf ein Herdenleben bei vielen Dinosaurierarten bekannt, so wurden neben weiteren Massengräbern auch viele parallel verlaufende Fährtenfolgen entdeckt. Hadrosauriden wanderten vermutlich in großen Herden, ähnlich wie die heutigen Springböcke oder Amerikanischen Bisons; so enthält ein Massengrab von Maiasaura aus Montana (USA) die Überreste von mindestens 10.000 Individuen.[44] Sauropodenspuren aus Oxford (England) zeigen, dass diese Sauropoden in gemischten Herden mit unterschiedlichen Arten wanderten.[45] Vielleicht bildeten Dinosaurier Herden zur Verteidigung gegen Fressfeinde, zum Schutz der Jungtiere oder für periodische Wanderungen. Einige karnivore Dinosaurier werden ebenso oft gesellig dargestellt, wobei sie in einer Gruppe selbst größere Beute erlegt haben könnten.[46][47] Jedenfalls ist das Jagen in Gruppen bei den nächsten lebenden Verwandten der Dinosaurier, den Vögeln und den Krokodilen, recht ungewöhnlich, und vermeintliche Nachweise für ein Jagen in Gruppen bei den Theropoden Deinonychus und Allosaurus könnten die Ergebnisse von tödlichen Auseinandersetzungen zwischen fressenden Tieren sein, wie bei modernen Reptilien häufig zu beobachten.[48]

Eine Maiasaura-Nestkolonie, die Jack Horner im Jahr 1978 in Montana (USA) entdeckt hat, zeigt, dass einige Dinosaurier ihre Jungen noch lange nach dem Schlüpfen betreuten und beschützten.[49] In der Mongolei wurde 1993 das Skelett des Oviraptoriden Citipati in einer brütenden Position über seinen Eiern entdeckt; dies könnte auf isolierende Federn hinweisen, welche die Eier warm hielten.[50] Andere Funde zeigen ebenfalls elterliche Fürsorge. So wurde zum Beispiel in Liaoning (China) ein erwachsenes Exemplar des Ceratopsier Psittacosaurus zusammen mit 34 Jungtieren gefunden – die große Anzahl des Nachwuchses könnte darauf hindeuten, dass das erwachsene Tier den Nachwuchs von verschiedenen Individuen betreut hat, ähnlich wie bei heutigen Straußen.[51] Die Auca-Mahuevo-Fundstelle in Patagonien barg tausende Nester mit Eiern, die Sauropoden zugeschrieben werden und Hinweise auf große Nistkolonien dieser Dinosaurier geben, ähnlich denen der heutigen Pinguine. Sauropoden betrieben allerdings wahrscheinlich keine elterliche Fürsorge, was nicht zuletzt wegen der Größe der Elterntiere im Vergleich zu den Jungtieren angenommen wird.[52]
Die mannigfaltigen Kämme und Schilde einiger Dinosaurier, wie die der Marginocephalia, der Theropoden und der Lambeosaurinen, waren zur aktiven Verteidigung vielleicht zu zerbrechlich. Wahrscheinlicher ist, dass sie zur sexuellen Zurschaustellung dienten oder Artgenossen einschüchtern sollten – jedoch ist nur wenig über die Paarung und das Territorialverhalten der Dinosaurier bekannt. Bisswunden an den Schädeln von einigen Theropoden lassen aktive aggressive Konfrontationen zumindest bei diesen Dinosauriern vermuten.[53] Die Kommunikation der Dinosaurier untereinander bleibt ebenfalls mysteriös, ist aber ein aktives Gebiet der Forschung. Beispielsweise haben jüngere Studien gezeigt, dass die Kopfkämme der Lambeosaurinen als Resonanzverstärker für ein breites Spektrum von Rufen gedient haben könnten.[54][55]
Ein Fossil eines Troodontiden aus China zeigte, dass dieser kleine Theropode den Kopf beim Schlafen unter die Arme steckte, um ihn warm zu halten; ähnlich wie heutige Vögel.[56] Eines der für die Verhaltensforschung wertvollsten Dinosaurier-Fossilien wurde im Jahr 1971 in der Wüste Gobi entdeckt und beinhaltet einen Velociraptor, der einen Protoceratops attackiert hat; der Fund zeigt die Tiere annähernd in Lebenddarstellung.[57] Weitere Hinweise auf das Jagen lebender Beute liefert eine teilweise verheilte Schwanzverletzung eines zu den Hadrosauriern zählenden Edmontosaurus – der Schwanz wurde von einem Tyrannosaurier gebissen, das Tier überlebte aber.[58] Kannibalismus konnte bei einigen Theropoden wie Majungasaurus nachgewiesen werden; so wurden im Jahr 2003 in Madagaskar entsprechende Bissspuren gefunden.[59]
Neue Funde wie Oryctodromeus zeigen, dass einige herbivore Arten anscheinend in einem Bau unter der Erde lebten,[60] während einige vogelähnliche Arten vielleicht baumbewohnend waren, wie Microraptor[34] und die rätselhaften Scansoriopterygiden.[61] Die meisten Dinosaurier bewegten sich jedoch auf dem Boden fort. Ein gutes Verständnis der Art der Fortbewegung ist ein Schlüssel für die Verhaltensforschung, und die Biomechanik hat bedeutende Fortschritte auf diesem Gebiet gebracht. So gab es Studien über die von Muskeln ausgeübten Kräfte und über das auf dem Skelett lastende Gewicht, wodurch geschätzt wurde, wie schnell Dinosaurier rennen konnten.[62] Weiter wurde untersucht, ob Diplodociden mit ihrem Schwanz einen Überschallknall erzeugen konnten[63] oder ob Sauropoden schwimmen konnten.[64] Für Theropoden wurde anhand von Kratzspuren im Sediment eines Sees nachgewiesen, dass sie schwimmen konnten.[65]
Physiologie
Seit den 1960er Jahren läuft eine energische Diskussion über die Temperatur-Regulierung der Dinosaurier. Obwohl die Theorie, dass Dinosaurier ihre Körpertemperatur überhaupt regulieren konnten, ursprünglich von Wissenschaftlern abgelehnt wurde, ist die Warmblütigkeit (Endothermie) der Dinosaurier die heute gängige Sichtweise, und die Debatte hat sich mehr auf die Mechanismen der Thermoregulation fokussiert.
Als die ersten Dinosaurier entdeckt wurden, glaubten die Wissenschaftler, Dinosaurier seien wechselwarme (ektotherme) Tiere – „schreckliche Echsen“, wie ihr Name nahelegt. Man stellte sich Dinosaurier als langsame, träge Tiere vor und verglich sie mit Reptilien, die sich erst durch die Sonne aufwärmen müssen, um sich aktiv bewegen zu können. Die Vorstellung von wechselwarmen Dinosauriern herrschte vor, bis Robert „Bob“ Bakker, ein früher Verfechter der Warmblütigkeit der Dinosaurier, eine einflussreiche Arbeit zum Thema veröffentlichte.
Hinweise auf Warmblütigkeit liefern Entdeckungen aus Antarktika und Australien, wo „Polar-Dinosaurier“[66] gefunden wurden, die dort einen kalten, sechsmonatigen Winter überstehen mussten. Erst kürzlich wurden Funde aus der Kreidezeit in Nordalaska gemacht, die zeigen, dass in diesen schon damals kalten Gebieten sogar dieselben Arten wie im übrigen Nordamerika lebten. Zusätzlich lässt der Skelettbau vieler Dinosaurier – insbesondere der Theropoden – auf eine hohe Aktivität schließen, die ebenfalls für eine hohe Stoffwechselrate spricht. Ebenso konnten die für warmblütige Tiere typischen Blutgefäß-Strukturen in Dinosaurierknochen nachgewiesen werden. Eine nicht unbedeutende Anzahl von kleineren Dinosauriern verfügte außerdem über ein isolierendes Federkleid. Es ist möglich, dass einige Dinosaurier warmblütig waren, andere aber nicht.[67]
Die Debatte wird dadurch verkompliziert, dass Warmblütigkeit auf mehr als nur einen Mechanismus beruhen kann. In den meisten Diskussionen wird die Dinosaurier-Warmblütigkeit mit der von durchschnittlich großen Vögeln oder Säugetieren verglichen, welche Energie aufwenden, um ihre Körpertemperatur über der Umgebungstemperatur zu halten. Kleine Säugetiere und Vögel besitzen außerdem eine Isolierung in Form von Fett, Fell oder Federn, die den Wärmeverlust verringert. Jedenfalls haben große Tiere wie Elefanten ein ganz anderes Problem – wird ein Tier größer, vergrößert sich das Volumen viel schneller als die Hautfläche (Haldanes Prinzip). Ab einem gewissen Punkt übersteigt die vom Körper produzierte Wärme den Wärmeverlust über die Haut, sodass den Tieren Überhitzung droht. Besonders in Bezug auf Sauropoden wird daher die Theorie diskutiert, dass große Dinosaurier durch ihre schiere Größe wärmer als die Umgebung waren (gigantotherm), ohne dass sie spezielle Anpassungen wie Säugetiere oder Vögel besessen hätten. 2011 hatten Forscher in Science berichtet, dass die Körpertemperatur für einige große pflanzenfressende Dinosaurier auf 36 bis 38 Grad bestimmt wurde.[68] Anfang 2020 wurde eine Publikation veröffentlicht, in der anhand der Isotopenverteilung in fossilen Eierschalen die Temperatur ermittelt wurde, unter der diese Schalen im Körper von Dinosaurierweibchen gebildet wurden. Die Temperatur der natürlichen Umgebung wurde anhand der Isotopenverteilung in Schalen wirbelloser Tiere ermittelt, und man kam zum Ergebnis, dass die Körpertemperatur der Dinosaurierweibchen 10 bis 15 °C höher war als die Umgebungstemperatur.[69]
Theropoden und wahrscheinlich ebenso Sauropoden besaßen Luftsäcke, die wie Blasebälge Luft durch die Lunge führten. Da dieses Merkmal unter heute lebenden Tieren nur bei den Vögeln bekannt ist, gilt es als weiterer Hinweis auf eine Abstammung der Vögel von den Dinosauriern. Außerdem wird es als Hinweis gedeutet, dass ebenso größere Dinosaurier wie die Sauropoden warmblütig gewesen sein könnten, da Verdunstung in den Luftsäcken einen effektiven Kühlmechanismus darstellt.[70][71]

Computertomografische Untersuchungen von Hohlräumen in der Brustgegend des Ornithopoden Thescelosaurus zeigten im Jahr 2000 die Überreste eines komplexen, vierkammerigen Herzes.[72] In Fachkreisen besteht zwar Uneinigkeit über die Richtigkeit der Ergebnisse,[73][74] das Vorkommen eines vierkammerigen Herzens sowohl bei Vögeln als auch bei Krokodilen könnte jedoch darauf hindeuten, dass Dinosaurier ebenfalls ein solches besessen haben.[75]
Histologische Untersuchungen an Dinosaurierknochen lieferten Hinweise auf enge physiologische Parallelen zwischen weiblichen Dinosauriern und Vögeln bei der Eierschalenproduktion. Bei weiblichen Vögeln wächst infolge der Ausschüttung von Östrogen im Zeitraum vor der Eiablage eine sehr calciumreiche Knochensubstanz in den Beinknochen, an der Innenseite der harten Außenknochen (corticaler Knochen) in die Markhöhle hinein. Diese Knochensubstanz wird als medullärer Knochen bezeichnet[76] und ist reich an Proteoglykanen und Glykoproteinen, an die die Calcium-Ionen gebunden werden,[77] sowie arm an Kollagen. Medullärer Knochen dient als Reservoir, in dem Calcium gespeichert wird, das für die Bildung der Eierschalen nötig ist. Knochensubstanz, die als medullärer Knochen gedeutet wird, fand sich auch in den Beinknochen eines Tyrannosaurus rex. Dies lässt vermuten, dass die Calciumeinlagerung bei Dinosauriern und Vögeln ähnlich funktionierte. Zudem kann das Vorhandensein von medullärem Knochen bei fossilen Vögeln oder bei Dinosauriern für die Bestimmung weiblicher Tiere genutzt werden.[78][79] Nach weiteren Forschungen wurde medullärer Knochen auch bei Allosaurus und dem Vogelbeckensaurier Tenontosaurus entdeckt. Da diese beiden Gattungen jeweils einer der beiden Hauptlinien der Dinosaurier angehören, wird davon ausgegangen, dass medullärer Knochen zur Calciumspeicherung bereits sehr früh in der Dinosaurierevolution entstanden ist und dass deshalb nahezu alle Dinosaurier dieses Merkmal besessen haben dürften. Dass diese Knochensubstanz auch bei noch nicht voll ausgewachsenen Tieren gefunden wurde, lässt den Schluss zu, dass Dinosaurier relativ früh in ihrer Individualentwicklung die Geschlechtsreife erreichten.[80]
Weiches Gewebe und DNA

Eines der besten Beispiele für Abdrücke von weichem Gewebe in einem Dinosaurierfossil wurde in Petraroia, Italien entdeckt. Der im Jahr 1998 beschriebene Fund stammt von dem kleinen, sehr jungen Coelurosaurier Scipionyx und zeigt Abdrücke verschiedener Darmabschnitte, der Leber, der Muskeln und der Luftröhre.[81]
Im Jahr 2005 stellten Mary Higby Schweitzer und ihr Team erstmals flexibles Gewebematerial eines Dinosauriers vor, das in einem 68 Millionen Jahre alten Beinknochen eines Tyrannosaurus rex aus der Hell-Creek-Formation in Montana (USA) gefunden wurde. Nach einer Rehydrierung wurde das Material wieder elastisch, und nach einer mehrere Wochen währenden Behandlung zum Entfernen der Mineralien (Demineralisierung) konnten intakte Strukturen wie Blutgefäße, Knochenmatrix und Knochenfasern nachgewiesen werden. Genauere Untersuchungen unter dem Mikroskop zeigten darüber hinaus, dass sogar noch Mikrostrukturen auf zellulärer Ebene erhalten geblieben sind.[82] Thomas Kaye et al. stellen die Ergebnisse in einer kürzlich veröffentlichten Studie jedoch in Frage – nach diesen Forschern handelt es sich bei dem vermeintlichen Gewebematerial um bakterielle Biofilme. Die Bakterien kolonisierten einst die Hohlräume des Knochens, die zuvor von echten Zellen besetzt waren. Die von Schweitzer aufgrund ihrer Eisenhaltigkeit als Blutgefäße interpretierten Strukturen deuten die Forscher zudem als Framboide – rundliche, mikroskopisch kleine Mineralstrukturen.[83]
Die erfolgreiche Gewinnung von Dinosaurier-DNA wurde zwar in zwei Fällen gemeldet, keine dieser beiden Studien konnte jedoch bestätigt werden.[84] Jedenfalls wurde bereits das theoretische Peptid Rhodopsin eines Dinosauriers kloniert, wobei die Gene von Krokodilen und Vögeln, den nächsten heute lebenden Verwandten der Dinosaurier, als Grundlage für die phylogenetische Ableitung dieses Peptids dienten. Das in Zellkultur exprimierte und aufgereinigte Rhodopsin zeigte sich aktiv in funktionellen Tests.[85] Des Weiteren wurden verschiedene Proteine in Dinosaurierfossilien entdeckt,[86] inklusive des roten Blutfarbstoffs Hämoglobin.[87] Die Möglichkeit des Klonens von Dinosauriern, wie in Michael Crichtons berühmtem Roman DinoPark (1993 verfilmt als Jurassic Park), kann aufgrund mangelnder genetischer Information für die nähere Zukunft ausgeschlossen werden.
Lebenserwartung und Wachstumsraten
Im Zuge der mehr als einhundertjährigen Erforschung fossiler Überreste von Dinosauriern sind viele Informationen über Neurologie, mögliches Verhalten und Physiologie dieser urzeitlichen Lebewesen gewonnen worden. Empirische Daten zur Individualentwicklung (beispielsweise zum Erreichen der Geschlechtsreife und zu Wachstumsraten) und zur allgemeinen Lebenserwartung fehlten jedoch zu Beginn des 21. Jahrhunderts noch weitgehend.[88] Um das Alter einzelner Individuen und darüber die mittlere Lebenserwartung der entsprechenden Spezies abzuschätzen, kamen und kommen histologischen Untersuchungen und insbesondere der Lebensaltersbestimmung anhand von Wachstumslamellen (Skeletochronologie) eine besondere Bedeutung zu.[89]
Bei den nächsten lebenden Verwandten der Dinosaurier, Vögeln und Krokodilen, korreliert die Lebenserwartung bei einer bestimmten Spezies mit der maximal erreichbaren Körpergröße ihrer Individuen (je größer, desto älter) und die Vertreter einiger der größten Arten können erfahrungsgemäß sehr alt werden (in Gefangenschaft teils mehr als 100 Jahre). Daraus könnte man ähnliche Lebensspannen und eine ähnliche Größenkorrelation für Dinosaurier ableiten. Allerdings stimmen die Ergebnisse histologischer Untersuchungen nicht mit solch rein phylogeniebasierten Rückschlüssen überein; die Daten rezenter Archosaurier lassen sich also nicht ohne Weiteres auf Dinosaurier hochrechnen.[90] Nichtsdestoweniger sind die Erkenntnisse aus histologischen Untersuchungen rezenter Archosaurier wichtig für die korrekte Interpretation der Beobachtungen an histologischen Schnitten fossiler Dinosaurierknochen (Aktualismusprinzip).[89]

Dass viele Dinosaurierarten eine enorme Größe erreichten, weiß man bereits seit dem 19. Jahrhundert. Wie schnell sie wuchsen, mit welchem Alter sie ausgewachsen waren oder ob sie bis zu ihrem Tode kontinuierlich weiterwuchsen, war jedoch lange Zeit unbekannt.[88] Skeletochronologische Untersuchungen an Dinosaurierknochen, das heißt das Zählen von Wachstumslamellen (engl.: lines of arrested growth, wörtlich: ‚Linien gestoppten/gebremsten Wachstums‘), die im Idealfall wie die Jahresringe eines Baumstamms das Lebensalter des Tieres anzeigen, konnten diese Wissenslücke mittlerweile ansatzweise füllen. So ist für den spätkreidezeitlichen riesenwüchsigen Theropoden Tyrannosaurus ermittelt worden, dass er in der „Pubertät“, im zweiten Lebensdrittel (zwischen 14 und 18 Jahren), besonders schnell wuchs, mit einer täglichen Gewichtszunahme um mindestens zwei Kilogramm, und dass sich im Alter von etwa 20 Jahren und bei einem Gewicht von 5 Tonnen das Wachstum drastisch verlangsamte, er faktisch ausgewachsen war. Sein Höchstalter soll 28 Jahre betragen haben, wäre also, angesichts seiner Größe, überraschend gering gewesen. Für kleinere, geologisch ältere Vertreter der Tyrannosauriden wurden noch geringere Höchstalter berechnet.[88] Die Lebenserwartung des großwüchsigen triassischen „Prosauropoden“ Plateosaurus wird auf mindestens 27 Jahre geschätzt.[89]
Ob bei einem bestimmten Dinosauriertaxon die starke Verlangsamung des Körperwachstums (das Erreichen der sogenannten asymptotischen Größe oder somatischen Reife) auch mit dem Erreichen der Geschlechtsreife übereinstimmte, kann durch das Zählen von Wachstumsringen allein nicht festgestellt werden. Die Entdeckung von medullärem Knochen (einem kalziumreichen Knochengewebe in der Markhöhle der Beinknochen weiblicher Vögel) bei verschiedenen Dinosaurierarten ermöglicht allerdings nunmehr relativ eindeutig die Bestimmung des Alters der Geschlechtsreife, zumindest bei weiblichen Individuen. Medullärer Knochen dient als Kalziumspeicher für die Sekretion kalkiger Eierschalen und sollte folglich nur bei geschlechtsreifen Tieren zu finden sein. So ist in Kombination mit der Skeletochronologie für Tenontosaurus (ein Vogelbeckensaurier), Allosaurus und Tyrannosaurus (beides Echsenbeckensaurier) das Erreichen der Geschlechtsreife im Alter von 8, 10 bzw. 18 Jahren ermittelt worden. Dies legt nahe, dass Dinosaurier wahrscheinlich einige Jahre vor Erreichen der asymptotischen Größe geschlechtsreif wurden. Dass dieses Muster auch bei mittelgroßen bis großen Säugetieren auftritt und vor allem dass Dinosaurier die Geschlechtsreife und asymptotische Größe bedeutend früher erreichten, als es rezente Reptilien täten, wenn diese ähnlich großwüchsig wären, lässt den Schluss zu, dass Dinosaurier warmblütigen Amnioten wie Säugetieren physiologisch-metabolisch wahrscheinlich ähnlicher waren als rezenten Reptilien.[80]
Aussterben

In den letzten 550 Millionen Jahren gab es fünf große Massenaussterben, bei denen jeweils mindestens 40 % aller Gattungen ausstarben. Am berühmtesten ist das Kreide-Paläogen-Massenaussterben vor etwa 66 Millionen Jahren, bei dem schätzungsweise 50 % der Gattungen und 20 % der Familien verschwanden, darunter alle Nicht-Vogel-Dinosaurier. Es wurden die verschiedensten Hypothesen aufgestellt, um die Ursachen dieses Massensterbens zu klären. Die meisten aktuellen Theorien sehen die Ursache in einem Meteoriteneinschlag oder einem gesteigerten Vulkanismus, einige schließen beide Ereignisse mit ein. Das rapide Absinken des Meeresspiegels könnte gleichfalls zum Massensterben beigetragen haben, da die großen Flachmeere verschwanden und sich Landbrücken bildeten.[91]
In einer dünnen, dunklen Tonschicht aus der Zeit des Massenaussterbens an der Kreide-Paläogen-Grenze fanden der Physiker Luis Walter Alvarez und sein Sohn, der Geologe Walter Alvarez, eine Anreicherung des sonst in der Erdkruste sehr seltenen Schwermetalls Iridium (siehe Iridium-Anomalie). In ihrer im Juni 1980 veröffentlichten Studie postulierten sie, dass dieses Iridium durch einen Meteoriten auf die Erde gelangt sein könnte, dessen Einschlag das Massensterben auslöste.[92] Die Hypothese wurde 1991 durch den Fund des 180 km durchmessenden Chicxulub-Kraters am Rande der Yukatan-Halbinsel im Golf von Mexiko untermauert, der zum passenden Zeitpunkt durch den Einschlag eines etwa 10 km großen Meteoriten entstanden ist. Zu den möglichen kurz- und mittelfristigen Folgen für die damaligen Ökosysteme sind vielfältige Überlegungen angestellt worden. So wird eine zunächst starke Aufheizung der Atmosphäre als unmittelbare Folge des Einschlags angenommen („Feuersturm“), gefolgt von einer inzwischen nachgewiesenen starken Abkühlung, weil die Atmosphäre durch Staub verdunkelt und so die Sonneneinstrahlung (Insolation) für einige Jahre um 10 bis 20 % reduziert wurde („nuklearer Winter“)[93], mit negativen Auswirkungen auf die Photosyntheseraten von Landpflanzen und einzelligen Meeresalgen, den Primärproduzenten der terrestrischen und marinen Ökosysteme.[94] Eine weitere unmittelbare und mittelbare Folge des Einschlages waren wahrscheinlich schwere und schwerste Erdbeben und Tsunamis, die noch tausende Kilometer vom Einschlagsort entfernt auftraten.[95]
Mehrere Hypothesen zu den Ursachen des Aussterbens stehen speziell mit dem Umstand in Zusammenhang, dass der Einschlag seinerzeit in eine karbonatische Schelfplattform erfolgte. Deren Sedimentabfolge beherbergt heute in unmittelbarer Nähe des Chicxulub-Kraters eine ergiebige Erdöllagerstätte, die wahrscheinlich auch schon am Ende der Kreidezeit existierte. Daher wurde, gestützt auf Isotopenuntersuchungen von organischem Kohlenstoff aus Sedimenten des Kreide-Paläogen-Grenzbereichs, eine These formuliert, die besagt, dass durch den Einschlag große Mengen von Erdöl verbrannt seien. Der dabei entstandene Ruß sei in die Stratosphäre aufgestiegen und habe sich dort weltweit verbreitet. Dies, und nicht der aus dem Einschlagskrater ausgeschleuderte feine Gesteinsstaub, sei Hauptursache für die nach dem Impakt erfolgte weltweite Verdunkelung und Abkühlung gewesen.[96] Weil der mächtige Sedimentstapel der Yucatan-Karbonatplattform unter anderem auch Anhydrit und Gips (Kalziumsulfat, CaSO4) enthält, könnten durch die Einschlagshitze große Mengen Schwefeldioxid (SO2) und -trioxid (SO3) entstanden sein, was in den folgenden Wochen und Monaten weltweit zu saurem Regen geführt hätte, der eine Versauerung von Böden und Gewässern verursacht und so die Lebensbedingungen vor allem für Pflanzen und Algen erheblich verschlechtert hätte.[97] Mithilfe eines computergestützten Klimamodells wurde ermittelt, dass nicht Staub oder Ruß, sondern vor allem langlebige Schwefelsäure-Aerosole in der Atmosphäre in den Monaten nach dem Einschlag ein Absinken der durchschnittlichen jährlichen globalen Oberflächentemperatur um mindestens 26 °C bewirkt hätten. Dadurch habe die Erde eine mehrjährige, nahezu globale Dauerfrostperiode erlebt, mit dramatischen Folgen für sowohl Land- als auch Meereslebewesen.[98]
Ein Indiz für die Vulkanismustheorie ist der gewaltige Dekkan-Trapp-Vulkanismus der indischen Dekkan-Hochebene, der mindestens zwei Millionen Kubikkilometer Basalt (Flutbasalt, Trapp) förderte. Neben einer verminderten Sonneneinstrahlung könnten große Mengen Kohlenstoffdioxid in die Atmosphäre gelangt sein, was einen starken Treibhauseffekt zur Folge gehabt hätte.[91] Eine neuere Studie verknüpft den Chicxulub-Impakt unmittelbar mit dem Dekkan-Trapp-Vulkanismus. Demnach verzeichnete der lange „schwelende“ Dekkan-Trapp aufgrund der beim Meteoriteneinschlag freigesetzten Energie von mindestens 3×1023 Joule und der dadurch ausgelösten tektonischen Schockwellen ein neues Aktivitätsmaximum. Laut dieser Hypothese ist der geologisch kurzfristige, über Jahrtausende in das Paläogen reichende Ausstoß von 70 % aller Dekkan-Trapp-Flutbasalte auf dieses Ereignis zurückzuführen.[99]
Das eigentliche Aussterben vollzog sich wahrscheinlich in einem relativ kurzen Zeitraum und „zumindest in Nordamerika nach geologischen Maßstäben augenblicklich“.[100] Zwar wurden einige Dinosaurierknochen in 64,5 Millionen Jahre alten känozoischen Schichten gefunden und daraufhin von einigen Forschern als Hinweis auf ein langsames Aussterben gedeutet,[101] jedoch wurde dieser These heftig widersprochen mit der Begründung, die Knochen seien aus mesozoischen Ablagerungen erodiert und in den känozoischen Schichten neu eingebettet worden.[102] Weit umstrittener ist die Frage, ob die Dinosaurier am Ende der Kreidezeit ohnehin im Niedergang begriffen waren oder ob sie in voller Blüte standen. Forschungen hierzu ergaben, dass die Artneubildungsrate der Dinosaurier schon 50 Millionen Jahre vor dem Ende der Kreidezeit von der normalen Hintergrundaussterberate übertroffen worden sein soll. Ausnahmen von dieser allmählichen Abnahme der Artenvielfalt seien die Hadrosaurier und die Ceratopsia, spezialisierte Pflanzenfresser, die noch in der jüngsten Kreide zahlreiche neue Arten bildeten. Trotz dieser Ausnahmen seien die Dinosaurier insgesamt seinerzeit offenbar relativ anfällig gegenüber einer globalen Katastrophe gewesen.[103] Dem wird entgegengehalten, dass der im Fossilbericht dokumentierte Artenrückgang eher darauf zurückzuführen ist, dass sich zum Ende der Kreidezeit (Campan bis Maastricht) die Bedingungen für die Fossilerhaltung extrem verschlechterten. Die tatsächliche Artenvielfalt der Dinosaurier in diesem Zeitraum, jedenfalls in Nordamerika, sei deshalb bisher unterschätzt worden.[104]
Dinosaurier und Menschen
Keine andere Gruppe ausgestorbener Tiere hat eine derart wichtige kulturelle Bedeutung wie die ausgestorbenen Gruppen der Dinosaurier. Seit die Dinosaurier im 19. Jahrhundert erstmals ins Licht der Öffentlichkeit rückten, erfreuen sie sich weltweit großen Interesses und so großer Beliebtheit, dass teilweise von einer bis heute anhaltenden „Dinomanie“ gesprochen wird.
Fast so bekannt wie die Dinosaurier selbst ist die Tatsache, dass der Großteil von ihnen innerhalb kürzester Zeit ausgestorben sind. Daher wird der Name Dinosaurier oft als Metapher für Denk- und Handelsweisen oder für Dinge benutzt, die als rückwärtsgewandt und nicht mehr zeitgemäß empfunden werden, wie etwa beim Dinosaurier des Jahres.
Entdeckungsgeschichte
Die ersten Dinosaurierfossilien sind schon vor hunderten, wahrscheinlich tausenden von Jahren gefunden worden, wobei ihre wahre Natur nicht erkannt wurde. Im China der östlichen Jin-Dynastie berichtete Cháng Qú (常璩) in seinem Buch Huàyángguó zhì (chinesisch 華陽國志 / 华阳国志) im 4. Jahrhundert über die Entdeckung von „Drachenknochen“ aus der Provinz Sichuan, die vielleicht von Dinosauriern stammten.[105] Dorfbewohner in Zentralchina haben derartige Drachenknochen seit Jahrzehnten ausgegraben, um aus ihnen traditionelle Medizin herzustellen.[106] Die antiken Griechen und Römer fanden ebenso entsprechende Fossilien, die Stoff für ihre Legenden und Sagen boten.

Im Jahr 1677 fertigte Robert Plot die erste formelle Beschreibung eines Dinosaurierfossils an, das in der Nähe von Cornwell bei Oxfordshire (England) entdeckt und heute Megalosaurus zugeschrieben wird.[107] Obwohl er den großen Knochen zuerst einem Elefanten zuordnete, der mit den Römern nach Britannien gekommen war, erkannte Plot später eine scheinbare Ähnlichkeit mit Menschenknochen und schrieb ihn einem Riesen der biblischen Vorsintflut zu. Einer der ersten, der über diese Gruppe urzeitlicher Riesenreptilien wusste und danach forschte, war der englische Arzt Gideon Mantell. Bereits im Jahre 1822 fand er den ersten fossilen Zahn, den er einige Jahre später und nach weiteren Funden Iguanodon nannte.[108] 1824 beschrieb der Amateurpaläontologe William Buckland mit Megalosaurus erstmals einen Dinosaurier in einem wissenschaftlichen Journal. Den Begriff Dinosauria prägte jedoch ein anderer, der englische Anatom Richard Owen. Im Jahr 1842 fasste er Megalosaurus und Iguanodon mit einer weiteren Gattung, Hylaeosaurus, zu einer Gruppe zusammen, die er Dinosauria nannte.[109]


Im Jahr 1858 wurde dann das erste fast vollständige Dinosaurierskelett in Nordamerika entdeckt. Dieser als Hadrosaurus foulkii beschriebene Fund aus Haddonfield (New Jersey) zeigte, dass dieser Dinosaurier wohl zweibeinig lief, und revolutionierte damit das öffentliche Bild der Dinosaurier – zuvor stellte man sich Dinosaurier wie Megalosaurus als riesige, auf vier Beinen laufende, waranähnliche Wesen vor. Diese Entdeckung löste eine wahre Dinomanie (Dinosaurier-Enthusiasmus) in den USA aus.
In den Folgejahren begann eine Feindschaft zwischen zwei berühmten Dinosaurierforschern, Edward Drinker Cope und Othniel Charles Marsh, die in den berühmten „Knochenkriegen“ eskalierte. Vielleicht begann der Streit, als Cope scharfe Kritik seitens Marsh erhielt, als er den Schädel des neu entdeckten, seltsamen Meeresreptils Elasmosaurus am falschen Ende des Körpers platzierte. Dies war der Beginn von Missgunst und Eifersucht zwischen den beiden Forschern, und ihr Streit endete erst 30 Jahre später im Jahr 1897 nach dem Tod Copes. Jeder der beiden Kontrahenten versuchte mit seinem Team, immer mehr Dinosaurierknochen zu finden als der andere – mit allen Mitteln. Sie zerstörten sich gegenseitig viele Knochenfunde, weitere Knochen fielen dem Dynamit zum Opfer, mit dem damals Knochen freigesprengt wurden. Das Resultat der Rivalität waren 142 neu entdeckte Dinosaurierspezies, wozu Marsh 86 Arten und Cope 56 Arten beitrug.[110]
Seitdem werden auf der ganzen Welt Dinosaurierfossilien gefunden: So startete das Berliner Museum für Naturkunde eine große Expedition unter der Leitung von Werner Janensch nach Deutsch-Ostafrika, dem heutigen Tansania, die einzigartige Funde wie Brachiosaurus oder Kentrosaurus zutage förderte. Weitere wichtige Entdeckungen wurden unter anderem in Südamerika, Madagaskar, Indien, der Mongolei, China und ebenso in Deutschland gemacht.
Obwohl Dinosaurier anfangs als lebhafte, agile Tiere galten, wurde dieses Bild durch die Entdeckungen von Marsh und Cope verändert; Dinosaurier wurden zunehmend als dumme, langsame und unbeholfene Kreaturen betrachtet. Einen Sauropoden beschrieb Marsh aufgrund seines im Vergleich zur Körpergröße lächerlich klein erscheinenden Kopfes sogar als Morosaurus („dumme Echse“), später hatte sich jedoch Copes Bezeichnung Camarasaurus durchgesetzt. Erst seit den 1970er Jahren näherte sich die wissenschaftliche Meinung wieder dem ursprünglichen Bild von lebhaften, aktiven Tieren an, nachdem John Ostrom Deinonychus beschrieben hatte und die Idee von einer Warmblütigkeit der Dinosaurier aufkam. Diese Entwicklung löste die Dinosaurier-Renaissance aus, eine bemerkenswerte Zunahme von Aktivitäten innerhalb der Dinosaurierforschung, die bis heute andauert.
Dinosaurier in der Kultur

Modelle
Breites öffentliches Interesse an Dinosauriern erregte erstmals der Dinosaur Court im Crystal Palace Park in London, wo im Jahr 1854 eine Urlandschaft mit verschiedenen, lebensgroßen Modellen ausgestorbener Tiere modelliert wurde, die noch heute zu bestaunen ist. Der Bildhauer Benjamin Waterhouse Hawkins fertigte unter Beratung von Owen 33 Skulpturen ausgestorbener Tiere an, darunter vier von Dinosauriern. Die Popularität der Dinosaurier im Crystal Palace Park wurde so groß, dass Hawkins für ein ähnliches Projekt im Central Park in New York engagiert wurde. Eine neue Verwaltung des Parks ließ diesen Plan jedoch fallen, und die halbfertigen Modelle wurden zerstört.[111]
Skelette
Seit Anfang des 19. Jahrhunderts zogen ausgestellte Skelette urzeitlicher Säugetiere eine Vielzahl von Besuchern an. Mit Reiseausstellungen, die durch die USA und Europa zogen, konnte viel Geld eingenommen werden. Daher sollten schon bald nach der Entdeckung vollständiger Dinosaurierskelette diese ausgestellt werden. Im Jahr 1868 wurde Hawkins beauftragt, erstmals Dinosaurier-Skelette (Hadrosaurus und Dryptosaurus) zu montieren und der Öffentlichkeit zu präsentieren. In einem New Yorker Museum gab es einen regelrechten Besucheransturm. In den folgenden Jahrzehnten wurden durch diese neuen Attraktionen in den Museen viele Skelette anderer urtümlicher Tiere in die Museumskeller verbannt, und in Deutschland konnten im Jahr 2006 allenfalls noch Relikte der Ägypter mit der Popularität von Dinosaurierskeletten konkurrieren.[112]
Literatur und Film
Von Beginn des 20. Jahrhunderts an wurde das Motiv Dinosaurier in Literatur und Film wirtschaftlich immer bedeutender und ertragreicher. Eine der ersten und eine der berühmtesten Fantasy-Geschichten ist Arthur Conan Doyles Roman Die vergessene Welt („The Lost World“, 1912), der ab 1925 vielfach verfilmt wurde. Wie diese handeln viele andere solcher Geschichten von der Entdeckung eines bis dahin isolierten Gebietes, zum Beispiel im Regenwald oder auf einer Insel, wo Dinosaurier bis in unsere Zeit überlebt haben.
In der auch in Deutschland sehr erfolgreichen Zeichentrickserie Familie Feuerstein (1960–1966) gehörten Dinosaurier zum regelmäßigen Inventar. Später entstand eine Reihe von Hollywood-Action-Filmen, in denen die Dinosaurier jedoch, mit Ausnahme einiger Darstellungen in Filmen der Jurassic-Park- und Jurassic-World-Reihe, übertrieben und nicht den wissenschaftlichen Erkenntnissen entsprechend gezeigt werden. So wurden Dinosaurier meist ahistorisch als menschenfressende Ungetüme, oft mit Höhlenmenschen zusammenlebend, dargestellt. Im Jahr 1954 zeigte der preisgekrönte tschechoslowakische Fantasy-Film Reise in die Urzeit, in dem Kinder auf einem Fluss immer tiefer in die Vergangenheit reisen, erstmals die Urzeittiere in den richtigen Zeitaltern.
Neueste Dinosaurierfilme sind oft Dokumentationen, zum Beispiel die mit großem Aufwand produzierte BBC-Serie Dinosaurier – Im Reich der Giganten (englischer Titel: „Walking with Dinosaurs“), in der versucht wird, Dinosaurier in ihrem Lebensraum zu zeigen. Erst durch die moderne und oft aufwändige dreidimensionale Bewegtgrafik (Computer Generated Imagery) ist es glaubhaft möglich, diese Kreaturen lebensecht bildlich darzustellen. Dennoch hat im wissenschaftlichen Bereich die handwerkliche, oftmals kunstfertige und ästhetische Illustration – im englischen Sprachraum wird diese Disziplin manchmal als Paleoart[113] bezeichnet – ihre Bedeutung nicht verloren. Selbst in großen Kinoproduktionen wird heute immer mit Storyboards gearbeitet. Nach dem immensen wirtschaftlichen Erfolg des Films Jurassic Park, der in der Internet Movie Database 2007 als weltweit neunterfolgreichster Film geführt wird, eroberte der „Darsteller Dinosaurier“ ebenso die Welt des Computerspiels.
Ein Dino verkörperte die Hauptfigur der 1990–2006 produzierten Hörbuchserie Mit em Batino unterwägs der Zürcher Verkehrserziehung.
Der ABC-Dino Xenegugeli gibt dem Schweizer Tier-ABC-Klassiker als Buch-, Liederalbum und App von Roland Zoss den Namen.
Bildung und Sprache

Bilder eines (regelmäßig grünhäutig dargestellten) Sauropoden im Stile einer Kinderbuchillustration werden in Leselern-Materialien (Anlauttabellen) als Beispielwort-Bild in der Bedeutung Dinosaurier oder Dino für den Buchstaben D verwendet, z. B. in einer 2014 in bayerischen Grundschulen verwendeten Ausgabe.[114] Dies impliziert, dass heute der Begriff „Dino(saurier)“ verbunden mit dem Ikon des Sauropoden als Bestandteil des rezeptiven Wortschatzes deutschsprachiger Schulanfänger allgemein vorausgesetzt wird.
Im April 2016 wurden Bilder von Köpfen dreier als exemplarisch angesehener Dinosaurier-Taxa zur Aufnahme als Emojis in den Unicode-Standard vorgeschlagen.[115][116] In dem Vorschlagsdokument werden die Köpfe von Tyrannosaurus rex und Brontosaurus („Bronto“) grünhäutig dargestellt, der von Triceratops bräunlich.
Privater Handel mit exklusiven Exemplaren
Auktionshäuser versteigern jährlich auch einige besonders wertvolle originale Dinosaurierskelette oder Skelettteile an exklusive, wohlhabende Sammler. Vor allem begehrt sind Exemplare von Theropoden. Die Stücke können Preise von mehreren Hunderttausenden bis zu mehreren Millionen Euro erzielen.[117] Die Käufer bleiben oft anonym. Experten sehen die Versteigerung wissenschaftlich wertvoller Skelette kritisch, da sie der Forschung nicht zur Verfügung stehen.[118] Im Oktober 2020 wurde für das Skelett eines Tyrannosaurus rex ein Rekordpreis von 27 Mio. Euro erzielt.[119]
Literatur
- Philip J. Currie, Kevin Padian: Encyclopedia of Dinosaurs. Academic Press, San Diego, Calif. u. a. 1997, ISBN 0-12-226810-5.
- James O. Farlow, Michael K. Brett-Surman (Hrsg.): The Complete Dinosaur. Indiana University Press, Bloomington IN u. a. 1997, ISBN 0-253-33349-0.
- William J. T. Mitchell: The Last Dinosaur Book. The Life and Times of a Cultural Icon. University of Chicago Press, Chicago IL u. a. 1998, ISBN 0-226-53204-6 (Auszüge aus dem Buch).
- Gregory S. Paul: The Scientific American Book of Dinosaurs. St. Martin’s Press, New York NY 2000, ISBN 0-312-26226-4.
- Gregory S. Paul: Dinosaurs of the Air. The Evolution and Loss of flight in Dinosaurs and Birds. The Johns Hopkins University Press, Baltimore MD u. a. 2002, ISBN 0-8018-6763-0.
- José Luis Sanz: Starring T. rex! dinosaur mythology and popular culture. Indiana University Press, Bloomington IN 2002, ISBN 0-253-34153-1.
- David B. Weishampel, Peter Dodson, Halszka Osmólska (Hrsg.): The Dinosauria. 2. Ausgabe. University of California Press, Berkeley CA u. a. 2004, ISBN 0-520-24209-2.
- David E. Fastovsky, David B. Weishampel: The Evolution and Extinction of the Dinosaurs. 2. Ausgabe. Cambridge University Press, Cambridge u. a. 2005, ISBN 0-521-81172-4.
Weblinks
Auf Deutsch
- Zeitreise ins Erdmittelalter – Die Paläobiologie der Dinosaurier. Von Martin Sander. In: Gerold Wefer (Hrsg.): expedition Erde. 2., überarbeitete und erweiterte Auflage, 2006 (PDF; 1,8 MB)
- Dossier Dinosaurier von scinexx. Stand 15. August 2001
- Dinosaurier-Interesse (Privates Projekt mit einführenden Informationen über Dinosaurier und andere Tiere des Mesozoikums für Erwachsene und Kinder)
- Jurassic Harz (Privates Projekt zu den Dinosaurierfunden im Harz)
Auf Englisch
- Palaeos.com (Umfassendes privates Projekt mit hohem wissenschaftlichem Anspruch, über Dinosaurier und die gesamte Lebewelt der Erdgeschichte)
- EnchantedLearning.com (Kommerzielle Internetpräsenz ohne Registrierungszwang mit knappen und sachlichen Informationen, richtet sich an Erwachsene und Kinder)
- Fossilworks – Dinosaur facts and figures (Kuriose Statistiken der wissenschaftlichen Datenbank “The Paleobiology Database”)
Bilder
- Skeletal Drawing (Bilder zur Anatomie der Dinosaurier erstellt von dem Paläontologen Scott Hartman)
Einzelnachweise
- Wilhelm Gemoll: Griechisch-Deutsches Schul- und Handwörterbuch. 9. Auflage, durchgesehene und erweiterte von Karl Vretska. Mit einer Einführung in die Sprachgeschichte von Heinz Kronasser. Freytag u. a., München u. a. 1965.
- Sean P. Modesto, Jason S. Anderson: The phylogenetic definition of Reptilia. Systematic Biology. Bd. 53, Nr. 5, 2004, S. 815–821, doi:10.1080/10635150490503026 (alternativer Volltextzugriff: IUCN/SSC Tortoise and Freshwater Turtle Specialist Group PDF 552 kB).
- Kutschera, Ulrich, 1955-: Evolutionsbiologie : Ursprung und Stammesentwicklung der Organismen ; 17 Tabellen. 4., aktualisierte und erw. Auflage. Ulmer, Stuttgart 2015, ISBN 3-8252-8623-1.
- Randall B. Irmis: A reappraisal of the phylogeny of early dinosaurs. In: The Palaeontological Association. Newsletter. Bd. 65, 2007, ISSN 0954-9900, S. 92–94, online (PDF; 120 kB).
- George Olshevsky: An annotated checklist of dinosaur species by continent (= Mesozoic Meanderings. Bd. 3, ISSN 0271-9428). G. Olshevsky Publications Requiring Research, San Diego CA 2000, S. 1–157.
- David Lambert und The Diagram Group: The Dinosaur Data Book. The definitive, fully illustrated encyclopedia of dinosaurs. Avon Books, New York NY 1990, ISBN 0-380-75896-2, S. 288.
- Nizar Ibrahim, Paul C. Sereno, Cristiano Dal Sasso, Simone Maganuco, Matteo Fabbri, David M. Martill, Samir Zouhri, Nathan Myhrvold, Dawid A. Iurino: Semiaquatic adaptations in a giant predatory dinosaur. In: Science. Bd. 345, Nr. 6204, 2014, S. 1613–1616, doi:10.1126/science.1258750.
- Steve C. Wang, Peter Dodson: Estimating the Diversity of Dinosaurs. In: Proceedings of the National Academy of Sciences. Bd. 103, Nr. 37, 2006, S. 13601–13605, doi:10.1073/pnas.0606028103, PMID 16954187.
- Dale A. Russell: China and the lost worlds of the dinosaurian era. In: Historical Biology. Bd. 10, Nr. 1, 1995, ISSN 0891-2963, S. 3–12, doi:10.1080/10292389509380510.
- Thomas R. Holtz Jr.: Dinosaurs. The most complete, up-to-date encyclopedia for dinosaur lovers of all ages. Random House, New York NY 2007, ISBN 978-0-375-82419-7, S. 36.
- Michael J. Benton: Fossil quality and naming dinosaurs. In: Biology Letters. Bd. 4, Nr. 6, 2008, ISSN 1744-9561, S. 729–732, doi:10.1098/rsbl.2008.0402.
- David E. Fastovsky, David B. Weishampel: The Evolution and Exctinction of the Dinosaurs. Cambridge University Press, Cambridge u. a. 1996, ISBN 0-521-44496-9.
- Michael J. Benton: Origin and Relationships of Dinosauria. In: David B. Weishampel, Peter Dodson, Halszka Osmólska (Hrsg.): The Dinosauria. 2nd edition. University of California Press, Berkeley CA u. a. 2004, ISBN 0-520-24209-2, S. 7–19, doi:10.1525/california/9780520242098.003.0002.
- Max C. Langer, Fernando Abdala, Martha Richter, Michael J. Benton: A sauropodomorph dinosaur from the Upper Triassic (Carnian) of southern Brazil. In: Comptes rendus de l'Académie des Sciences. Série 2, Fascicule A: Sciences de la terre et des planètes. Bd. 329, Nr. 7, 1999, ISSN 0764-4450, S. 511–517, doi:10.1016/S1251-8050(00)80025-7.
- Richard Cowen: History of Life. 4th edition. Blackwell Publishing, Malden MA u. a. 2005, ISBN 1-4051-1756-7, S. 151–175.
- Tai Kubo, Michael J. Benton: Evolution of hindlimb posture in archosaurs: limb stresses in extinct vertebrates. In: Palaeontology. Bd. 50, Nr. 6, 2007, ISSN 0031-0239, S. 1519–1529, doi:10.1111/j.1475-4983.2007.00723.x.
- Harry G. Seeley: On the classification of the fossil animals commonly named Dinosauria. In: Proceedings of the Royal Society. Bd. 43, Nr. 258–265, 1887, S. 165–171, doi:10.1098/rspl.1887.0117.
- Alfred Sherwood Romer: Osteology of the Reptiles. University of Chicago Press, Chicago IL 1956.
- Robert T. Bakker, Peter M. Galton: Dinosaur Monophyly and a New Class of Vertebrates. In: Nature. Bd. 248, Nr. 5444, 1974, S. 168–172, doi:10.1038/248168a0.
- Sterling J. Nesbitt, Paul M. Barrett, Sarah Werning, Christian A. Sidor, Alan J. Charig: The Oldest Dinosaur? A Middle Triassic Dinosauriform from Tanzania. In: Biology Letters. Bd. 9, Nr. 1, 2012, ISSN 1744-9561, 20120949, doi:10.1098/rsbl.2012.0949.
- Paul C. Sereno: The Evolution of Dinosaurs. In: Science. Bd. 284, Nr. 5423, 1999, S. 2137–2147, doi:10.1126/science.284.5423.2137.
- Paul C. Sereno, Catherine A. Forster, Raymond R. Rogers, Alfredo M. Monetta: Primitive dinosaur skeleton from Argentina and the early evolution of Dinosauria. In: Nature. Bd. 361, Nr. 6407, 1993, S. 64–66, doi:10.1038/361064a0.
- Thomas R. Holtz Jr., Ralph E. Chapman, Matthew C. Lamanna: Mesozoic Biogeography of Dinosauria. In: David B. Weishampel, Peter Dodson, Halszka Osmólska (Hrsg.): The Dinosauria. 2nd edition. University of California Press, Berkeley CA u. a. 2004, ISBN 0-520-24209-2, S. 627–642, doi:10.1525/california/9780520242098.003.0030.
- David E. Fastovsky, Joshua B. Smith: Dinosaur Paleoecology. In: David B. Weishampel, Peter Dodson, Halszka Osmólska (Hrsg.): The Dinosauria. 2nd edition. University of California Press, Berkeley CA u. a. 2004, ISBN 0-520-24209-2, S. 614–626, doi:10.1525/california/9780520242098.003.0029.
- Paul C. Sereno, Jeffrey A. Wilson, Lawrence M. Witmer, John A. Whitlock, Abdoulaye Maga, Oumarou Ide, Timothy A. Rowe: Structural extremes in a Cretaceous dinosaur. In: PLoS ONE. Bd. 2, Nr. 11, 2007, ISSN 1932-6203, S. e1230, doi:10.1371/journal.pone.0001230.
- Vandana Prasad, Caroline A. E. Strömberg, Habib Alimohammadian, Ashok Sahni: Dinosaur Coprolites and the Early Evolution of Grasses and Grazers. In: Science. Bd. 310, Nr. 5751, 2005, S. 1177–1180, doi:10.1126/science.1118806.
- Kevin Padian: Basal Avialae. In: David B. Weishampel, Peter Dodson, Halszka Osmólska (Hrsg.): The Dinosauria. 2nd edition. University of California Press, Berkeley CA u. a. 2004, ISBN 0-520-24209-2, S. 210–231, doi:10.1525/california/9780520242098.003.0013.
- John H. Ostrom: The ancestry of birds. In: Nature. Bd. 242, Nr. 5393, 1973, S. 136, doi:10.1038/242136a0.
- Gerald Mayr, Burkhard Pohl, D. Stefan Peters: A Well-Preserved Archaeopteryx Specimen with Theropod Features. In: Science. Bd. 310, Nr. 5753, 2005, S. 1483–1486, doi:10.1126/science.1120331.
- Xing Xu, Mark A. Norell, Xuewen Kuang, Xiaolin Wang, Qi Zhao, Chengkai Jia: Basal tyrannosauroids from China and evidence for protofeathers in tyrannosauroids. In: Nature. Bd. 431, Nr. 7009, 2004, S. 680–684, doi:10.1038/nature02855, PMID 15470426.
- Ursula B. Göhlich, Luis M. Chiappe: A new carnivorous dinosaur from the Late Jurassic Solnhofen archipelago. In: Nature. Bd. 440, Nr. 7082, 2006, S. 329–332, doi:10.1038/nature04579.
- Phillip Burgers, Luis M. Chiappe: The wing of Archaeopteryx as a primary thrust generator. In: Nature. Bd. 399, Nr. 6731, 1999, S. 60–62, doi:10.1038/19967.
- Richard Cowen: History of Life. 3rd edition. Blackwell Science, Malden MA 2000, ISBN 0-632-04444-6.
- Sankar Chatterjee, R. Jack Templin: Biplane wing planform and flight performance of the feathered dinosaur Microraptor gui. In: Proceedings of the National Academy of Sciences. Bd. 104, Nr. 5, 2007, S. 1576–1580, doi:10.1073/pnas.0609975104.
- Jan Peczkis: Implications of body-mass estimates for dinosaurs. In: Journal of Vertebrate Paleontology. Bd. 14, Nr. 4, 1995, ISSN 0272-4634, S. 520–533, doi:10.1080/02724634.1995.10011575.
- Anatomy and evolution. National Museum of Natural History, abgerufen am 15. Juli 2014 (englisch).
- Kenneth Carpenter: Biggest of the Big: A critical re-evaluation of the mega-sauropod Amphicoelias fragillimus Cope, 1878. In: John R. Foster, Spencer G. Lucas (Hrsg.): Paleontology and geology of the Upper Jurassic Morrison formation (= New Mexico Museum of Natural History & Science. Bulletin. 36). New Mexico Museum of Natural History & Science, Albuquerque NM 2006, S. 131–138, online.
- Warum Riesendinosaurier so groß wurden. Pressemitteilung der Universität Bonn vom 9. Oktober 2008, abgerufen am 20. August 2018, mit Bezug auf: Marcus Clauss, Martin Sander: Sauropod dinosaur gigantism. In: Science, Band 322, 2008, S. 200–201. DOI: 10.1126/science.1160904 (alternativer Volltextzugriff: ResearchGate)
- John S. McIntosh, Michael K. Brett-Surman, James O. Farlow: Sauropods. In: James O. Farlow, Michael K. Brett-Surman (Hrsg.): The Complete Dinosaur. Indiana University Press, Bloomington IN u. a. 1997, ISBN 0-253-33349-0, S. 281.
- Edwin H. Colbert: Men and Dinosaurs. The Search in Field and Laboratory. E. P. Dutton & Company, New York NY 1968.
- David M. Lovelance, Scott A. Hartman, William R. Wahl: Morphology of a specimen of Supersaurus (Dinosauria, Sauropoda) from the Morrison Formation of Wyoming, and a re-evaluation of Diplodocoid phylogeny. In: Arquivos do Museu Nacional. Rio de Janeiro. Bd. 65, Nr. 4, 2007, ISSN 0365-4508, S. 527–544, online (PDF; 21,7 MB) (Memento vom 30. Juli 2014 im Internet Archive).
- Cristiano Dal Sasso, Simone Maganuco, Eric Buffetaut, Marco A. Mendez: New information on the skull of the enigmatic theropod Spinosaurus, with remarks on its size and affinities. In: Journal of Vertebrate Paleontology. Bd. 25, Nr. 4, 2005, S. 888–896, doi:10.1671/0272-4634(2005)025[0888:NIOTSO]2.0.CO;2.
- Johan Yans, Jean Dejax, Denise Pons, Christian Dupuis, Philippe Taquet: Implications paléontologiques et géodynamiques de la datation palynologique des sédiments à faciès wealdien de Bernissart (bassin de Mons, Belgique). In: Comptes Rendus Palevol. Bd. 4, Nr. 1/2, 2005, ISSN 1631-0683, S. 135–150, doi:10.1016/j.crpv.2004.12.003.
- John R. Horner Jr., David B. Weishampel, Catherine A. Forster: Hadrosauridae. In: David B. Weishampel, Peter Dodson, Halszka Osmólska (Hrsg.): The Dinosauria. 2nd edition. University of California Press, Berkeley CA u. a. 2004, ISBN 0-520-24209-2, S. 25–46, doi:10.1525/california/9780520242098.003.0023.
- Julia J. Day, Paul Upchurch, David B. Norman, Andrew S. Gale, H. Philip Powell: Sauropod Trackways, Evolution, and Behavior. In: Science. Bd. 296, Nr. 5573, 2002, S. 1659, doi:10.1126/science.1070167.
- Don Lessem, Donald F. Glut: The Dinosaur Society’s Dinosaur Encyclopedia. Random House, New York NY u. a. 1993, ISBN 0-679-41770-2, S. 19–20.
- W. Desmond Maxwell, John H. Ostrom: Taphonomy and paleobiological implications of Tenontosaurus-Deinonychus associations. In: Journal of Vertebrate Paleontology. Bd. 15, Nr. 4, 1995, S. 707–712, doi:10.1080/02724634.1995.10011256.
- Brian T. Roach, Daniel L. Brinkman: A Reevaluation of Cooperative Pack Hunting and Gregariousness in Deinonychus antirrhopus and Other Nonavian Theropod Dinosaurs. In: Bulletin of the Peabody Museum of Natural History. Bd. 48, Nr. 1, 2007, ISSN 0079-032X, S. 103–138, doi:10.3374/0079-032X(2007)48[103:AROCPH]2.0.CO;2.
- John R. Horner, Robert Makela: Nest of juveniles provides evidence of family structure among dinosaurs. In: Nature. Bd. 282, Nr. 5736, 1979, S. 296–298, doi:10.1038/282296a0.
- Oviraptor nesting Nester von Oviraptor oder Protoceratops?
- Qingjin Meng, Jinyuan Liu, David J. Varricchio, Timothy Huang, Chunling Gao: Parental care in an ornithischian dinosaur. In: Nature. Bd. 431, Nr. 7005, 2004, S. 145–146, doi:10.1038/431145a.
- Luis M. Chiappe, Frankie Jackson, Rodolfo A. Coria, Lowell Dingus: Nesting Titanosaurs from Auca Mahuevo and Adjacent Sites: Understanding Sauropod Reproductive Behavior and embryonic development. In: Kristina Curry Rogers, Jeffrey A. Wilson (Hrsg.): The Sauropods. Evolution and paleobiology. University of California Press, Berkeley CA u. a. 2005, ISBN 0-520-24623-3, S. 285–302, doi:10.1525/california/9780520246232.003.0011.
- Darren H. Tanke, Philip J. Currie: Head-biting behavior in theropod dinosaurs: paleopathological evidence. In: Gaia. Bd. 15, 1998, ISSN 0871-5424, S. 167–184, online.
- James A. Hopson: The evolution of cranial display structures in hadrosaurian dinosaurs. In: Paleobiology. Bd. 1, Nr. 1, 1975, ISSN 0094-8373, S. 21–43.
- Carl F. Diegert, Thomas E. Williamson: A digital acoustic model of the lambeosaurine hadrosaur Parasaurolophus tubicen. In: Journal of Vertebrate Paleontology. Bd. 18, Supplement 3, 1998, S. 38A.
- Xing Xu, Mark A. Norell: A new troodontid dinosaur from China with avian-like sleeping posture. In: Nature. Bd. 431, Nr. 7010, 2004, S. 838–841, doi:10.1038/nature02898.
- The Fighting Dinosaurs. American Museum of Natural History, abgerufen am 25. April 2015 (englisch).
- Kenneth Carpenter: Evidence of predatory behavior by theropod dinosaurs. In: Gaia. Bd. 15, 1998, S. 135–144.
- Raymond R. Rogers, David W. Krause, Kristina Curry Rogers: Cannibalism in the Madagascan dinosaur Majungatholus atopus. In: Nature. Bd. 422, Nr. 6931, 2003, S. 515–518, doi:10.1038/nature01532.
- David J. Varricchio, Anthony J. Martin, Yoshihiro Katsura: First trace and body fossil evidence of a burrowing, denning dinosaur. In: Proceedings of the Royal Society. Series B: Biological Sciences. Bd. 274, Nr. 1616, 2007, ISSN 0080-4649, S. 1361–1368, doi:10.1098/rspb.2006.0443.
- Fucheng Zhang, Zhonghe Zhou, Xing Xu, Xiaolin Wang: A juvenile coelurosaurian theropod from China indicates arboreal habits. In: Naturwissenschaften. Bd. 89, Nr. 9, 2002, S. 394–398, doi:10.1007/s00114-002-0353-8.
- R. McNeill Alexander: Dinosaur biomechanics. In: Proceedings of the Royal Society. Series B: Biological Sciences. Bd. 273, Nr. 1596, 2006, S. 1849–1855, doi:10.1098/rspb.2006.3532.
- Alain Goriely, Tyler McMillen: Shape of a Cracking Whip. In: Physical Review Letters. Bd. 88, Nr. 24, 2002, ISSN 0031-9007, 244301, doi:10.1103/PhysRevLett.88.244301.
- Donald M. Henderson: Effects of stomach stones on the buoyancy and equilibrium of a floating crocodilian: a computational analysis. In: Canadian Journal of Zoology. Bd. 81, Nr. 8, 2003, ISSN 0008-4301, S. 1346–1357, doi:10.1139/z03-122.
- Rubén Ezquerra, Stéfan Doublet, Loic Costeur, Peter M. Galton, Felix Pérez-Lorente: Were non-avian theropod dinosaurs able to swim? Supportive evidence from an Early Cretaceous trackway, Cameros Basin (La Rioja, Spain). In: Geology. Bd. 35, Nr. 6, 2007, S. 507–510, doi:10.1130/G23452A.1.
- Thomas H. Rich, Patricia Vickers-Rich, Roland A. Gangloff: Polar Dinosaurs. In: Science. Bd. 295, Nr. 5557, 2002, S. 979–980, doi:10.1126/science.1068920.
- Keith M. Parsons: Drawing out Leviathan. Dinosaurs and the Science Wars. Indiana University Press, Bloomington IN u. a. 2001, ISBN 0-253-33937-5, S. 22–48.
- Robert A. Eagle, Thomas Tütken, Taylor S. Martin, Aradhna K. Tripati, Henry C. Fricke, Melissa Connely, Richard L. Cifelli, John M. Eiler: Dinosaur Body Temperatures Determined from Isotopic (13C-18O) Ordering in Fossil Biominerals. In: Science. Bd. 333, Nr. 6041, 2011, S. 443–445, doi:10.1126/science.1206196.
Johannes Seiler: Ein Thermometer für Dinosaurier. idw-online.de, 23. Juni 2011. - Robin R. Dawson et al. 2020. Eggshell geochemistry reveals ancestral metabolic thermoregulation in Dinosauria. Science Advances 6 (7): eaax9361; doi: 10.1126/sciadv.aax9361
- Patrick M. O'Connor, Leon P. A. M. Claessens: Basic avian pulmonary design and flow-through ventilation in non-avian theropod dinosaurs. In: Nature. Bd. 436, Nr. 7048, 2005, S. 253–256, doi:10.1038/nature03716.
- Mathew J. Wedel: Vertebral pneumaticity, air sacs, and the physiology of sauropod dinosaurs. In: Paleobiology. Bd. 29, Nr. 2, 2003, S. 243–255, doi:10.1666/0094-8373(2003)029<0243:VPASAT>2.0.CO;2.
- Paul E. Fisher, Dale A. Russell, Michael K. Stoskopf, Reese E. Barrick, Michael Hammer, Andrew A. Kuzmitz: Cardiovascular Evidence for an Intermediate or Higher Metabolic Rate in an Ornithischian Dinosaur. In: Science. Bd. 288, Nr. 5465, 2000, S. 503–505, doi:10.1126/science.288.5465.503.
- Willem J. Hillenius, John A. Ruben: The Evolution of Endothermy in Terrestrial Vertebrates: Who? When? Why? In: Physiological and Biochemical Zoology. Bd. 77, Nr. 6, 2004, ISSN 1522-2152, S. 1019–1042, doi:10.1086/425185.
- Timothy Rowe, Earle F. McBride, Paul C. Sereno: Dinosaur with a Heart of Stone. In: Science. Bd. 291, Nr. 5505, 2001, S. 783, doi:10.1126/science.291.5505.783a.
- Anusuya Chinsamy, Willem J. Hillenius: Physiology of nonavian dinosaurs. In: David B. Weishampel, Peter Dodson, Halszka Osmólska (Hrsg.): The Dinosauria. 2nd edition. University of California Press, Berkeley CA u. a. 2004, ISBN 0-520-24209-2, S. 643–659, doi:10.1525/california/9780520242098.003.0031.
- C. G. Dacke, S. Arkle, D. J. Cook, I. M. Wormstone, S. Jones, M. Zaidi, Z. A. Bascal: Medullary Bone and Avian Calcium Regulation. In: Journal of Experimental Biology. Bd. 184, Nr. 1, 1993, S. 63-88 (online)
- N. Stagni, B. De Bernard, G. F. Liut, F. Vittur, M. Zanetti: Ca2+-Binding Glycoprotein in Avian Bone Induced by Estrogen. In: Connective Tissue Research. Bd. 7, Nr. 3, 1980, S. 121-125, doi:10.3109/03008208009152103
- Mary H. Schweitzer, Jennifer L. Wittmeyer, John R. Horner: Gender-Specific Reproductive Tissue in Ratites and Tyrannosaurus rex. In: Science. Bd. 308, Nr. 5727, 2005, S. 1456–1460, doi:10.1126/science.1112158.
- Anusuya Chinsamy, Luis M. Chiappe, Jesús Marugán-Lobón, Gao Chunling, Zhang Fengjiao: Gender identification of the Mesozoic bird Confuciusornis sanctus. In: Nature Communications. Bd. 4, Artikel-Nr. 1381, 2012, doi:10.1038/ncomms2377
- Andrew H. Lee, Sarah Werning: Sexual maturity in growing dinosaurs does not fit reptilian growth models. In: Proceedings of the National Academy of Sciences. Bd. 105, Nr. 2, 2008, S. 582–587, doi:10.1073/pnas.0708903105.
- Cristiano Dal Sasso, Marco Signore: Exceptional soft-tissue preservation in a theropod dinosaur from Italy. In: Nature. Bd. 292, Nr. 6674, 1998, S. 383–387, doi:10.1038/32884.
- Mary H. Schweitzer, Jennifer L. Wittmeyer, John R. Horner, Jan K. Toporski: Soft-Tissue Vessels and Cellular Preservation in Tyrannosaurus rex. In: Soft-Tissue Vessels and Cellular Preservation in Tyrannosaurus rex. Science, Band 307, Nr. 5717, 2005, S. 1952–1955, doi:10.1126/science.1108397.
- Thomas G. Kaye, Gary Gaugler, Zbigniew Sawlowicz: Dinosaurian Soft Tissues Interpreted as Bacterial Biofilms. In: PLoS ONE. Bd. 3, Nr. 7, 2008, S. e2808, doi:10.1371/journal.pone.0002808.
- Han-Lin Wang, Zi-Ying Yan, Dong-Yan Jin: Reanalysis of published DNA sequence amplified from Cretaceous dinosaur egg fossil. In: Molecular Biology and Evolution. Bd. 14, Nr. 5, 1997, ISSN 0737-4038, S. 589–591, online.
- Belinda S. Chang, Karolina Jönsson, Manija A. Kazmi, Michael J. Donoghue, Thomas P. Sakmar: Recreating a Functional Ancestral Archosaur Visual Pigment. In: Molecular Biology and Evolution. Bd. 19, Nr. 9, 2002, S. 1483–1489, online.
- Graham Embery, Angela C. Milner, Rachel J. Waddington, Rachel C. Hall, Martin S. Langley, Anna M. Milan: Identification of proteinaceous material in the bone of the dinosaur Iguanodon. In: Connective Tissue Research. Bd. 44, Nr. 1, 2003, ISSN 0091-1690, S. 41–46, doi:10.1080/03008200390152070, PMID 12952172.
- Mary H. Schweitzer, Mark Marshall, Keith Carron, D. Scott Bohle, Scott C. Busse, Ernst V. Arnold, Darlene Barnard, John R. Horner, Jean R. Starkey: Heme compounds in dinosaur trabecular bone. In: Proceedings of the National Academy of Sciences. Bd. 94, Nr. 12, 1997, S. 6291–6296, online, PMID 9177210.
- T-Rex: Größe durch „pubertären“ Wachstumsschub. Undatierter Artikel auf Science orf.at (Abgerufen am 19. November 2014) mit Bezug auf Gregory M. Erickson, Peter J. Makovicky, Philip J. Currie, Mark A. Norell, Scott A. Yerby, Christopher A. Brochu: Gigantism and comparative life-history parameters of tyrannosaurid dinosaurs. In: Nature. Bd. 430, Nr. 7001, 2004, S. 772–775, doi:10.1038/nature02699 (alternativer Volltextzugriff: ResearchGate).
- Nicole Klein: Bone histology and growth of the prosauropod dinosaur Plateosaurus engelhardti MEYER, 1837 from the Norian bonebeds of Trossingen (Germany) and Frick (Switzerland). Dissertation zur Erlangung des Doktorgrades der Mathematisch-Naturwissenschaftlichen Fakultät der Rheinischen Friedrich-Wilhelms-Universität Bonn, 2004 (urn:nbn:de:hbz:5N-04660), S. 6 ff. (für einen kurzen [historischen] Überblick zu paläohistologischen Untersuchungen an fossilen Tetrapoden und zur Methode der Skeletochronologie), S. 107 f. (für Schätzungen der Lebensspanne von Plateosaurus)
- Eberhard Frey: Wie alt wurden die Saurier? SWR-Blog, 29. September 2009, abgerufen am 19. November 2014.
- J. David Archibald, David E. Fastovsky: Dinosaur extinction. In: David B. Weishampel, Peter Dodson, Halszka Osmólska (Hrsg.): The Dinosauria. 2nd edition. University of California Press, Berkeley CA u. a. 2004, ISBN 0-520-24209-2, S. 672–684, doi:10.1525/california/9780520242098.003.0033.
- L. W. Alvarez, W. Alvarez, F. Asaro, H. V. Michel: Extraterrestrial Cause for the Cretaceous-Tertiary Extinction. In: Science. Band 208, Nr. 4448, 1980, S. 1095–1108, doi:10.1126/science.208.4448.1095 (alternativer Volltextzugriff: UCSC).
- Johan Vellekoop, Appy Sluijs, Jan Smit, Stefan Schouten, Johan W. H. Weijers, Jaap S. Sinninghe Damsté, Henk Brinkhuis: Rapid short-term cooling following the Chicxulub impact at the Cretaceous-Paleogene boundary. In: PNAS. 111, Nr. 21, Mai 2014. doi:10.1073/pnas.1319253111.
- Adriana Ocampo, Vivi Vajda, Eric Buffetaut: Unravelling the Cretaceous–Paleogene (KT) Turnover, Evidence from Flora, Fauna and Geology. In: Charles Cockell, Christian Koeberl, Iain Gilmour (Hrsg.): Biological Processes Associated with Impact Events. (ESF Impact). Springer, Berlin u. a. 2005, ISBN 3-540-25735-7, S. 197–219, doi:10.1007/b135965.
- Simon Day, Mark Maslin: Linking large impacts, gas hydrates, and carbon isotope excursions through widespread sediment liquefaction and continental slope failure: The example of the K-T boundary event. In: T. Kenkmann, F. Hörz, A. Deutsch (Hrsg.): Large meteorite impacts III. (= The Geological Society of America. Special Papers. Bd. 384). Geological Society of America, Boulder CO 2005, S. 239–258, doi:10.1130/0-8137-2384-1.239
- Kunio Kaiho, Naga Oshima, Kouji Adachi, Yukimasa Adachi, Takuya Mizukami, Megumu Fujibayashi, Ryosuke Saito: Global climate change driven by soot at the K-Pg boundary as the cause of the mass extinction. In: Scientific Reports. Bd. 6, Art.-Nr. 28427, 2016, doi:10.1038/srep28427.
- Sohsuke Ohno, Toshihiko Kadono, Kosuke Kurosawa, Taiga Hamura, Tatsuhiro Sakaiya, Keisuke Shigemori, Yoichiro Hironaka, Takayoshi Sano, Takeshi Watari, Kazuto Otani, Takafumi Matsui, Seiji Sugita: Production of sulphate-rich vapour during the Chicxulub impact and implications for ocean acidification. In: Nature Geoscience. Bd. 7, 2014, S. 279–282, doi:10.1038/ngeo2095.
- Julia Brugger, Georg Feulner, Stefan Petri: Baby, it's cold outside: Climate model simulations of the effects of the asteroid impact at the end of the Cretaceous. In: Geophysical Research Letters. Januar 2017. doi:10.1002/2016GL072241. Siehe dazu auch ein Video einer der Simulationen auf der Webpräsenz des Potsdam-Instituts für Klimafolgenforschung.
- Mark A. Richards, Walter Alvarez, Stephen Self, Leif Karlstrom, Paul R. Renne, Michael Manga, Courtney J. Sprain, Jan Smit, Loÿc Vanderkluysen, Sally A. Gibson: Triggering of the largest Deccan eruptions by the Chicxulub impact. (PDF) In: Geological Society of America Bulletin. April 2015. doi:10.1130/B31167.1.
- David E. Fastovsky, Peter M. Sheehan: The Extinction of the Dinosaurs in North America. In: GSA Today. Bd. 15, Nr. 3, 2005, S. 4–10, doi:10.1130/1052-5173(2005)015<4:TEOTDI>2.0.CO;2
- James E. Fassett, Robert A. Zielinski, James R. Budahn: Dinosaurs that did not die: Evidence for Paleocene dinosaurs in the Ojo Alamo Sandstone, San Juan Basin, New Mexico. In: Christian Koeberl, Kenneth G. MacLeod (Hrsg.): Catastrophic events and mass extinctions. Impacts and beyond (= The Geological Society of America. Special Papers. Bd. 356). Geological Society of America, Boulder CO 2002, S. 307–336, doi:10.1130/0-8137-2356-6.307.
- Robert Sullivan: No Paleocene dinosaurs in the San Juan Basin, New Mexico. In: The Geological Society of America. Abstracts with Programs. Bd. 35, Nr. 5, 2003, ISSN 0016-7592, S. 15.
- Manabu Sakamoto, Michael Benton, Chris Venditti: Dinosaurs in decline tens of millions of years before their final extinction. In: Proceedings of the National Academy of Sciences. Bd. 113, Nr. 18, 2016, S. 5036–5040, doi:10.1073/pnas.1521478113.
- Alfio Alessandro Chiarenza, Philip D. Mannion, Daniel J. Lunt, Alex Farnsworth, Lewis A. Jones, Sarah-Jane Kelland, Peter A. Allison: Ecological niche modelling does not support climatically-driven dinosaur diversity decline before the Cretaceous/Paleogene mass extinction. In: Nature Communications. Bd. 10, 2019, Art.-Nr. 1091, doi:10.1038/s41467-019-08997-2; siehe dazu auch Michael Greshko: Hätten die Dinosaurier ohne den Asteroiden überlebt? In: National Geographic. 11. März 2019, abgerufen am 21. Dezember 2020.
- Dong Zhiming: Dinosaurian Faunas of China. China Ocean Press u. a., Beijing u. a. 1992, ISBN 0-387-52084-8.
- Dinosaur bones „used as medicine“. BBC News, 2007, abgerufen am 6. Juni 2007 (englisch).
- Oxford University Museum of Natural History: Robert Plot, abgerufen am 2. August 2014.
- Hans-Dieter Sues: European Dinosaur Hunters. In: James O. Farlow, Michael K. Brett-Surman (Hrsg.): The Complete Dinosaur. Indiana University Press, Bloomington IN u. a. 1997, ISBN 0-253-33349-0, S. 14.
- Deborah Cadbury: Dinosaurierjäger. Der Wettlauf um die Erforschung der prähistorischen Welt. Rowohlt, Reinbek bei Hamburg 2001, ISBN 3-498-00924-9.
- Thom Holmes: Fossil Feud. The Bone Wars of Cope and Marsh, Pioneers in Dinosaur Science. Silver Burdett Press, Parsippany NJ 1996, ISBN 0-382-39147-0.
- David Norman: Dinosaurier. Bertelsmann, München 1991, ISBN 3-570-02250-1.
- Kenneth Carpenter: Dinosaurs as Museum Exhibits. In: James O. Farlow, Michael K. Brett-Surman (Hrsg.): The Complete Dinosaur. Indiana University Press, Bloomington IN u. a. 1997, ISBN 0-253-33349-0, S. 150–164.
- Smithsonian National Museum of Natural History – Department of Paleobiology (Memento vom 31. Januar 2010 im Internet Archive)
- Schreibtabelle zu Frohes Lernen (Fibel). Wien (Österreichischer Bundesverlag) / Stuttgart (Klett Verlag) 2014.
- Jessica Binsch: Warum es ein Dinosaurier-Emoji geben sollte. Abgerufen am 23. November 2020.
- Courtney Milan: Jurassic Emoji. (PDF) In: Document L2/16-072. Unicode Technical Committee, 2. April 2016, abgerufen am 13. April 2016.
- Hobby für Reiche: DiCaprio und Cage auf Saurierjagd. orf.at, 12. Dezember 2018, abgerufen am 13. Dezember 2018.
- Dinosaurierskelett für drei Mio. Euro versteigert. orf.at, 14. Oktober 2020, abgerufen 14. Oktober 2020.
- Handelsblatt/Barbara Kutscher (9. Oktober 2020): T-Rex-Skelett für 31 Millionen Dollar – Die Welt der Hochpreiskunst.