Schuppenkriechtiere
Die Schuppenkriechtiere (Squamata) bilden eine der vier Großgruppen der Reptilien (Reptilia). Sie stellen mit 10.954 Arten[1] (6905 „Echsen“[2], 3848 Schlangen[3] und 201 Doppelschleichen[4]; Stand August 2020) einen bedeutenden Teil der Landwirbeltierfauna, mehr als die Säugetiere mit etwa 6400 Arten. Über 96 % der rezenten, bekannten Reptilienarten sind Schuppenkriechtiere.[5]
| Schuppenkriechtiere | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Schuppenkriechtiere (Squamata) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Squamata | ||||||||||||
| Oppel, 1811 |
Die meisten Squamaten sind mittelgroße Tiere, die größten rezenten Schuppenkriechtiere sind der Netzpython (Python reticulatus) und die Große Anakonda (Eunectes murinus), die eine Länge von etwa sechs bis sieben Meter erreichen können. Das kleinste ist Brookesia micra, ein nur drei Zentimeter lang werdendes Stummelschwanzchamäleon. Alle Schuppenkriechtiere haben einen mehr oder weniger langgestreckten Körper, dessen Querschnitt oft rund ist, aber auch abgeflacht oder hochrückig (Chamäleons) sein kann.
Verbreitung
Schuppenkriechtiere besiedeln fast alle terrestrischen Lebensräume. Sie leben mit Ausnahme der Antarktis auf allen Kontinenten. Mit den Seeschlangen (Hydrophiinae) haben sie auch die Küstenregion tropischer Meere erobert. Die meisten Schuppenkriechtiere leben in den Tropen, nach Norden nimmt die Artenfülle immer mehr ab; im größten Teil Kanadas, in Alaska, auf Grönland und im Norden Sibiriens fehlen sie. Die Waldeidechse (Zootoca vivipara) und die Kreuzotter (Vipera berus) sind die am weitesten nach Norden vordringenden Reptilienarten. Sie kommen noch nördlich des Polarkreises vor. Das am weitesten südlich vorkommende Schuppenkriechtier ist der Leguanartige Liolaemus magellanicus, der noch auf Feuerland lebt. In Europa gibt es knapp über 50 Echsen- sowie etwa 30 Schlangenarten.[6] In Deutschland leben zwölf Arten: fünf Eidechsen, die Blindschleiche und sechs Schlangen.
Merkmale
Haut


Die Beschuppung der Epidermis (Oberhaut) kann sehr verschieden sein. Sie ist bei Geckos am feinsten, kann aus flachen, glatten oder gekielten Schilden bestehen, aber auch mit Dornen oder vorstehenden Höckern versehen sein. Leguanartige haben oft klingenartige Stachelschuppen, die einen Kamm im Nacken, auf dem Rücken, dem Schwanz oder an der Kehlwamme bilden. Bei einigen dünenbewohnenden Echsen finden sich Säume von abstehenden Schuppen an den Zehen, die ein Einsinken in den Sand verhindern; den Basilisken helfen diese Säume, schnell über Wasseroberflächen zu laufen. Geckos und Anolis haben an der Unterseite der Zehen Haftlamellen, die von der Epidermis gebildet werden und aus vielen einzelnen Härchen bestehen.
Die oberste Schicht der Epidermis wächst nicht mit und wird regelmäßig – alle drei bis vier Wochen bei vielen Echsen oder nach sechs bis zehn Monaten bei Schlangen oder Chamäleons – abgestreift. Vorher wurde sie durch Häutungshärchen angehoben und mit Luft oder Lymphflüssigkeit von der darunter gebildeten neuen Epidermis getrennt. Geckos fressen sie unmittelbar nach der Häutung auf. Die Häutung erfolgt bei den meisten Echsen in Fetzen, bei Schlangen oder beinlosen Echsen im Ganzen (Exuvie). Klapperschlangen bilden beim Häuten eine Ringschuppe, die zu einem Teil ihrer Schwanzrassel wird.
Die unter der Epidermis liegende Lederhaut (Dermis) ist dick und besteht aus dreidimensional verlaufenden Bündeln von Bindegewebe. Bei Echsen werden hier Osteodermen (flache Knochenplatten) gebildet, deren Form und Lage ungefähr jenen der darüber liegenden Schuppen entsprechen. Die Osteodermen können, vor allem bei verschiedenen Skinkartigen, aber auch einigen Schleichenartigen, einen geschlossenen Panzer bilden. Unter der Dermis liegt die Subkutis (Unterhaut), die der Muskulatur nur locker aufliegt und durch horizontal verlaufendes Bindegewebe gebildet wird.
Schädel
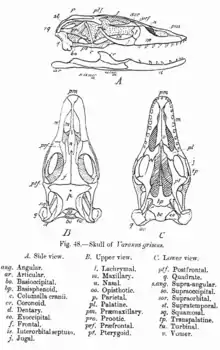
Der Schädel der Schuppenkriechtiere unterscheidet sich vom diapsiden Schädel durch die Reduktion des unteren der beiden Jochbögen. Bei den Schlangen, den Doppelschleichen und einigen beinlosen Skinkartigen ist auch der obere Jochbogen zurückgebildet. Ein weiteres Kennzeichen ist die sogenannte Streptostylie, die stark erhöhte innere Beweglichkeit des Squamaten-Schädels. Diese wird dadurch erreicht, dass das Quadratum, ein Knochen des primären Kiefergelenks der Reptilien, beweglich am Schuppenbein aufliegt. Die Beweglichkeit des Schädels ist bei Schlangen am weitesten ausgeprägt. Deren Unterkiefer besteht aus zwei hälftigen Unterkieferbögen; die zahntragenden Dentalen sind am Vorderende nicht miteinander verwachsen, sondern durch Faserknorpel flexibel miteinander verbunden (Symphyse) und auch gegenüber den übrigen Unterkieferknochen beweglich. Es gibt allerdings auch, angepasst an eine grabende Lebensweise, die Tendenz, den Schädel wieder zu verfestigen. Dies ist besonders bei den Doppelschleichen, den Schlangenschleichen und den Blindschlangenartigen ausgeprägt. Bei einigen grabenden Skinken, Gürtelechsen, Echten Eidechsen und den Krustenechsen werden die oberen und seitlichen Schädelpartien zusätzlich durch kleine Knochenplatten (Osteodermen) verstärkt. Das Foramen parietale, eine Öffnung für das Parietalorgan im Schädeldach, bleibt bei den Echsen immer frei. Schlangen haben kein Parietalorgan.
Bezahnung

Zahntragende Schädelknochen sind bei den Echsen die Maxillaria im Oberkiefer und die Dentalia im Unterkiefer. Daneben können auch die Gaumenknochen Zähne tragen: das Gaumenbein (Palatinum) bei einigen Schleichen, das Flügelbein (Pterygoid) bei einigen Tejus und Eidechsen, beide Knochen bei den Schlangen. Die Zähne sind wurzellos an der Innenseite der Kieferknochen befestigt (Pleurodontie). Dies wird als Plesiomorphie der Schuppenkriechtiere angesehen. Ersatzzähne wachsen aus einer Knospe an der Basis der alten Zähne. Bei den Agamen, den Chamäleons, den Spitzschwanz-Doppelschleichen (Trogonophidae) und den Schlangen tritt eine andere Form der Zahnbefestigung, die Akrodontie auf. Dabei sitzen die Zähne auf der Oberkante des Kiefers. Agamen und Chamäleons werden deshalb innerhalb der Leguanartigen als Monophylum Acrodonta zusammengefasst. Squamaten mit akrodonter Bezahnung vollziehen keinen Zahnwechsel.
Die Zähne sind normalerweise homodont (gleichartig). Die meisten Squamaten fressen Insekten, ihre Zähne sind konisch mit einer (Geckos), zwei oder drei Spitzen (Eidechsen, Tejus, die meisten Leguanartigen). Mollusken fressende Schuppenkriechtiere, wie einige Skinke, Schleichen, Tejus und Warane, haben breit abgeflachte Zähne. Bei großen Waranen ist der Hinterrand fein gesägt. Viele Pflanzen fressende Leguanartige haben Zähne mit flachen Kronen und gesägten Schneiden. Bei den auch Samen und harte Pflanzenteile fressenden Dornschwanzagamen sind die Zähne zu einer Kauleiste zusammengewachsen. Die Zähne der Schlangen sind konisch und nach hinten gekrümmt. Die Fangzähne der Giftschlangen sind mit einer giftleitenden Rinne oder einem Hohlkanal versehen. Vipern (Viperidae) und Erdvipern (Atractaspididae) haben im Ruhezustand nach hinten geklappte Zähne, die beim Öffnen des Mauls aufgerichtet werden. Bei Blindschlangen (Typhlopidae), Schlankblindschlangen (Leptotyphlopidae) und den Afrikanischen Eierschlangen (Dasypeltis) ist die Bezahnung reduziert.
Postcranialskelett

Das Skelett der Schuppenkriechtiere ist in Anpassung an unterschiedliche Lebensweisen oft drastisch verändert worden. Die meisten haben fünf Halswirbel wie Chamäleons, andere, wie die Warane, bis zu neun. Ab dem dritten Halswirbel kann es kurze Rippen (Cervicalrippe) geben. Die Anzahl der Rumpfwirbel (Wirbel vor dem Kreuzbein) hängt von der Streckung des Rumpfes ab und kann 23 bis 29 bei den Geckos, 74 bis 110 bei den mit ihnen verwandten Flossenfüßen betragen. Skinkartige haben 26 bis 107 Rumpfwirbel, vierfüßige Schleichenartige 29 bis 36, ihre beinlosen Verwandten 51 bis 68. Schlangen können über 400 Wirbel haben, davon bis zu 300 Rumpfwirbel. Alle Rumpfwirbel tragen Rippen.
Über Schultergürtel und Vorderbeine verfügen, mit Ausnahme der Zweifuß-Doppelschleichen (Bipedidae) und der Gymnophthalmidae-Gattung Bipes, nur die vierbeinigen Arten. Er besteht aus Schulterblatt (Scapula), Rabenbein (Coracoid), Schlüsselbein (Clavicula) und Interclavicula. Die letzten beiden sind mit dem knorpeligen Brustbein verbunden. Zwei Einbuchtungen im Rabenbein, die bei einigen Formen auch zu Fenstern durchgebrochen sind, gelten als Squamaten-Synapomorphie. Der Beckengürtel besteht aus Darmbein (Ilium), Sitzbein (Ischium) und Schambein (Pubis). Die drei Knochen treffen in der Hüftgelenkpfanne (Acetabulum) zusammen. Der Beckengürtel ist bei den beinlosen Formen teilweise oder vollständig reduziert. Die Tendenz zur Reduktion der Gliedmaßen tritt, von den Leguanartigen abgesehen, in allen Taxa oberhalb der Familienebene auf. Innerhalb der Geckoartigen sind es die Flossenfüße, bei den Skinkartigen gibt es Formen mit verkümmerten Beinen bei den Skinken, bei den Gürtelechsen (Gattung Chamaesaura) und bei den Zwergtejus (Gattungen Bachia und Calyptommatus). Von den Schleichenartigen fehlen einigen Schleichen (Anguidae) und allen Ringelschleichen (Anniellidae) die Gliedmaßen. Das Gleiche gilt für alle 3000 Schlangenarten. Riesenschlangen verfügen noch über einen stabförmigen Überrest des Beckens im Hinterleib und mit dem Aftersporn einen rudimentären Überrest von Hinterextremitäten.
Sinnesorgane


Die Augen sind je nach Art stark unterschiedlich ausgebildet und können bei nachtaktiven Gruppen, z. B. diversen Geckos, sehr groß sein, bei anderen, wie einigen Blindschlangenartigen, auch nahezu vollständig reduziert und ohne Pigmente sein. Nachtaktive Arten haben senkrecht-ovale bis schlitzförmige, tagaktive Arten meist runde Pupillen. Die recht großen Orbitae sind durch ein Interorbitalseptum (Scheidewand) getrennt, die Augen werden von vier geraden und zwei schrägen Augenmuskeln und dem Musculus retractor bulbi gesteuert. Der Augapfel ist um die Cornea herum verfestigt, bei den meisten Schuppenkriechtieren außer Schlangen durch einen Skleralring. Tränendrüsen sind vorhanden. Die Nickhaut wird durch Sekrete von Harderschen- und Nickhautdrüsen gleitfähig gehalten, bei Schlangen und einigen anderen Schuppenkriechtieren (etwa viele Gekkota) ist die Nickhaut mit dem unteren Lid zu einer starren „Brille“ verwachsen. Sekrete der zuvor genannten Drüsen werden bei ihnen über Tränennasengänge bzw. Lacrimalgänge in die Mundhöhle abgeleitet. Die Netzhaut weist meist nur zwei oder drei verschiedene Typen von Zapfen auf, bei einigen höheren Schlangen kommen auch Stäbchen vor. Bei einigen Schuppenkriechtieren (z. B. Ahaetulla) ist die Fähigkeit zum binokularen Sehen vorhanden. Untersuchungen an der Nachtsicht des Helmgeckos Tarentola chazaliaei ergaben, dass seine Augen in der Nacht Farben unterscheiden können, wenn Menschen bereits farbenblind sind. Möglicherweise liegt dies darin begründet, dass sich in seinen Augen ausschließlich Zapfen befinden.[7]
Bei geschlossenem Maul erfolgt die olfaktorische (chemische) Wahrnehmung über die Nasenlöcher durch einen Vorhof bis zur eigentlichen Nasenhöhle mit Riechepithel und innerer Nasenöffnung. Die Sinnesepithelien liegen meist am Dach der Nasenhöhle, und ihre Fläche wird durch einen 'Muschel' (Concha) genannten Auswuchs vergrößert. In diesem Aufsatz finden sich bei einigen Schuppenkriechtieren vergrößerte Nasendrüsen, oft zur Salzausscheidung, etwa bei Wüstenbewohnern wie Dornschwanzagamen (Uromastyx) und der marinen Meerechse (Amblyrhynchus cristatus). Die äußeren Nasenlöcher einiger stark ans Wasser gebundener Gruppen wie Seeschlangen (Hydrophiinae), Meerechse und Wassertrugnattern (Homalopsinae) sind verschließbar.
Ein anderes Organ zur olfaktorischen Wahrnehmung ist das Jacobsonsche Organ bzw. Vomeronasalorgan. Embryonal entsteht es durch Abschnürung von der Nasenhöhle und ist später nicht mehr mit ihr verbunden. Es öffnet sich durch zwei Gänge zum Gaumendach, Geruchspartikel werden dann an der Zungenspitze zu den Sinnesepithelien des Vomeronasalorgans befördert. Die Geruchspartikel werden aufgenommen, indem die Zunge regelmäßig aus dem Mund heraus- und wieder hineinbewegt wird; dieser besonders bei Waranen (Varanus) und Schlangen häufige Vorgang wird 'Züngeln' genannt.
Geschmacksknospen finden sich vor allem auf der Zunge, aber auch am Gaumendach und auf der Mundschleimhaut. Bei Schlangen sind Geschmacksknospen nur auf der Mundschleimhaut vorhanden. Lange war strittig, ob Squamaten ihren Geschmackssinn nutzen. Bei einem 2001 durchgeführten Wahlexperiment verschmähten Rotkehlanolis (Anolis carolinensis) mit bitteren Stoffen versehene Futterinsekten, während mit Süßstoff versehene Insekten gegenüber normal schmeckenden Insekten bevorzugt wurden. Auch bei verschlossenen Gängen des Vomeronasalorgans blieben diese Präferenzen erhalten. Somit könnte der Geschmackssinn bei Reptilien, die nicht primär das Vomeronasalorgan nutzen, eine Rolle in der Beuteauswahl spielen.[8] Eidechsen wie die Gattung Lacerta können offenbar alle vier Geschmacksqualitäten (süß, sauer, salzig, bitter) unterscheiden.
Das Gehörorgan besteht aus Außenohr, Paukenhöhle und Innenohr. Das Trommelfell liegt fast immer auf Niveau der Kopfseitenfläche. Bei einigen Schuppenkriechtieren ist das Außenohr reduziert, da das Trommelfell mit der schuppigen Haut kaschiert ist, oder aber die Grubenränder des Tympanons sind mit dem Trommelfell verwachsen.
Im Jahr 2010 wurde außerdem experimentell bestätigt, dass sich der Gecko Cyrtodactylus philippinicus am Erdmagnetfeld orientieren kann. Dies war der erste Nachweis eines Magnetsinnes bei Schuppenkriechtieren.[9]
Fortpflanzung


Schuppenkriechtiere haben eine innere Befruchtung und paaren sich von der Seite. Je nachdem auf welcher Seite das Männchen ist, wird der rechte oder der linke Hemipenis benutzt. Während der Paarung halten sich die Männchen bei den meisten Echsen- und einigen Schlangenarten (bei Giftschlangen nicht) mit dem Maul am Hals oder der Flanke des Weibchens fest. Riesenschlangen umschlingen sich während der Paarung mit den Hinterleibern.
Die Mehrzahl der Schuppenkriechtiere legt Eier. Die Eier haben eine pergamentartige Schale und können sich während der Inkubation durch die Aufnahme von Wasser ausdehnen. Bei den meisten Geckoartigen, mit Ausnahme von Lidgeckos, Doppelfingergeckos, Carphodactylidae und Flossenfüßen, sind die Eierschalen allerdings verkalkt. Viviparie und Ovoviviparie haben sich mehrfach, in verschiedenen Taxa unabhängig voneinander entwickelt, beispielsweise bei einigen Skinken, allen Nachtechsen, einigen Schleichen, den Boas und Sandboas, fast allen Seeschlangen und zahlreichen Vipern. Bei einer überraschend hohen Zahl der Schuppenkriechtiere gibt es eine Fortpflanzung durch Parthenogenese. Zuerst wurde dieses Phänomen bei den Kaukasischen Felseidechsen (Darevskia) entdeckt, kommt aber auch bei vier Geckogattungen, den Rennechsen (Cnemidophorus), zwei Gattungen der Zwergtejus, den Schmetterlingsagamen (Leiolepis), den Mittelamerikanischen Nachtechsen (Lepidophyma) sowie bei der Blindschlange Ramphotyphlops braminus vor. Brutpflege betreiben nur wenige Schlangen wie zum Beispiel die Pythons. Sie legen sich bis zum Schlupf der Jungtiere in Schlingen um ihr Gelege und erzeugen Wärme durch Muskelzittern. Wie bei Schildkröten und Krokodilen wird auch bei einigen Echsen das Geschlecht durch die Temperatur während des letzten Drittels der Inkubationszeit festgelegt. Bei hoher Inkubationstemperatur entstehen Männchen, ist sie niedriger, dagegen Weibchen. Die Schlüpflinge aller eierlegenden Squamaten befreien sich mit einem Eizahn aus der Eierschale. Der Schlupf kann einige Stunden bis Tage dauern. Die Jungtiere verlassen das Ei erst, wenn der Dottersack eingezogen ist. Nach dem Schlupf sind die Tiere sofort selbstständig und ähneln den Adulten. Lediglich eine abweichende Juvenilzeichnung kommt vor.
Systematik
Äußere Systematik
Die Schuppenkriechtiere gehören zu den diapsiden Reptilien, deren Schädel durch zwei Schädelfenster gekennzeichnet ist. Ihre Schwestergruppe, mit der sie in der Überordnung Schuppenechsen (Lepidosauria) vereinigt sind, sind die Sphenodontia. Zu jenen gehören, neben den heute noch lebenden Brückenechsen aus Neuseeland, nur noch Taxa aus dem Mesozoikum. Die Monophylie der Lepidosauria ist durch fast 50 Synapomorphien gesichert.
| Sauropsida (Reptilia) |
| ||||||||||||||||||
Innere Systematik
Die innere Systematik der Schuppenkriechtiere wird von verschiedenen Bearbeitern gegensätzlich diskutiert und ist als noch sehr vorläufig anzusehen. Klassisch wurden die Schuppenkriechtiere in zwei Unterordnungen eingeteilt, die Echsen (Lacertilia) und die Schlangen (Serpentes). Später kamen noch die Doppelschleichen (Amphisbaenia), die wegen ihrer grabenden Lebensweise einen von den anderen Echsengruppen stark abweichenden Körperbau haben, als eigene Unterordnung hinzu. Da die zuletzt genannten Gruppen aber aus den Echsen hervorgegangen sind, handelt es sich bei den Echsen um ein paraphyletisches Taxon. In dieser Gruppe wurden alle Schuppenkriechtiere zusammengefasst, die sich nicht den anderen beiden Gruppen zuordnen ließen. Doppelschleichen und Schlangen gelten als monophyletisch.
Eine nach morphologischen Gesichtspunkten vorgenommene Aufteilung der Echsen in vier Großgruppen findet sich in vielen Publikationen. Die Leguanartigen, zu denen auch die Agamen und Chamäleons gezählt werden, stehen als unterste Klade am Ursprung des Stammbaums. Alle anderen Echsen gehören dem Taxon Scleroglossa an, dessen Monophylie durch mehr als 20 Autapomorphien gestützt wird. Diese teilen sich in die Geckoartigen, zu denen neben den Geckos auch die beinlosen Flossenfüße aus Australien und Neuguinea gehören, und die Autarchoglossa, die sich durch den Besitz eines Musculus rectus abdominis auszeichnen. Die Autarchoglossa werden in Skinkartige und Schleichenartige unterteilt. Zu den Skinkartigen gehören unter anderem die in Europa heimischen Echten Eidechsen. Viele Wissenschaftler rechnen auch die Doppelschleichen und die ebenfalls beinlosen Schlangenschleichen dazu. Zu den Schleichenartigen gehören, neben den Schleichen, auch die großen Warane und die Krustenechsen. Da die Warane eine Reihe von Merkmalen mit den Schlangen teilen, werden auch diese von vielen Experten als Schleichenartige angesehen. Die Schlangen haben in der klassischen Systematik den Rang einer Unterordnung und werden in drei Überfamilien unterteilt: die primitiven, wühlenden und unterirdisch lebenden Blindschlangenartigen, die Wühl- und Riesenschlangenartigen, zu denen neben einigen weitgehend unbekannten Familien auch die Riesenschlangen gehören, sowie die Nattern- und Vipernartigen, die mit weit über 2000 Arten die große Masse der Schlangen stellt. Die Systematik der Schlangen unterliegt aber ebenso größeren Änderungen, weshalb die paraphyletische Überfamilie der Wühl- und Riesenschlangenartigen nicht mehr gültig ist.
Dieses klassische Konzept über die Verwandtschaft innerhalb der Schuppenkriechtiere gibt das folgende einfache Kladogramm wieder (weitestgehend nach W. Böhme, 2004):
| Schuppenkriechtiere |
| |||||||||||||||||||||||||||

Nach jüngsten molekularbiologischen Untersuchungen werden die verwandtschaftlichen Verhältnisse zwischen den Großtaxa der Schuppenkriechtiere in Frage gestellt und die Monophylie der Scleroglossa, der Autarchoglossa und der Skinkartigen (Scincomorpha) bestritten. Es ergibt sich danach ein völlig anderer Stammbaum, der sich inzwischen auf einige anatomische Merkmale stützen kann. Die Schlangenschleichen stehen an der Basis des Kladogramms, sie haben als einzige Schuppenkriechtiere eine einspitzige Zunge. Alle anderen Schuppenkriechtiere werden in das neue Taxon Bifurcata gestellt. Die Bifurcata haben eine in unterschiedlichem Ausmaß ausgeprägt zweispitzige Zunge, die nur leicht eingekerbt sein kann, wie bei den Geckos, oder im anderen Extrem tief gespalten ist, wie bei Tejus, Waranen und Schlangen. Einzige Ausnahme hiervon sind die Chamäleons, deren Zunge sekundär zu einem hochspezialisierten Fangapparat umgebildet ist. Die Bifurcata teilen sich in einer Dichotomie in die Geckoartigen, deren Schlüpflinge einen paarigen Eizahn besitzen, und die Unidentata, die nur einen Eizahn haben. Innerhalb der Unidentata werden Scinciformata und Episquamata unterschieden. Zu den Scinciformata gehören die Skinke, die Gürtelechsen und die Nachtechsen. Die Episquamata bestehen aus den Laterata, zu denen einige sonst zu den Skinkartigen gerechnete Familien gehören, und den Toxicofera.
Nach dem Toxicofera-Konzept ist die Fähigkeit giftiger Schuppenkriechtiere wie der Krustenechsen, der Giftnattern und der Vipern, Toxine zu produzieren, nicht mehrmals, sondern nur einmal bei einem gemeinsamen Ahnen vor etwa 200 bis 230 Millionen Jahren entstanden. Zu den Toxicofera gehören die Schlangen, die Schleichenartigen und die Leguanartigen; die beiden letzteren sind Schwestergruppen. Die Schlangen gehören hier also nicht, wie bei dem oben dargestellten, nach morphologischen Gesichtspunkten erstellten Kladogramm, zu den Schleichenartigen; die Leguanartigen stehen nicht an der Basis des Kladogramms, sondern sind hoch in der Kronengruppe angesiedelt.[5][10][11] Das Toxicofera-Konzept erfährt weitere Unterstützung, da auch in Ober- und Unterkiefer eines Leguanartigen, der Östlichen Bartagame (Pogona barbata), giftproduzierendes Drüsengewebe gefunden wurde. Außerdem werden die Symptome, die nach den Bissen von drei Waranarten auftreten, nicht mehr nur als Ergebnis einer Bakterieninfektion, sondern als Resultat einer aktiven Giftsekretion interpretiert.[12]
Kladogramm der Schuppenkriechtiere nach molekularbiologischen Untersuchungen:[5][11][13][14]
|
Kladogramm der Schlangen nach molekularbiologischen Untersuchungen:[5][11][16][17]
|
Stammesgeschichte
Die ersten den Schuppenkriechtieren ähnlichen Echsen erscheinen im Oberperm und in der Untertrias von Südafrika. Weitere Fossilien wurden in Schichten der Obertrias in England und Nordamerika gefunden. Ihr Skelett ist deutlich primitiver als das der rezenten Taxa. Deshalb werden sie als eigenes Taxon Eolacertilia klassifiziert. Sie eroberten schnell neue Lebensräume und verdrängten die vorher dominierenden echsenartigen Reptilien, wie die Procolophonier, die Millerosaurier und die Eosuchier.

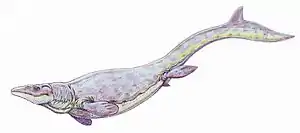
Aus der Zeit des Jura sind fast keine Squamatenfossilien bekannt. Erst im späten Jura gibt es wieder Fossilfunde in China und Europa. Diese sind den heutigen Großtaxa Gekkota, Scincomorpha und Anguimorpha zuzuordnen. Der in Frankreich gefundene Euposaurus wird wegen seiner akrodonten Zähne (auf der Oberkante der Kiefers) in die Verwandtschaft der Agamen zu den Leguanartigen gestellt. In die gleiche Verwandtschaftsgruppe gehört der gleitfähige Xianglong aus der Unterkreide von China.[18] Die Tejus erschienen mit zahlreichen Arten in der Oberkreide von Nordamerika und Zentralasien. Aus derselben Zeit stammen die ersten Schleichen, Xenosauriden, Krustenechsen und Warane, sowie mit Dinislysia aus Patagonien die erste gut bekannte Schlange. Die in Israel gefundene Schlange Pachyrhachis hat mehr als 200 Rippen, verkümmerte Beckengürtel und Hinterbeine, hat aber Vorderbeine und Schultergürtel vollständig verloren. Insgesamt ist die Überlieferung von Schlangenfossilien aus der Kreide und dem unteren Tertiär sehr lückenhaft. Die obere Kreide ist auch die Blütezeit mariner Squamaten, wie den Aigialosauriern und den riesigen Mosasauriern, die mit fast 20 Gattungen weltweit in den Meeren vorkamen und Längen bis zu 18 Metern erreichten. Die Schädel beider Gruppen hatten Ähnlichkeit mit Waranschädeln, sie zeigen aber auch anatomische Gemeinsamkeiten mit Riesenschlangen. Beide Taxa wurden Opfer des Kreide-Tertiär-Grenze-Massenaussterbens vor 65 Millionen Jahren.
Aus dem Paläozän gibt es die ersten Fossilien von Doppelschleichen. Blindschlangenartige und Nattern erscheinen im Eozän, Vipern und Giftnattern im Miozän. Wahrscheinlich fällt die Radiation der Schlangen mit der Ausbreitung kleiner Säugetiere, einer wichtigen Beute, zusammen. Auch die Chamäleons lassen sich seit dem Miozän in Europa und Afrika nachweisen.
Quellen
Hauptquelle für den Artikel ist:
- Wolfgang Böhme: Squamata, Schuppenkriechtiere. In: Wilfried Westheide, Reinhard Rieger (Hrsg.): Wirbel- oder Schädeltiere. (= Spezielle Zoologie. Teil 2). Fischer, Stuttgart 2004, ISBN 3-8274-0900-4, S. 354–357.
Quelle für das Kapitel Stammesgeschichte ist:
- Robert L. Carroll: Paläontologie und Evolution der Wirbeltiere. Thieme, Stuttgart 1993, ISBN 3-13-774401-6.
Alles nicht durch diese Werke abgedeckte wird durch Einzelnachweise belegt.
- Squamata In: The Reptile Database
- Sauria In: The Reptile Database
- Serpentes In: The Reptile Database
- Amphisbaenia In: The Reptile Database
- Nicolas Vidal, S. Blair Hedges: The phylogeny of squamate reptiles (lizards, snakes, and amphisbaenians) inferred from nine nuclear protein-coding genes. (PDF; 164 kB). In: Comptes Rendus Biologies. 328, Nr. 10–11, 2005, S. 1000–1008, doi:10.1016/j.crvi.2005.10.001.
- Günter Diesner, Josef Reichholf: Lurche und Kriechtiere. Mosaik, München 1996, ISBN 3-576-10697-9.
- L. S. V. Roth, L. Lundström, A. Kelber, R. H. H. Kröger, P. Unsbo: The pupils and optical systems of gecko eyes. In: Journal of Vision. 9 (3), 2009, S. 1–11 (Volltext; PDF; 541 kB).
- Kathrin F. Stanger-Hall, Derek A. Zelmer, Christine Bergren, Stephanie A. Burns: Taste Discrimination in a Lizard (Anolis carolinensis, Polychrotidae). In: Copeia. (2), 2001, S. 490–498.
- C. Marek, N. Bissantz, E. Curio, A. Siegert, B. Tacud & D. Ziggel: Spatial orientation of the Philippine bent-toed gecko (Cyrtodactylus philippinicus) in relation to its home range. In: Salamandra. Band 46, Nr. 2, 2010, S. 93–97, Volltext.
- Nicolas Vidal, S. Blair Hedges: Molecular evidence for a terrestrial origin of snakes. (PDF; 192 kB). In: Proceedings. Biological sciences. 271, 2004, S. 226-S229. PMID 15252991.
- Ted M. Townsend, Allan Larson, Edward Louis, J. Robert Macey: Molecular phylogenetics of squamata: The position of snakes, amphisbaenians, and dibamids, and the root of the squamate tree. In: Systematic Biology. 53, Nr. 5, 2004, S. 735–757, doi:10.1080/10635150490522340.
- B. G. Fry, N. Vidal, J. A. Norman, F. J. Vonk, H. Scheib, S. F. Ramjan, S. Kuruppu, K. Fung, S. B. Hedges, M. K. Richardson, W. C. Hodgson, V. Ignjatovic, R. Summerhayes, E. Kochva: Early evolution of the venom system in lizards and snakes. In: Nature. Band 439, Nummer 7076, Februar 2006, S. 584–588, doi:10.1038/nature04328. PMID 16292255.
- Robert Alexander Pyron, Frank T. Burbrink, John J Wiens: A phylogeny and revised classification of Squamata, including 4161 species of lizards and snakes. In: BMC Evolutionary Biology. 2013, 13, S. 93 doi:10.1186/1471-2148-13-93.
- Nicolas Vidal, Anna Azvolinsky, Corinne Cruaud, S. Blair Hedges: Origin of tropical American burrowing reptiles by transatlantic rafting. In: Biology Letters. Band 4, Nr. 1, 2008, S. 115–118, doi:10.1098/rsbl.2007.0531.
- N. Goicoechea, D. R. Frost, I. De la Riva, K. C. M. Pellegrino, J. Sites, M. T. Rodrigues, J. M. Padial: Molecular systematics of teioid lizards (Teioidea/Gymnophthalmoidea: Squamata) based on the analysis of 48 loci under tree-alignment and similarity-alignment. In: Cladistics. März 2016, doi:10.1111/cla.12150
- Robert Alexander Pyron, Frank T. Burbrink, John J Wiens: A phylogeny and revised classification of Squamata, including 4161 species of lizards and snakes. In: BMC Evolutionary Biology. 2013, 13, S. 93 doi:10.1186/1471-2148-13-93.
- Nicolas Vidal, Anna Azvolinsky, Corinne Cruaud, S. Blair Hedges: Origin of tropical American burrowing reptiles by transatlantic rafting. In: Biology Letters. Band 4, Nr. 1, 2008, S. 115–118, doi:10.1098/rsbl.2007.0531.
- Pi-Peng Li, Ke-Qin Gao, Lian-Hai Hou, Xing Xu: A gliding lizard from the Early Cretaceous of China. In: Proceedings of the National Academy of Sciences. 104, Nr. 13, 2007, S. 5507–5509, doi:10.1073/pnas.0609552104.
