Dentin
Das Dentin (von lateinisch dens ‚Zahn‘, (Genetiv: dentis) und dem chemischen Suffix -in), auch Zahnbein (lateinisch Substantia eburnea), stellt einen großen Anteil des Zahns dar. Im Gegensatz zum Zahnschmelz kann es lebenslang durch einen Prozess der Biomineralisation neu gebildet werden, allerdings nur an der Grenzfläche zum Zahnmark. Es ist eines der beständigsten organischen Materialien[1] und alle Klassen der Wirbeltiere, welche aus den Knorpelfischen hervorgingen, tragen Dentin-Gene.
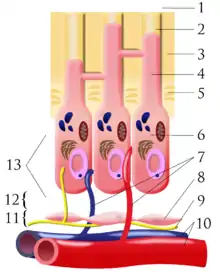
1) außerhalb des Zahnes/Zahnschmelzes
2) Dentin Tubuli
3) Dentin
4) Odontoblastenfortsatz
5) Prädentin
6) Odontoblast
7) Kapillaren
8) Fibroblasten
9) Nerven
10) Arterien / Venen
11) zellreiche Zone
12) zellarme Zone
13 ) Pulpakammer


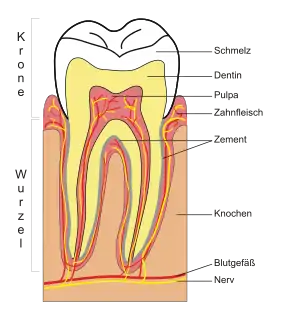
Zahnaufbau
Das Dentin ist knochenähnlich und setzt sich zu ca. 70 % aus mineralischer Substanz und zu 20 % aus organischen Bestandteilen zusammen. Die restlichen 10 % sind Wasser. Die mineralische Substanz besteht überwiegend aus Calciumhydroxylapatit, einem calciumhaltigen Phosphatmineral. Die organische Substanz besteht zu 90 % aus Kollagen. Die Farbe ist gelblich. Im Bereich der Zahnkrone liegt ihm der Zahnschmelz auf („Kronendentin“) und im Bereich der Zahnwurzel der Wurzelzement. Das Dentin umschließt das Pulpencavum (Pulpahöhle) mit der Zahnpulpa (Zahnmark), die aus Blutgefäßen, Nerven, Bindegewebe und Lymphgefäßen besteht.
Dentinproteine
Dentinproteine sind schlecht charakterisiert, da diese in einer sehr festen Matrix verankert sind und kaum zerstörungsfrei zu untersuchen sind. Wie im Knochen machen Kollagen Typ I, saure Proteine und Proteoglykane einen großen Anteil der extrazellulären Proteine aus.[2] Einige kollagenfreie Proteinfraktionen konnten aufgrund ihrer Molekülmasse getrennt werden: Fraktion I mit überwiegend Phosphoproteinen, Fraktion II mit mehreren sauren Proteinen, Albumin, Proteoglykanen und einem Protein mit geringem Phosphatanteil, Fraktion III mit einem charakteristischen Glykoprotein einer Molekularmasse von 95 kDa und kleineren Anteilen anderer Proteine, darunter Albumin und Phosphoproteinen sowie Fraktion IV mit niedermolekularen Anteilen von γ-Carboxyglutamat-enthaltenden Proteinen, die Knochenproteinen ähneln.[3]
Bildung
Die dentinbildenden Zellen werden Odontoblasten genannt. Die Odontoblastenkörper liegen in der Pulpa und stehen mit freien Nervenendigungen in Kontakt. Ihre Fortsätze, die Tomes'schen Fasern, ragen in die feinen Kanälchen (Dentintubuli) hinein, die von der Pulpa zentrifugal nach außen bis an die Schmelz-Dentin-Grenze verlaufen.
Je nach Zeitpunkt der Bildung werden drei Arten von Dentin unterschieden. Während der Zahnbildung produziertes Dentin wird als „primäres Dentin“ bezeichnet. Strukturell gleich ist das „Sekundärdentin“. Dieses wird lebenslang gebildet und engt so im Laufe der Jahre die Pulpenhöhle ein. Dadurch wird die Sensibilität an den Zähnen im Alter reduziert. Histologisch davon zu unterscheiden ist „Tertiärdentin“, auch Reizdentin genannt. Es entwickelt sich nicht gleichmäßig im gesamten Bereich der Odontoblasten, sondern wird aufgrund eines externen Reizes gebildet, um die Pulpa zu schützen. Ursachen dafür sind neben Karies auch Bruxismus, freiliegende Zahnhälse sowie Parodontopathien.
Das zirkumpulpale Dentin bildet den Hauptanteil des Dentins und entsteht zeitlich nach dem Manteldentin. Die Odontoblastenfortsätze weisen hier eine geringere Zahl von Seitenverzweigungen auf als im Manteldentin. Da die Mineralisation des Dentins in Zyklen erfolgt, kommt es zur Bildung eines typischen Linienmusters. Diese Linien werden nach dem österreichischen Histologen Viktor von Ebner-Rofenstein (1842–1925) als Ebner-Linien bezeichnet. Entsprechend nennt man das zirkumpulpale Dentin auch Ebner-Dentin. Die Owenschen Konturlinien nennt man das deutlich hypomineralisierte Wachstumsdentin.
Vorkommen
Dentin kommt stammesgeschichtlich bereits in den Schuppen und Zähnen von Knorpelfischen vor (Ganoidschuppe, Kosmoidschuppe bzw. Placoidschuppe)[4] und wurde dort bereits im 19. Jahrhundert wissenschaftlich beschrieben.[5] Es kann von den meisten Wirbeltieren gebildet werden, welche Knorpelfische als Vorfahren hatten. Obgleich rezente Vögel und auch ausgestorbene seit etwa 60 Millionen Jahren keine Zähne tragen, konnte auch bei ihnen das Gen Dentin-Matrix-Protein 1 (DMP1) nachgewiesen werden.[6]
Bedeutung für die Paläontologie
Aufgrund der Beständigkeit von Dentin zählen Zähne zu den dauerhaftesten Relikten von Wirbeltieren und erlauben aufgrund ihres guten Erhaltungszustandes oft deren paläontologische Identifizierung. Die stammesgeschichtliche Betrachtung der Zahnentwicklung erlaubt meist Einblick in Änderungen des Nahrungsverhaltens.[7][8] Durch Analyse von Gebrauchsspuren an Zahnfunden von Vorfahren des Menschen sind Rückschlüsse auf manche Lebensgewohnheiten wie bevorzugte Nahrung und Werkzeuggebrauch möglich.[9]
Weblinks
Einzelnachweise
- Brian R. Lawn, James J-W. Lee, and Herzl Chai: Teeth: among nature's most durable biocomposites. In: Annual Review of Materials Research. Band 40, 2010, S. 55–75 (englisch).
- William T. Butler, Helena H. Ritchie, and A. L. J. J. Bronckers: Extracellular matrix proteins of dentine. In: Dental enamel. Band 1996, 1997, S. 107 (englisch).
- W. T. Butler, et al.: Nonocollagenous proteins of dentin. Isolation and partial characterization of rat dentin proteins and proteoglycans using a three-step preparative method. In: Collagen and related research. Band 1, Nr. 2, 1981, S. 187 (englisch).
- H. Kawasaki, et al.: Chemical nature of proteins in the placoid scale of the blue shark, Prionace glauca L. In: Archives of Oral Biology. Band 25, Nr. 5, 1980, S. 313–320, doi:10.1016/0003-9969(80)90040-0 (englisch).
- Carl Gegenbaur: Elements of comparative anatomy. Macmillan and Co., 1878 (englisch).
- YiPing Chen, et al.: Conservation of early odontogenic signaling pathways in aves. In: Proceedings of the National Academy of Sciences. Band 97, Nr. 18, 2000, S. 10044–10049, doi:10.1073/pnas.160245097 (englisch).
- Julia Fritz, Ellen Kienzle, Jürgen Hummel, Oliver Wings, W. Jürgen Streich, Marcus Clauss: Gizzard vs. teeth, it's a tie: food-processing efficiency in herbivorous birds and mammals and implications for dinosaur feeding strategies. In: Paleobiology. 37, 2011, S. 577–586, doi:10.1666/10031.1.
- Terry Harrison: A new species of Micropithecus from the middle Miocene of Kenya. In: Journal of Human Evolution. Band 18, Nr. 6, 1989, S. 537–557, doi:10.1016/0047-2484(89)90017-1 (englisch).
- Konstanze Weltersbach: Homo neanderthalensis und Urmensch: Rekonstruktionen und Lebensbilder. In: Verhandlungen zur Geschichte und Theorie der Biologie. Band 13, 2007, S. 55–69 (Online [PDF]).