Ammoniten
Die Ammoniten (Ammonoidea) sind eine ausgestorbene Teilgruppe der Kopffüßer. Dieses Taxon war mit über 1500 bekannten Gattungen sehr formenreich. Die Zahl der Arten dürfte bei etwa 30.000 bis 40.000 gelegen haben. Die Größe der Schale ausgewachsener Tiere liegt meist im Bereich von 1 bis 30 cm. Eine berühmte Ausnahme bildet Parapuzosia seppenradensis – mit ca. 1,80 m Schalendurchmesser ist dies die größte bekannte Art. Ammoniten stellen seit ihrem ersten Auftreten im Unterdevon bis zu ihrem Aussterben am Ende der Kreide (Kreide-Paläogen-Grenze) über einen Zeitraum von etwa 350 Millionen Jahren eine große Zahl der Leitfossilien; zum Teil erfolgt die zeitliche Abgrenzung mariner Sedimente ausschließlich anhand von Ammoniten. Sie sind für die Geologie und die Paläontologie daher von großer Bedeutung. Wegen ihrer Vielfalt und Häufigkeit sind sie auch bei vielen Fossiliensammlern beliebt und entsprechend häufig im Fossilienhandel zu finden.
| Ammoniten | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Historische Darstellung lebender Ammonitentiere von Heinrich Harder. Als überholt gilt die Rekonstruktion der Arme als Cirren und die Deutung der Aptychen als Hutkappe. | ||||||||||||
| Zeitliches Auftreten | ||||||||||||
| Emsium (Unterdevon) bis Maastrichtium (Oberkreide) | ||||||||||||
| 407,6 bis 66 Mio. Jahre | ||||||||||||
| Fundorte | ||||||||||||
| ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Ammonoidea | ||||||||||||
| Zittel, 1884 | ||||||||||||
| ||||||||||||
Namensherkunft

Das Taxon Ammonoidea wurde 1884 von Karl Alfred von Zittel (1839–1904) in seinem Handbuch zur Paläontologie zum ersten Mal erwähnt.[1] Die Bezeichnung stammt aus der Antike, Plinius der Ältere bezeichnete Versteinerungen als „Ammonis cornua“ (Ammonshörner). Amon oder Ammon war bei den Griechen und Römern die Bezeichnung für den altägyptischen Sonnengott Amun-Re, den sie als Zeus- bzw. Jupiter-Ammon mit ihrem Götterkönig gleichsetzten. Dieser Gott wurde in seiner ägyptischen Urversion häufig als Widder mit entsprechenden Hörnern, und in der greco-romanischen Version als Mensch mit Widderhörnern dargestellt. Die Form vieler Ammonitenarten und deren äußere Skulptur, insbesondere die Rippen, erinnern an die gewundenen Hörner von männlichen Schafen. Es wird jedoch vermutet, dass Plinius der Ältere eigentlich keine Ammoniten, sondern fossile Schnecken der Gattung Natica als Ammonshörner beschrieben hat.[2] Der Bestandteil -ceras bzw. -ceratidae vieler wissenschaftlicher Namen von Ammonitengattungen bzw. -familien leitet sich vom griechischen Wort κέρας für „Horn“ ab, und nimmt damit in ähnlicher Weise Bezug auf die Ähnlichkeit der Fossilien mit den Kopfanhängen von Huftieren.
Anatomie
Schale
Die Grundform des Gehäuses von Ammoniten ist eine sich mit zunehmender Entfernung von der Öffnung (Apertur) verjüngende Röhre, die nach Art einer logarithmischen Spirale aufgerollt ist. Diese Grundform wird als planspiral bezeichnet. Weil ein entrolltes Gehäuse die Form eines Spitzkegels hätte, lautet die Lagebezeichnung für Körperteile, die zum Anfang der Spirale, dem Nabel, hin gelegen sind, adapikal (von lat. Apex ‚Spitze‘). Für Körperteile, die zum Ende der Spirale, zur Gehäusemündung (Apertur) hin gelegen sind, lautet sie adoral (von lat. oris ‚Mund‘) oder adapertural. Durch die spiralartige Windung umgreift die „innere“ (dorsale) Partie der Gehäuseröhre die „äußere“ (ventrale) Partie der nächstinneren Windung mehr (involutes Gehäuse) oder weniger (evolutes Gehäuse) stark. Vermutlich bedingt durch starke Meeresspiegelanstiege (Transgression) entstanden in der Obertrias, im Mitteljura und besonders häufig in der Kreidezeit „abnorm“ und zum Teil in alle Raumrichtungen entrollte Gehäuse.[3] Solche Formen werden auch als aberrante oder heteromorphe Ammoniten bezeichnet. Einer der bekanntesten Vertreter dieser Formen ist Nipponites aus der Oberkreide Japans. Seine Gehäuseröhre besteht aus in sich verschlungenen U-förmigen Abschnitten und zählt zu den absoluten Raritäten. Ein weiteres Beispiel ist Diplomoceras, dessen Gehäuse wie eine Büroklammer geformt war.
Das Gehäuse aller Ammoniten ist in zwei Bereiche unterteilt: die adorale Wohnkammer und den adapikalen, gekammerten Auftriebskörper (Phragmokon). In der Wohnkammer saß der größte Teil des Weichkörpers.

Das Material, aus dem ein Ammonitengehäuse größtenteils besteht, ist Calciumcarbonat in der natürlichen Modifikation Aragonit. Die Gehäusewandung ist, wie bei fast allen Molluskenvertretern (Muscheln, Schnecken usw.) aus mehreren Schichten aufgebaut. Sie wird vom äußeren Mantelrand in einer speziellen Mantelfalte durch eine organische Schicht, das Periostracum, vorgeformt. Das Periostracum fungiert im weiteren Schalenbildungsprozess als Matrize, das heißt alle Ornamente wie Rippen oder Knoten sind bereits vorhanden. Im nächsten Schritt wird das Periostracum von einer etwa 5 µm dünnen mineralischen Schicht, dem Außenostrakum (äußere Prismenschicht) unterlagert. Die Anordnung der stängeligen Aragonitkristalle ist zum Teil senkrecht zur Gehäusewandung, zum Teil radialstrahlig in halbkugeligen Sektoren (Sphärolithsektoren).


In der zweiten mineralischen Lage, der Perlmuttschicht, werden mikroskopisch kleine sechseckige Aragonitplättchen übereinander gestapelt. Durch die geringe Mächtigkeit der einzelnen Plättchen, die nur einen Bruchteil eines Mikrometers beträgt und die damit im Bereich der Wellenlänge des Lichtes liegt, wird auftreffendes Licht in seine Spektralfarben zerlegt, bevor es reflektiert wird. Dies erzeugt das typische bunte Schillern des Perlmutts. Die Perlmuttschicht kann ein Vielfaches der Mächtigkeit des Außenostrakums erreichen. Dass die Aragonitplättchen ursprünglich in ein dichtes Netz aus organischem Material (Matrix) eingebettet waren, verlieh der Schale zusätzlich eine hohe Elastizität.
Nach innen folgt die dritte mineralische Schalenschicht, das Innenostrakum (innere Prismenschicht). Diese zuletzt mineralisierte Schalenlage wird von mündungsferneren Teilen des Mantels abgeschieden. Bei planspiralen Ammoniten ist sie die einzige der drei Lagen der Gehäusewandung, die auch dorsal ausgebildet wird. Außenostrakum und Perlmuttschicht werden bei solchen Formen ausschließlich ventral und lateral sezerniert. Aufbau und Funktion der inneren Prismenschicht ist zum Teil recht unterschiedlich und dient unter anderem der Anheftung von Muskulatur.[3]
Die den Phragmokon unterteilenden Kammerscheidewände (Septen) wurden vom adapikalen Teil des Mantelgewebes abgeschieden. Dieser Mineralisationsprozess ging vermutlich recht zügig vonstatten und erfolgte gleichzeitig auf der gesamten Septenoberfläche. Das lässt sich aus dem Fehlen von Anwachsstreifen schließen. Vermutlich wurden die Septen ähnlich wie die Schale durch eine organische Lage vorgeformt und anschließend vollständig perlmuttrig mineralisiert. Die Ansatzlinien der Kammerscheidewände an der Innenseite der Gehäuseröhre liefern ein wichtiges Merkmal für die Systematik der Ammoniten.[4] Diese Kontaktnähte, auch Suturen genannt, sind auf Steinkernen (natürlichen Innenausgüssen von Schalen) als Lobenlinien erkennbar, deren Ausbildung jeweils typisch für verschiedene Ammonitengruppen ist.
Steinkerne sind die übliche Erhaltungsform bei Ammonitengehäusen, weil Aragonit relativ leicht löslich ist. Daher wächst mit dem geologischen Alter einer im Sediment eingebetteten aragonitischen Molluskenschale die Wahrscheinlichkeit, dass sie durch diagenetische Prozesse zerstört wird. Nur unter sehr günstigen Umständen können aragonitische Schalen über mehrere 100 Millionen Jahre erhalten bleiben. Das entsprechende Material wird Ammolit genannt.
Der Phragmokon der Ammoniten erfüllte ähnlich wie beim rezenten Nautilus eine Gewichtsausgleich-Funktion. Die neugebildeten Kammern waren zunächst mit Flüssigkeit gefüllt. Sie wurden mittels organischer Innenauskleidung (Pellicula), die wie ein Löschblatt funktionierte, und dem schlauchartigen Mantelgewebe (Sipho), das alle Kammern durchzog, leer gepumpt.[5][6] Durch ein Salzionen-Konzentrationsgefälle zwischen der Kammerflüssigkeit, mit nahezu Süßwasserzusammensetzung, und dem Blut des Siphos wurde ein osmotischer Druck aufgebaut. Dieser aktiv vom Organismus aufgebaute Druck führte dazu, dass die Kammerflüssigkeit zum Sipho geleitet und über diesen abgeführt wurde.[7] Durch den Abpumpprozess entstand in den voll mineralisierten Kammern ein Unterdruck, der wiederum zum Ausperlen eines stickstoffhaltigen Gases führte. Der dadurch gewonnene statische Auftrieb glich das Gewicht von Schale und Weichkörper aus. Der gesamte Prozess ist also eine wesentliche Voraussetzung, um den Ammoniten (aber auch Nautilus) das Wachstum (= Gewichtszunahme) zu ermöglichen. Der Sipho der Ammoniten liegt im Unterschied zu Nautilus, wo der Sipho zentral-mittig in der Gehäuseröhre liegt, immer randlich meist extern. Nur bei der oberdevonischen Gruppe der Clymenien liegt der Sipho intern. Der Vorgang der Kammerneubildung im Ganzen wurde 2008 ausführlich beschrieben.[8]
Somit ist der rezente Nautilus also in der Lage, das Gewicht von Schale und Weichkörper auszugleichen und in der Wassersäule zu schweben, ohne dafür zusätzliche Energie aufzuwenden. Da die Kammerscheidewände der Ammoniten deutlich komplexer als die uhrglasförmigen Kammern des Nautilus ausgebildet sind, wird vermutet, dass die Ammoniten ihr Gehäuse auch benutzten, um Tag/Nachtwanderungen vertikal in der Wassersäule durchzuführen. Dies könnte ähnlich wie bei einem U-Boot durch Fluten und Leerpumpen der Phragmokonkammern bewerkstelligt worden sein. Das Eigengewicht wurde so entsprechend modifiziert und ein energiesparendes Auf- und Abtauchen ermöglicht. Allerdings ist es nicht unumstritten, ob Ammoniten tatsächlich auf diese Art und Weise Tag/Nachtwanderungen vollzogen. Eine aktuelle Übersicht über alle zurzeit diskutierten Funktionen des gekammerten Phragmokons und der Septen geben Keupp (2000)[3] und Hoffmann (2010)[9].
Die Größen der Schalen variieren stark. Die größten Ammoniten mit einem Durchmesser von rund 1,80 Meter wurden bislang in der Westfälischen Bucht gefunden. Sie gehören zur Art Parapuzosia seppenradensis. Die ersten Exemplare wurden 1887 und 1895 in einem Steinbruch bei Seppenrade entdeckt. Die größte bekannte Ammonitenart wurde also nach ihrem Fundort benannt und 2008 zum ersten Fossil des Jahres im Rahmen der Tagung der deutschen Paläontologischen Gesellschaft gewählt. Das größte erhaltene Schalengehäuse kam beim U-Bahn-Bau in Dortmund ans Tageslicht. Die Funde stammen aus kreidezeitlichen Mergel-Schichten.
Weichteile
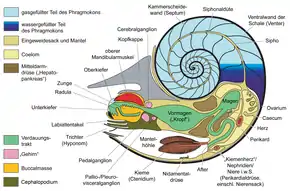

Über die Weichkörperorganisation der Ammoniten ist bisher nur wenig bekannt, da außer den Kieferapparaten und den Muskelansatzstellen kaum Weichteile überliefert sind. So bleibt zum Beispiel die Anzahl der Ammonitenarme und deren Funktion bis heute umstritten und könnte 10, 8 und 6 betragen haben. Eine schlüssige Rekonstruktion des Weichkörpers gibt es für die diskusförmige Gattung Aconeceras, die zum Teil häufig in den Unterkreide-Ablagerungen von NW Deutschland gefunden werden kann.[10] Der Weichkörper befand sich hauptsächlich in der Wohnkammer und war wie bei Nautilus mittels großer Muskeln an der Innenseite festgeheftet. Solche Muskelansatzstellen zum Beispiel der Rückziehmuskulatur die dafür sorgte, dass sich die Ammoniten bei Gefahr vollständig in ihre Wohnkammer zurückziehen konnten, wurden zum ersten Mal umfangreicher beschrieben.[11][12] Der Cephalopoden-Weichkörper entspricht dem Grundmuster der Mollusken und lässt sich in Kopf, Eingeweidesack und Mantel untergliedern. Im Kopfbereich befinden sich Sinnesorgane wie Augen, Fangarme und der Kieferapparat. Der Eingeweidesack enthält den Verdauungstrakt, das Herz und die Gonaden und wird vollständig vom Mantel umschlossen (siehe Skizze). Der Mantel bildete bei den Ammoniten vermutlich auch eine Mantelhöhle im ventralen, vorderen Wohnkammerbereich, wie sie bei Nautilus ausgebildet ist. In die Mantelhöhle ragen ein paar Kiemen für die Sauerstoffaufnahme aus dem Meerwasser. Zusätzlich kann Nautilus über einen zweilappigen Trichter Wasser in die Mantelhöhle einströmen und durch Zusammenziehen von Muskulatur das Wasser wieder herauspressen. Nach diesem Rückstoßprinzip bewegt sich der rezente Nautilus und vermutlich auch die ausgestorbenen Ammoniten durchs Wasser. Einen Tintenbeutel wie Sepia und Octopus besaßen die Ammoniten nicht. Am hinteren Abschnitt der Wohnkammer am Übergang zum Phragmokon bildet der Mantel eine schlauchartige Struktur, die bei den Ammoniten alle Kammern miteinander verbindet, der Sipho.
Arme
Alle rezenten Cephalopoden mit internem Gehäuse (Endocochleata) besitzen entweder acht (Vampyropoda) z. B. Octopus oder zehn (Decabrachia) z. B. Sepia, Spirula Arme. Nautilus mit seinem externen Gehäuse (Ektocochleata) besitzt hingegen zahlreiche ~90 Arme.[13] Die Arme von Octopus oder Sepia sind mit Saugnäpfen besetzt, die von Belemniten mit kleinen Haken (Onychiten) und Saugnäpfen.[14] Nautilus besitzt weder Haken noch Saugnäpfe, sondern zahlreiche Cirren, die ein klebriges Sekret absondern können. Hieraus ergibt sich für die Rekonstruktion der Ammonitenarme eine ganze Reihe an Möglichkeiten.[15] Am Wahrscheinlichsten scheint eine Armanzahl von zehn, acht oder sechs, da durch neuere Untersuchungen gezeigt werden konnte, dass auch Nautilus in der Embryonalanlage nur zehn Arme besitzt.[16] Die Erhöhung der Armzahl auf über etwa 90 erfolgte also sekundär innerhalb der Nautiliden-Entwicklungslinie. Zudem ist bekannt, dass Ammoniten durch verschiedene Merkmale (schmale Radula, kleines Juvenilgehäuse) den Coleoidea (Cephalopoden mit internem Gehäuse z. B. Belemniten, Sepien) entwicklungsgeschichtlich näher stehen als den Nautiliden, mit denen sie lediglich das externe Gehäuse als gemeinsames Merkmal teilen.[17] Da bisher Nachweise von Ammonitenarmen, auch von Fossillagerstätten mit exzellenter Weichteilerhaltung wie zum Beispiel der mitteljurassischen Lagerstätte Voulte-sur-Rhone, von der ein vollständig erhaltener Octopode (Proteroctopus ribeti) bekannt ist, fehlen, sind folgende Rückschlüsse möglich: a) die Arme waren fadenartig dünn oder b) sehr kurz. Ein paar Rekonstruktionsversuche zu Aussehen und Funktion der Ammonitenarme sind beschrieben.[18][19][20]
Radula, Kiefer und Nahrungsgewohnheiten

Ammoniten besaßen wie alle Cephalopoden und auch deren nächste Verwandte die Gastropoden eine sogenannte Buccalmasse. Diese kugelige, von kräftiger Muskulatur umfasste Struktur liegt direkt hinter der Mundöffnung und enthält bei rezenten Cephalopoden einen papageienschnabelartigen Kiefer, allerdings anders als bei Papageien, mit einem Unterkiefer, der größer ist als der Oberkiefer. Im Zentrum dieser Kapsel liegt die Raspelzunge oder Radula, mit deren Hilfe die Nahrung zerkleinert wird. Sie besteht bei Nautilus aus 13, bei Ammoniten und Coleoideen aus neun Elementen je Querreihe.[17] In einer speziellen Tasche werden zeitlebens kontinuierlich neue Zahnreihen gebildet, welche die abgenutzten Zähne ersetzen. Im Jahr 2011 veröffentlichte 3D-Rekonstruktionen eines oberkreidezeitlichen heteromorphen Ammoniten (Baculites) zeigten die fragile Struktur der Raspelzähne und deren Anpassung an die Ernährung von Zooplankton z. B. Schneckenlarven oder kleine Krebstiere.[21] Eine ähnliche Radula ist für die Unterkreide Gattung Aconeceras berichtet.[10] Es bleibt abzuwarten, ob weitere Untersuchungen ähnlich starke Anpassungen der Radula an die Ernährungsweise wie bei den Gastropoden zeigen.
Ähnlich wie bei heutigen Kopffüßern, bestanden die Kiefer der Ammoniten ursprünglich aus einem hornigen, wahrscheinlich chitinartigen Material, und sowohl Ober- als auch Unterkiefer besaßen eine hakenförmige Spitze (Rostrum). Solche Kiefer sind von Goniatiten[22] und Ceratiten[23] bekannt. Phylloceraten und Lytoceraten besaßen einen Unterkiefer, der dem des rezenten Nautilus ähnlich ist, indem dessen Rostrum durch Kalkeinlagerungen (Conchorhynch) verstärkt war. Dies wurde als konvergente Anpassung an eine aasfressende Lebensweise, wie sie von Nautilus geführt wird, interpretiert.[24] Vermutlich schwammen die Ammoniten auch mit ähnlichen Geschwindigkeiten wie Nautilus. Sie waren also trotz ihres komplizierter gebauten Gehäuses keine schnellen, räuberischen Formen wie etwa die Belemniten mit ihrem torpedoförmigen Körper. Einige Arten könnten dennoch räuberisch gelebt haben, indem sie an festsitzenden (sessilen) Wirbellosen wie Korallen, Bryozoen oder Seelilien fraßen.

Im jüngeren Unterjura (Lias) treten bei der Ammonitengruppe der Hildoceraten zum ersten Mal calcitisch(!) verkalkte zweiteilige („zweiklappige“) Unterkiefer mit stark reduziertem Rostrum auf, die sogenannten Aptychen. Nicht-verkalkende Unterkiefer mit und ohne Rostrum werden auch Anaptychen genannt, solche mit verkalktem Rostrum Rhynchaptychen. Mit der Reduktion des Rostrums, die zuerst bei Anaptychen im frühen Unterjura auftritt, geht vermutlich ein Verlust der ursprünglichen primären Funktion des Unterkiefers, dem Festhalten und Zerkleinern von Nahrung, einher. Stattdessen waren die aptychentragenden Ammoniten wahrscheinlich Planktonfresser.[25] Ferner dienten sowohl Aptychen als auch rostrenlose Anaptychen sekundär vermutlich als Deckel (Operculum) für die Gehäusemündung, analog zur Hutkappe das Nautilus. Zudem werden weitere sekundäre Funktionen diskutiert.[26] Aptychen und Anaptychen kommen bis zum Ende der Kreide parallel nebeneinander vor und dienen der Unterteilung der Ammoniten in aptychentragende (Aptychophora) und nicht-aptychentragende Formen.[27]
Rhyncholithen, die wegen ihrer Ähnlichkeit mit den Kiefern von Nautilus früher als Kieferteile von Ammoniten gedeutet wurden, stammen nach heutiger Auffassung sicher nicht von Ammoniten, sondern vermutlich von anderen Cephalopoden. Eine Zuordnung zu einzelnen Gruppen ist aber noch schwierig.
Weitere Weichteile (Tintenbeutel, Kiemen und Augen)
Nachweise von Tintenbeuteln bei Ammoniten sind nicht eindeutig. Höchstwahrscheinlich liegen Verwechslungen mit Magen und Ösophagus der Ammoniten vor. Kiemen sind von Ammoniten fossil nicht überliefert. Nautiliden haben vier Kiemen, alle anderen rezenten Kopffüßer und auch deren nächste Verwandte, die Schnecken, besitzen nur zwei Kiemen. Aufgrund der engeren Verwandtschaft der Ammoniten zu den Coleoideen, aufgrund der Ausbildung von Radula und Embryonalgehäuse, wird vermutet, dass Ammoniten ebenfalls zwei Kiemen besaßen. Da auch Schnecken nur zwei Kiemen besitzen, kann davon ausgegangen werden, dass erst innerhalb der Entwicklungsreihe der Nautiliden die Kiemenanzahl von ursprünglich zwei auf vier erhöht wurde, ganz entsprechend der Erhöhung der Armzahl. Augen sind fossil nicht überliefert. Dass Ammoniten jedoch Augen besessen haben müssen, scheint unstrittig. Die Augen von Nautilus funktionieren wie eine Camera obscura (Lochkamera) und besitzen keine Linse. Alle anderen modernen Cephalopoden besitzen verschiedene Formen von Linsenaugen.
Paläobiologie
Fortbewegung


Die Frage nach der Fortbewegung der Ammoniten ist am schwierigsten zu beantworten. Es kann hier mit Hilfe von Indizien über eine wahrscheinliche Lebensweise der Ammoniten spekuliert werden. Zunächst einmal soll erwähnt sein, dass es zwei grundsätzlich verschiedene Vorstellungen zur Lebensweise der Ammoniten gibt: a) benthonisch auf dem Meeresboden kriechend oder gar sessil und b) frei in der Wassersäule schwimmend.
Für eine benthonische Lebensweise sprechen geochemische Analysen.[28] Es wurden Schalen von Oberkreide-Ammoniten, Planktonorganismen und Benthosorganismen untersucht. Dabei stellte sich heraus, dass die Sauerstoffisotopen der Ammonitenschalen stark denen der Benthosorganismen ähnelten. Weitere Indizien für eine bodenbezogene Lebensweise könnte aus dem Bereich der Paläopathologie angeführt werden. So könnten Schalenverletzungen, die durch bodenbewohnende Krebse verursacht wurden, für eine benthonische Lebensweise der Ammoniten sprechen. Beide Argumente können als Hinweise für eine benthonische Lebensweise gedeutet werden, schließen aber eine demersiale, das heißt dicht über dem Meeresboden schwebende, Lebensweise nicht aus.
Für eine Lebensweise in der freien Wassersäule spricht das Fehlen jeglicher Spurenfossilien von Ammoniten. Die von Devon bis Oberkreide weltweit massenhaft vorkommenden Ammonitentiere müssten unzählige Spurenfossilien in den Ablagerungen jener Zeit hinterlassen haben. Bis heute ist jedoch keine einzige Spur bekannt, die eindeutig einem Ammoniten zugewiesen werden kann. Alle rezenten Cephalopoden mit einem gekammerten Gehäuse (Nautilus, Spirula) schwimmen frei in der Wassersäule, ebenso die bereits ausgestorbene Gruppe der Belemniten. Generell ist das gekammerte Gehäuse als Schlüsselinnovation der Cephalopoden zu verstehen, die ihnen erst den Übergang von der benthonischen zur schwimmenden Lebensweise ermöglichte. Ammoniten mit ihrem gekammerten Außengehäuse und der Wohnkammer entsprechen im Grundprinzip dem Nautilusgehäuse. Es lassen sich jedoch auch gravierende Unterschiede feststellen: Der Sipho liegt am Rand, und die Kammerscheidewände der Ammoniten sind teilweise extrem stark verfaltet. Diese Verkomplizierung des Gehäuses spricht nach Meinung vieler Forscher für eine Effizienzsteigerung des hydrostatischen Apparates (= Auftriebsorgan). Das heißt, Wasser kann schneller aus den neugebildeten Kammern abgepumpt und so schneller das Schwimmgleichgewicht erreicht werden. Möglicherweise konnte auch schneller Wasser zurückgeflutet werden, wie ein Vergleich von Schalenverletzungen bei Nautilus und Ammoniten zeigte.[29][30] Positiver Auftrieb zum Beispiel durch Schalenverlust könnte somit verringert und das Auftreiben an die Wasseroberfläche, gleichbedeutend mit dem Tod des Tieres, vermieden werden.[3][31] Kalkige Ablagerungen in den Kammern und Siphonen verschiedener fossiler Cephalopoden könnten sogar ein Hinweis darauf sein, dass der Auftrieb ständig größer als das Eigengewicht war.[29]
Die größere Wohnkammer der Ammoniten mit entsprechend großem Weichkörper wird oft angeführt, um die bodenbezogene Lebensweise der Ammoniten zu begründen. Da der Weichkörper jedoch eine relative Dichte von 1 g/cm³ besitzt, die also nahezu identisch mit der des umgebenden Meerwassers ist, wirkt sich die Größe des Weichkörpers kaum auf das spezifische Gewicht der Tiere im Wasser aus (im Toten Meer können auch Nichtschwimmer aufgrund des hohen Salzgehaltes und des dadurch verursachten Auftriebs schwimmen). Den weitaus wichtigsten Gewichtsfaktor bildet die aragonitische Schale mit einer Dichte von ca. 2,5–2,6 g/cm³.
Weitere Indizien für eine schwimmende Lebensweise der Ammoniten kommen von den verschiedensten Fundstellen. Ammoniten werden auch in Sedimenten (z. B. Schwarzschiefer) gefunden, die unter sauerstoffarmen bis -freien Bedingungen (dys- bis anoxisch) abgelagert wurden (z. B. Fossillagerstätte Holzmaden). Wären Ammoniten bodenbezogen lebende Organismen, dürften sie dort nicht vorkommen. Sie lebten daher vermutlich in der freien Wassersäule oberhalb der sauerstoffarmen Zone und sanken nach ihrem Tod zum Meeresboden oder wurden aus anderen Meeresbereichen dorthin verdriftet. Die lebensfeindlichen sauerstoffarmen Bedingungen verhinderten nach der Ablagerung eine weitere Zerstörung oder Bewuchs der Schalen durch andere Organismen. Auch scheint die Ernährungsweise für eine entweder planktonische oder nektonische Lebensweise in der freien Wassersäule zu sprechen. So fand sich marines Zooplankton (Schneckenlarven und kleine Krebstiere) im Kieferapparat des Oberkreide-Ammoniten Baculites.[21] Da Baculites mit seinen zweiteiligen Aptychus zu den Aptychophora gehört, kann die Ernährung mit Zooplankton, die eine schwimmende Lebensweise erforderlich macht, evtl. für alle Aptychen-tragenden Ammoniten angenommen werden.[21][25]
Auch die schnelle Entfaltung und globale Verbreitung der Ammoniten nach den Massenaussterbe-Ereignissen spricht für eine Lebensweise sowohl in der freien Wassersäule küstennah als auch küstenfern, da insofern eine schnellere Verbreitung gegenüber bodenbezogen lebenden Organismen möglich war.[15]
Geschlechtsdimorphismus: Mikrokonche und Makrokonche

Unter den Begriffen Mikro- bzw. Makrokonch versteht man zunächst einmal lediglich kleine und große Ammonitengehäuse mit ähnlich gestalteten Innenwindungen. Bei den detailliert-morphologischen Studien an Ammonitengehäusen fiel auf, dass einige Formen zunächst identische Windungen mit identischen Ornamenten anlegten. Ab einem bestimmten Schalendurchmesser unterschieden sich dann aber die Windungen und die Ornamentierung. Bei weiterer langjähriger Sammeltätigkeit stellte sich heraus, dass diese Formen immer zeitgleich und an den gleichen Fundorten zu finden waren. Lediglich die Verhältnismäßigkeit der Fundhäufigkeit war unterschiedlich. Oft wurden diese Ammoniten erst als unterschiedliche Arten oder sogar Gattungen beschrieben. Waren einmal die Ähnlichkeiten erkannt, drängte sich schnell der Verdacht auf, es könnte sich hierbei um sexualdimorphe Paare handeln. Sexualdimorph bedeutet, die Geschlechter (männlich oder weiblich) unterscheiden sich morphologisch (vgl. Menschen). Um dieses zu belegen, müssen ausgewachsene Ammoniten der gleichen Art verglichen werden. Dies geschieht über die Bildung einer morphologischen Reihe. Allgemeinhin nimmt man an, dass es sich bei den größeren Makrokonchen um die Weibchen und bei den kleineren Mikrokonchen um die Männchen, sogenannte Zwergmännchen handelt. Beweisen lässt sich diese Annahme allerdings nicht, da Weichteile von Ammoniten nicht überliefert sind. Allerdings tritt bei rezenten Cephalopoden häufig der Fall auf, dass die Weibchen größer als ihre Männchen werden. Die frühen Ähnlichkeiten und späteren Unterschiede im Gehäusebau könnten Folge der sexuellen Reife sein. Um auszuschließen, dass ausgewachsene mit nicht ausgewachsenen Exemplaren der gleichen Art verglichen werden, ist die Beachtung der Lobenlinie hinreichend. Das Erreichen des Adultstadiums und damit der maximalen Gehäusegröße erkennt man bei Ammoniten wie auch beim rezenten Nautilus an der Drängung der zuletzt gebildeten zwei bis drei Septen. Diesen Effekt hat Hölder als Lobendrängung beschrieben.[32] Auch die Mündungsapophysen (Ohren) der Mikrokonche z. B. Ebrayiceras werden als geschlechtsbedingte Modifikationen der Gehäusemündung interpretiert.[18] Ein etwas komplizierter gelagerter Fall von Sexualdimorphismus wurde ebenfalls 2011 beschrieben.[33] Einen umfassenden Überblick zu allen Aspekten des Sexualdimorphismus bei Ammoniten gibt Callomon (1981),[34] der 1963[35] unabhängig von Henryk Makowski (1962)[36] die grundlegenden Arbeiten dazu veröffentlichte.
Lebenserwartung
Neueste Untersuchungen des heteromorphen Ammoniten Diplomoceras deuten darauf hin, dass das Tier ein Alter von 200 Jahren erreicht haben könnte. Bei den Fossilien der Schale wurden wiederkehrende Muster im Verhältnis von Sauerstoff- und Kohlenstoffisotopen festgestellt. Die Forscher schlussfolgerten daraus, dass diesem Muster die Jahreszyklen und der regelmäßige Methanfluss des Meeresbodens zugrunde liegen könnten. Die Anzahl der Musterwechsel ist außerdem identisch mit der der Rippungen des Schalenbogens, die sich bei modernen Nautiloiden im Lauf eines Jahres bilden.[37]
Verwandtschaft und Stammesgeschichte
 Die Gattung Cheiloceras (Devon) als Vertreter der Paläoammonoidea (Goniatiten), die von Devon bis Perm verbreitet waren
Die Gattung Cheiloceras (Devon) als Vertreter der Paläoammonoidea (Goniatiten), die von Devon bis Perm verbreitet waren Die Gattung Ceratites (Trias) als Vertreter der Mesoammonoidea (Ceratiten), die hauptsächlich in der Trias verbreitet waren
Die Gattung Ceratites (Trias) als Vertreter der Mesoammonoidea (Ceratiten), die hauptsächlich in der Trias verbreitet waren Die Gattung Hildoceras (Jura) als Vertreter der Neoammonoidea (Ammoniten in engeren Sinne), die von Jura bis Kreide verbreitet waren
Die Gattung Hildoceras (Jura) als Vertreter der Neoammonoidea (Ammoniten in engeren Sinne), die von Jura bis Kreide verbreitet waren
Die Ammoniten leiteten sich im Unterdevon (Emsium) von den Bactriten, einer Gruppe Cephalopoden, die ihren Sipho vom Zentrum der Gehäuseröhre an den Rand verlagerten, ab. Infolge der Siphoverlagerung ergab sich auch eine erste Einfaltung der Lobenlinie. Die Bactriten wiederum lassen sich nahtlos von orthoceriden Nautiliden mit langen gradgestreckten Gehäusen – ebenfalls im Unterdevon (Pragium) – ableiten.[38] Durch die beginnende Krümmung und zunehmende planspirale Einrollung des Gehäuses leiten die Bactriten zu den Ammoniten über.[39] Eine genaue Definition für die Ammoniten ist wegen des graduellen morphologischen Übergangs zwischen Bactriten und Ammoniten zurzeit noch schwierig. Bemerkenswert ist jedoch, dass die Ammoniten bereits kurze Zeit nach ihrem ersten Auftreten global und massenhaft verbreitet waren, was im Zusammenhang mit weiteren Veränderungen in den damaligen Meeren als die devonische Nektonrevolution beschrieben wurde.[40] Vermutlich lassen sich auch die Coleoidea (Cephalopoden mit Innenskelett), zu denen auch die ausgestorbene Gruppe der Belemniten gehört, ableiten. Generell werden die Großgruppen innerhalb der Ammoniten anhand der Ausgestaltung ihrer Lobenlinie unterschieden.[41]
Lange Zeit wurde zur Rekonstruktion der Lebensweise oder des Weichkörpers der rezente Nautilus herangezogen. Wie aber gezeigt werden konnte, sind die Ammoniten eher mit den Coleoideen verwandt. Neben den bekannteren Vertretern dieser Gruppe (Octopus und Sepia) ist besonders die seltene Tiefseetintenart Spirula spirula für die Paläontologie in letzter Zeit immer stärker in den Focus rückt. Diese Form besitzt nämlich ein vollständiges gekammertes Gehäuse mit Siphon, das in den Weichkörper eingelagert ist. Wegen der engeren Verwandtschaft zwischen Ammoniten und Spirula wird letzterer als Modellorganismus für zukünftige Rekonstruktionsversuche verstärkt herangezogen.[42]
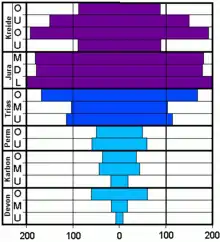
Vereinfacht lassen sich die Ammoniten in Paläo- (Devon-Perm), Meso- (Trias) und Neoammoniten (Jura-Kreide) unterteilen. Die vereinfachte und nicht ganz korrekte, dafür aber in Gelände leicht anzuwendende Methode basiert auf der Ausgestaltung der Lobenlinien späterer ontogenetischer Stadien und nicht der Primärsutur (was eigentlich die korrekte Herangehensweise wäre). Bei fast allen Paläoammoniten (Goniatiten, Anarcestiden, Clymenien) ist die Lobenlinie noch recht einfach mit wenigen Sätteln (meist breit-gerundet) und Loben (meist spitz) ausgebildet. Bei den Mesoammoniten (Ceratiten) sind die Sättel einfach und die Loben zeigen eine beginnende Zerschlitzung des Lobengrundes. Die Neoammoniten (Phylloceraten, Ammoniten inklusive Lytoceraten und Ancyloceraten = Heteromorphe) entwickeln die kompliziertesten Lobenlinien mit zerschlitzten Sätteln und Loben. Die Zeichnungen wurden in die vermutete Lebendstellung der Ammonitentiere gedreht. Neben dieser Tendenz finden sich eine Unzahl an Variationen der Proportion der Schale, von „Verzierungen“ wie Rippen, Spaltrippen, Wülste, Rillen, Dornen oder Knoten, z. T. als Folgen von Konvergenz. Die drei Gruppen sind jeweils durch ein Massenaussterben getrennt, wobei nur wenige Formen überlebten. Von diesen ging anschließend eine explosionsartige Entfaltung (Radiation) neuer Formen aus. Die Ammoniten, die ein Massenaussterben überlebt hatten, wiesen vereinfachte Lobenlinien auf, die sich im Zuge der Stammesgeschichte jedes Mal hin zu komplizierteren Lobenlinien entwickelten. Dieser phylogenetische Trend lässt sich auch während der Ontogenie sehr gut beobachten. Leider starben die Ammoniten an der Kreide/Paläogen-Grenze nachkommenlos aus. Möglicherweise überlebten einige wenige Ammoniten dieses Aussterbe-Ereignis, dem neben vielen Planktonorganismen auch die Dinosaurier zum Opfer fielen, noch um ein paar Monate oder Jahre. Ein Effekt der unter dem Begriff „dead clade walking“ bekannt ist. Gab es in der höchsten Oberkreide noch ca. 30 Ammonitenarten, so sind kurz oberhalb der Iridium-Anomalie, die global nachgewiesen wurde und einen Meteoriten-Impakt wahrscheinlich macht, alle Ammoniten verschwunden.[19]
Typostrophen-Theorie
Ammoniten waren das Musterbeispiel der überholten Typostrophenlehre, wie sie Otto Heinrich Schindewolf vertrat.[43][44] Eine Typostrophe beginnt mit der Entstehung einer neuen Form (Typogenese), die dann im Laufe der Zeit im Rahmen ihrer Entwicklungspotenzen ausgestaltet wird (Typostase). Schließlich gelangt die Form an die Grenzen ihrer Möglichkeiten und stirbt aus (Typolyse). Die Evolution der Ammoniten folgt scheinbar diesem Schema. Beispielsweise ist in dieser Deutung das Auftreten von heteromorphen Ammonitenarten, die keine planspiralen Gehäuse besitzen, in der Oberkreide eine Typolyse, d. h. eine stammesgeschichtliche Degeneration. Spätere Funde belegen das Auftreten solcher Formen auch in anderen Epochen. Die unhaltbar gewordene antidarwinistische „Typostrophen-Theorie“ wurde z. B. durch Dieter Korn widerlegt.[45]
Aussterben
Vor dem endgültigen Aussterben der Ammoniten an der Kreide-Tertiär-Grenze bzw. Kreide/Paläogen-Grenze überlebten die Ammoniten drei der fünf größten Massenaussterbe-Ereignisse der Erdgeschichte. Bereits im Oberdevon (Kellwasser-Event) gab es einen starken Einschnitt in der Diversität der Ammoniten. Einen zweiten deutlich stärkeren Einschnitt gab es an der Perm-Trias-Grenze, als es zum größten Massenaussterben der Erdgeschichte kam. Hier starben nach Schätzungen etwa 75–90 % aller Tierarten aus. Das dritte Massenaussterben der Ammoniten liegt an der Trias-Jura-Grenze. Bei den ersten drei Ereignissen haben jeweils nur wenige Ammonitenarten überlebt. Von diesen ging jedoch kurz danach eine enorme Radiation aus, welche oft die vorherige Formenvielfalt übertraf. Die Ursachen für diese Massenaussterben sind umstritten; klimatische und astronomische Ursachen (Meteoriteneinschläge, KT-Impakt) werden ebenso diskutiert wie u. a. aufgrund von Kontinentaldrift veränderte Meeresströmungen mit tiefgreifendem Wechsel im Nahrungsangebot, der Temperaturverteilung im Meer und der Wassertiefe – also rapiden Änderungen der paläoökologischen Bedingungen. Nach den Darlegungen von Kruta[21] und Tanabe[25] starben die Ammoniten auch infolge ihrer planktonischen Lebensphase aus. Demzufolge waren die frischgeschlüpften Ammoniten – mit einem Gehäusedurchmesser von etwa 0,5–2 mm – möglicherweise selbst Teil des Zooplanktons, aber ihrerseits auf Plankton als Nahrung angewiesen. Generell ist das Kreide-Paläogen-Massenaussterben auch als Planktonkrise, von der vor allem das kalkige Nanoplankton betroffen war, bekannt. Es ist wahrscheinlich, dass im Zuge der Planktonkrise die Jungtiere ohne ihre Nahrungsgrundlage einfach verhungerten. Aber auch die Adulttiere mit modifizierten Unterkiefern (Aptychen) waren auf Plankton als Nahrung angewiesen und somit direkt von der Planktonkrise betroffen.
Systematik
Die Bezeichnung Ammonoidea Zittel 1884 umfasst neben den eigentlichen Ammoniten des Jura und der Kreide eine Reihe weiterer Formen, die klassischerweise als Ordnungen geführt werden (Gattungslisten unvollständig). Die Brauchbarkeit dieses taxonomischen Konzepts der Hierarchien wird in der Rezentbiologie spätestens seit 1999 infrage gestellt und immer seltener genutzt.[46] Stattdessen ist nur noch von Taxa (Sing. Taxon) die Rede, welche sich durch Apomorphien (einmalig neu erworbene Merkmale) unterscheiden müssen. Die Unterteilung in Ammoniten-Großgruppen erfolgt heutzutage primär nach der Ausgestaltung der Primärsutur. Die Primärsutur ist die Lobenlinie des ersten echten in Perlmutt angelegten Septums (Kammerscheidewand). Man unterscheidet in trilobate- (Paläoammonoidea; Devon-Perm), quadrilobate- (Mesoammonoidea Oberperm-Trias; sekundär vereinfacht bei heteromorphen Ammoniten der Kreidezeit), quinquelobate- (Neoammonoidea, die Ammoniten im engeren Sinne; Jura-Kreide) und sixlobate (Tetragoniten eine Teilgruppe der Lytoceraten aus der Oberkreide) Primärsuturen.[41] Einen aktuellen Überblick über die phylogenetischen Zusammenhänge alle größeren Ammonitentaxa oberhalb des Gattungsniveaus geben Rouget et al.[47] Für einen detaillierteren Einblick in die Ammonitensystematik werden folgende Standardwerke empfohlen:[48] alle Ammonoideen von Devon bis Kreide leider stark veraltet,[49] enthält nur die Kreideammoniten sowie Teile der Reihe Fossilium Catalogus I: Animalia.
Ammonoidea
- Ordnung Agoniatitida (Gattungen Agoniatites, Anarcestes, Maenioceras, Prolobites, Manticoceras, Beloceras)
- Ordnung Clymeniida ? frühe Goniatiten (Gattungen Acanthoclymenia, Gonioclymenia, Hexaclymenia, Wocklumeria, Platyclymenia, Clymenia, Parawocklumeria)
- Ordnung Goniatitida ? Echte Goniatiten (Gattungen Tornoceras, Cheiloceras, Sporadoceras, Gattendorfia, Ammonellipsites, Goniatites, Gastrioceras, Schistoceras, Perrinites, Cyclolobus)
- Ordnung Prolecanitida ? frühe Ceratiten (Gattungen Prolecanites, Medlicottia, Sageceras)
- Ordnung Ceratida ? Echte Ceratiten (Gattungen Xenodiscus, Otoceras, Beneckeia, Ceratites, Choristoceras, Tropites, Cladiscites, Ptychides, Pinacoceras)
- Neoammonoidea
- Ordnung Phylloceratida (Gattungen Phylloceras, Geyeroceras, Paradasyceras, Leiophyllites)
- "Ordnung" Lytoceratida (Gattungen Lytoceras, Ectocentrites, Pleuroacanthites u. a.)
- "Ordnung" Ancyloceratida (Gattungen Ancyloceras, Macroscaphites, Diplomoceras, Crioceratites, Baculites, Turrilites, Bostrychceras, Scaphites, Hoploscaphites, Douvilleiceiras, Parahoplites, Deshayesites)
- Ordnung Ammonitida Echte Ammoniten (Mehrere Überfamilien)
- Psilocerataceae (Gattungen Psiloceras, Caloceras, Alsatites, Storthoceras, Schlotheimia, Arietites, Echioceras, Oxynoticeras)
- Eoderocerataceae? ?Ringripper? (Gattungen Eoderoceras, Androgynoceras, Amaltheus, Pleuroceras, Dactylioceras)
- Hildocerataceae? ?Sichelripper? (Gattungen Harpoceras, Hildoceras, Leioceras, Ludwigia, Sonninia, Oppelia)
- Stephanocerataceae (Gattungen Stephanoceras, Macrocephalites, Kosmoceras, Quenstedtoceras)
- Perisphinctaceae (Gattungen Perisphinctes, Ataxioceras, Rasenia, Gravesia, Aulacostaphanus, Virgatites, Aspidoceras, Polyptychides)
- Weitere Gattungen (ehemals Überfamilien Desmocerataceae und Hoplitaceae): Callizoniceras, Pachydiscus, Leymeriella, Schloenbachia, Tissotia, Flickia.
 Discoscaphites iris aus der Oberkreide
Discoscaphites iris aus der Oberkreide Perisphinctes im Berliner Museum für Naturkunde
Perisphinctes im Berliner Museum für Naturkunde Ein Exemplar von Hoploscaphites aus Nordamerika. Die Gehäuseform weicht von der einfachen Spirale ab
Ein Exemplar von Hoploscaphites aus Nordamerika. Die Gehäuseform weicht von der einfachen Spirale ab
Schmuck und Dekoration aus Ammoniten
.jpg.webp)
Aus fossilen Überresten von Ammoniten kann sich der als Ammolit bezeichnete opaleszierende Edelstein bilden, der im Schmuckhandel auch unter den Namen Calcentin oder Korit angeboten wird.
Des Weiteren gibt es einige wenige Vorkommen von opalisierenden Muschelmarmoren, die aus Schalenresten von Ammoniten bestehen, wie beispielsweise den Bleiberger Muschelmarmor in Kärnten und weitere Vorkommen in Hall in Tirol in Österreich, die zu Broschen, Ringen, Dosen und als Tischeinlagerungen verarbeitet wurden. Weitere Muschelmarmore kommen bei Yelatma an der Oka im europäischen Russland, bei Folkestone in Südengland, bei Bakulites von Wyoming und bei Lethbridge in Alberta, Kanada vor.
Vollständig pyritisierte Ammoniten werden im Volksmund als Goldschnecken bezeichnet und, wie auch geschnittene und polierte Exemplare, in Schmuckstücke (z. B. Amulette) eingearbeitet.
Ammoniten inspirieren gelegentlich auch Künstler zu Ammonitenobjekten. So gestalten Goldschmiede Ohrringe und Anhänger in Ammonitenform, genauso wie Bildhauer Gartenobjekte gestalten, die als Ursprung einen Ammoniten als Vorbild haben.
Verwendung als Wappentiere
Gehäuse bzw. Schalen von Ammoniten sind ein eher seltenes heraldisches Element. Ihre Verwendung in Wappen von Städten, Gemeinden und Gemeindeteilen deutet oft auf dortige Fundstätten und damit auf die lokale Geologie hin.
- Deutschsprachiger Raum

 Cremlingen, nördliches Harzvorland, Niedersachsen
Cremlingen, nördliches Harzvorland, Niedersachsen Erkerode, nördliches Harzvorland, Niedersachsen
Erkerode, nördliches Harzvorland, Niedersachsen Evessen, nördliches Harzvorland, Niedersachsen
Evessen, nördliches Harzvorland, Niedersachsen Destedt, nördliches Harzvorland, Niedersachsen
Destedt, nördliches Harzvorland, Niedersachsen Hemkenrode, nördliches Harzvorland, Niedersachsen
Hemkenrode, nördliches Harzvorland, Niedersachsen Heersum, Innerstebergland, Niedersachsen
Heersum, Innerstebergland, Niedersachsen


 Hetzles, Fränkische Alb, Bayern
Hetzles, Fränkische Alb, Bayern Schernfeld, Fränkische Alb, Bayern
Schernfeld, Fränkische Alb, Bayern
- Übriges Europa


Literatur
- Helmut Keupp: Ammoniten. Paläobiologische Erfolgsspiralen. Jan Thorbecke, Stuttgart 2000, ISBN 3-7995-9086-2. (umfassendes Nachschlagewerk).
- Ulrich Lehmann: Ammoniten. Ihr Leben und ihre Umwelt. 2. Auflage. Enke, Stuttgart 1987, ISBN 3-432-88532-6. (gute Einführung, ohne systematischen Teil).
- Arno Hermann Müller: Lehrbuch der Paläozoologie. Band 2: Invertebraten. Teil 2: Mollusca 2 – Arthropoda 1. 4., neu bearbeitete und erweiterte Auflage. Gustav Fischer, Jena u. a. 1994, ISBN 3-334-60458-6 (Lehrbuch mit systematischem Teil, Darstellung).
- Andreas E. Richter: Ammoniten. Überlieferung, Formen, Entwicklung, Lebensweise, Systematik, Bestimmung. Ein Kapitel aus dem Entwicklungsprogramm des Lebens. Franckh, Stuttgart 1982, ISBN 3-440-05129-3 (Überblick, eher für Sammler; Lehmann bietet mehr und genaueres zur Biologie).
- Rudolf Schlegelmilch: Die Ammoniten des süddeutschen Lias. Ein Bestimmungsbuch für Fossiliensammler und Geologen. Gustav Fischer, Stuttgart u. a. 1976, ISBN 3-437-30238-8.
- Rudolf Schlegelmilch: Die Ammoniten des süddeutschen Dogger. Ein Bestimmungsbuch für Fossiliensammler und Geologen. Gustav Fischer, Stuttgart u. a. 1985, ISBN 3-437-30488-7.
- Rudolf Schlegelmilch: Die Ammoniten des süddeutschen Malms. Ein Bestimmungsbuch für Fossiliensammler und Geologen. Gustav Fischer, Stuttgart u. a. 1994, ISBN 3-437-30610-3 (Drei Beispiele für Monografien der Ammoniten in einem geographischen Raum, in dem klassische Arbeiten zu Ammoniten entstanden. Hervorragende Zeichnungen und umfassende Beschreibungen, zahlreiche Abbildungen von Typusexemplaren. Standardwerke für die Bestimmung).
- Zum Ober-Bathonium (Mittlerer Jura) im Raum Hildesheim, Nordwestdeutschland – Mega- und Mikropaläontologie, Biostratigraphie (= Geologisches Jahrbuch. Reihe A: Allgemeine und regionale Geologie Bundesrepublik Deutschland und Nachbargebiete, Tektonik, Stratigraphie, Paläontologie. Heft 121, ISSN 0341-6399). Schweizerbart, Stuttgart 1990, S. 21–63.
Weblinks
- Website Dr. René Hoffmann, Ruhr-Universität Bochum
- The Paleobiology Database Ammonoidea
- Ammoniten im Fossilienatlas WiKi
- Herbert Summesberger: Die Bergung des Riesenammoniten von Gosau
- AMMON: Online-Datenbank paläozoischer Ammoniten, Dieter Korn & August Ilg (englisch)
- GONIAT Online, Online-Datenbank paläozoischer Ammonoideen (englisch)
- Hettangium-Ammoniten aus den Alpen, Peter Reiter
Einzelnachweise
- K. A. Zittel (1884): Handbuch der Paläontologie: Abt. 1, Band 2. 893 Seiten.
- E. Thenius: Fossilien im Volksglauben. Kramer, Frankfurt am Main 1996.
- H. Keupp (2000): Ammoniten – Paläobiologische Erfolgsspiralen. 165 Seiten.
- O. H. Schindewolf (1961–1968): Studien zur Stammesgeschichte der Ammoniten. Abhandlungen der Akademie der Wissenschaften und der Literatur in Mainz, Mathematisch-Naturwissenschaftliche Klasse.
- E. J. Denton, J. B. Gilpin-Brown (1966): On the buoyancy of the pearly Nautilus. Journal of the Marine Biological Association U. K. 46: S. 723–759.
- E. J. Denton (1974): On buoyancy and the lives of modern and fossil cephalopods. Proceedings of the Royal Society of London, Series B., Biological Sciences. 185: S. 273–299.
- L. Greenwald, C. B. Cook, P. Ward (1982): The structure of the chambered Nautilus siphuncle: the siphuncular epithelium. Journal of Morphology. 172: S. 5–22.
- C. Klug, E. P. Meyer, U. Richter, D. Korn (2008): Soft-tissue imprints in fossil and recent cephalopod septa and septum formation. Lethaia. 41: S. 477–492.
- R. Hoffmann (2010): New insights on the phylogeny of the Lytoceratoidea (Ammonitina) from the septal lobe and its functional interpretation. Revue de Paléobiologie. 29 (1): S. 1–156.
- L. A. Doguzhaeva, H. Mutvei (1991): Organization of the soft body in Aconeceras (Ammonitina), interpreted on the basis of shell morphology and muscle-scars. Palaeontographica A. 218: S. 17–33.
- R. Jordan (1968): Zur Anatomie mesozoischer Ammoniten nach den Strukturelementen der Gehäuseinnenwand. Beihefte zum Geologischen Jahrbuch. 77: S. 1–64.
- U. Richter (2002): Gewebeansatz-Strukturen auf pyritisierten Steinkernen von Ammonoideen. Geologische Beiträge Hannover. 4: S. 1–113.
- B. Kröger, J. Vinther, D. Fuchs (2011): Cephalopod origin and evolution: A congruent picture emerging from fossils, development and molecules. BioEssays: doi:10.1002/bies.201100001 12 Seiten.
- D. Fuchs, S. v. Boletzky, H. Tischlinger (2010): New evidence of functional suckers in belemnoid coleoids (Cephalopoda) weakens support for the "Neocoleoidea" concept. Journal of Molluscan Studies. 2010: S. 1–3.
- C. Klug (2010): Konnten Ammoniten schwimmen? Fossilien 2010 (2): S. 83–91.
- S. Shigeno, T. Sasaki, T. Moritaki, T. Kasugai, M. Vecchione, K. Agata (2008): Evolution of the Cephalopod Head Complex by assembly of Multiple Molluscan Body parts: Evidence from Nautilus embryonic development. Journal of Morphology. 269: S. 1–17.
- U. Lehmann (1990): Ammonoideen. Haeckel Bücherei, 257 Seiten.
- H. Keupp, F. Riedel (2009): Remarks on the possible function of the apophyses of the Middle Jurassic microconch ammonite Ebrayiceras sulcatum (Zieten, 1830), with a discussion on the palaeobiology of Aptychophora in general. Neues Jahrbuch für Geologie und Paläontologie, Abhandlungen. 255: S. 301–314.
- N. H. Landman, R. O. Johnson, M. P. Garb, L. E. Edwards, F. T. Kyte (2010): Ammonites from the Cretaceous/Tertiary Boundary. New Jersey, USA. S. 287–295. Tokai University Press.
- S. A. Walton, D. Korn, C. Klug (2010): Size distribution of the Late Devonian ammonoid Prolobites: indication for possible mass spawning events. Swiss J. Geosciences. 103: S. 475–494.
- I. Kruta, N. Landman, I. Rouget, F. Cecca, P. Tafforeau (2011): The Role of Ammonites in the Mesozoic Marine Food Web Revealed by Jaw Preservation. Science. 331: S. 70–72.
- Siehe Aufsatztext und zitierte Literatur in K. Tanabe, R. H. Mapes, D. L. Kidder (2001): A phosphatized cephalopod mouthpart from the Upper Pennsylvanian of Oklahoma, U.S.A. Paleontological Research 5(4): S. 311–318, doi:10.2517/prpsj.5.311 (Open Access).
- Siehe z. B. C. Klug, I. Jerjen (2012): The buccal apparatus with radula of a ceratitic ammonoid from the German Middle Triassic. Geobios. 45: S. 57–65, doi:j.geobios.2011.12.001
- K. Tanabe, Y. Fukuda, Y. Kanie, U. Lehmann (1980): Rhyncholites and conchorhynchs as calcified jaw elements in some Late Cretaceous ammonites. Lethaia. 13(2): S. 157–168, doi:10.1111/j.1502-3931.1980.tb01046.x (alternativer Volltextzugriff: ResearchGate).
- K. Tanabe (2011): The feeding habits of Ammonites. Science. 331: S. 37–38, doi:10.1126/science.1201002, (alternativer Volltextzugriff: ResearchGate)
- für einen Überblick siehe G. Schweigert (2009): First three-dimensionally preserved in situ record of an aptychophoran ammonite jaw apparatus in the Jurassic and discussion of the function of aptychi. Berliner Paläobiologische Abhandlungen. 10: S. 321–330 (PDF 750 kB).
- T. Engeser, H. Keupp (2002): Phylogeny of the aptychi-possessing Neoammonoidea (Aptychophora nov., Cephalopoda). Lethaia. 34: S. 79–96.
- K. Moriya, H. Nishi, H. Kawahata, K. Tanabe, Y. Takayanagi (2003): Demersal habitat of Late Cretaceous ammonoids: Evidence from oxygen isotopes for the Campanian (Late Cretaceous) northwestern Pacific thermalstructure. Geology. 31 (2): S. 167–170.
- B. Kröger (2001): Discussion - Comments on Ebel’s benthic-crawler hypothesis for ammonoids and extinct nautiloids. Paläontologische Zeitschrift. 75 (1): S. 123–125.
- B. Kröger (2002): On the efficiency of the buoyancy apparatus in ammonoids: evidences from sublethal shell injuries. Lethaia. 35: S. 61–70.
- T. L. Daniel, B. S. Helmuth, W. B. Saunders, P. D. Ward (1997). Septal complexity in ammonoid cephalopods increased mechanical risk and limited depth. Paleobiology. 23 (4): S. 470–481.
- H. Hölder (1952): Über den Gehäusebau, insbesondere den Hohlkiel jurassischer Ammoniten. Palaeontographica, Abteilung A. 102: S. 18–48.
- G. Schweigert, A. Scherzinger, H. Parent (2011): Geschlechtsunterschiede bei Ammoniten: Ungewöhnliches Beispiel aus dem Oberjura. Fossilien. 2011 (1): S. 51–56.
- J. H. Callomon (1981): Dimorphism in ammonoids. The Systematics Association Special Volume. 18: S. 257–273
- J. Callomon (1963): Sexual dimorphism in Jurassic ammonites. Transactions of the Leicester Literary and Philosophical Society 57: S. 21–56
- H. Makowski (1962): Problem of sexual dimorphism in ammonites. Palaeontologia Polonica 12: S. 1–92 (PDF 8,1 MB)
- Colin Barras: Squid-like creature that looked like a giant paperclip lived 200 years. Abgerufen am 11. November 2020 (amerikanisches Englisch).
- B. Kröger, R. H. Mapes (2007): On the origin of bactritoids (Cephalopoda). Paläontologische Zeitschrift. 81 (3): S. 316–327.
- C. Klug, D. Korn (2004): The origin of ammonoid locomotion. Acta Palaeontologica Polonica. 49 (2): S. 235–242.
- C. Klug, B. Kröger, W. Kiessling, G. L. Mullins, T. Servais, J. Frýda, D. Korn, S. Turner (2010): The Devonian nekton revolution. Lethaia. 43: S. 465–477.
- D. Korn, V. Ebbighausen, J. Bockwinkel, C. Klug (2003): The A-Mode sutural ontogeny in Prolecanitid Ammonoids. Palaeontology. 46 (6): S. 1123–1132.
- K. Warnke, H. Keupp (2005): Spirula - a window to the embryonic development of ammonoids? Morphological and molecular indications for a palaeontological hypothesis. Facies. 51: S. 65–70.
- O. H. Schindewolf (1945): Darwinismus oder Typostrophismus? Különnyomat a Magyar Biologiai Kutatóintézet Munkáiból. 16: S. 104–177.
- O. H. Schindewolf (1947): Fragen der Abstammungslehre. Aufsätze und Reden der Senckenbergischen Naturforschenden Gesellschaft. 1947: S. 1–23.
- D. Korn (2003): Typostrophism in Palaeozoic Ammonoids? Paläontologische Zeitschrift. 77 (2): S. 445–470.
- P. Ax (1995): Das System der Metazoa I – ein Lehrbuch der phylogenetischen Systematik. Gustav Fischer Verlag, 226 Seiten.
- Isabelle Rouget, Pascal Neigeet, Jean-Louis Dommergues: Ammonites phylogenetic analysis: state of the art and new prospects - L’analyse phylogénétique chez les ammonites: état des lieux et perspectives (= Bulletin de la Société Géologique de France. Band 175, Nr. 5). Société Géologique de France, Paris 2004, S. 507–512, doi:10.2113/175.5.507 (HTML).
- R. C. Moore (1957): Treatise on Invertebrate Paleontology Part L Mollusca 4 Cephalopoda Ammonoidea. Geological Society of America and University of Kansas Press. 490 Seiten.
- R. L. Kaesler (1996): Treatise on Invertebrate Paleontology Part L Mollusca 4 Revised Volume 4: Cretaceous Ammonoidea. Geological Society of America Inc. and The University of Kansas. 362 Seiten.

