Foraminiferen
Foraminiferen (Foraminifera), selten auch Kammerlinge genannt, sind einzellige, zumeist gehäusetragende Protisten aus der Gruppe der Rhizaria. Sie umfassen rund 10.000 rezente und 40.000 fossil bekannte Arten und stellen damit die bei weitem größte Gruppe der Rhizaria dar.
| Foraminiferen | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Ammonia tepida | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Foraminifera | ||||||||||||
| d’Orbigny, 1826 |
Nur rund fünfzig Arten leben im Süßwasser, alle übrigen Foraminiferen bewohnen marine Lebensräume von den Küsten bis in die Tiefsee. Die Tiere besiedeln zumeist den Meeresboden (Benthos); ein kleiner Teil, die Globigerinida, lebt im Wasser schwebend (planktisch).
Die außerordentlich formenreiche Gruppe ist fossil seit dem Kambrium (vor rund 560 Millionen Jahren) nachgewiesen, Untersuchungen der molekularen Uhr verweisen jedoch auf ein deutlich höheres Alter von 690 bis 1150 Millionen Jahren.[1] Foraminiferen dienen in der Paläontologie aufgrund ihrer gut fossil erhaltungsfähigen, oft gesteinsbildenden Schalen als Leitfossilien der Kreide, des Paläogen und des Neogen.
Merkmale
Alle Arten der Foraminifera sind einzellige Lebewesen, die ein Alter von mehreren Monaten oder sogar einigen Jahren erreichen können.[2] Die Mehrheit der lebenden Arten ist zwischen 200 und 500 Mikrometer groß, die kleinsten Vertreter messen nur bis zu 40 Mikrometer (Rotaliella roscoffensis) und die größten bis zu 12 (Cycloclypeus carpenteri) oder sogar 20 Zentimeter (Acervulina).[3] Fast alle Arten besitzen ein in der Regel vielkammeriges Gehäuse. Durch dessen Perforation können in einzelnen Fällen fadenförmige, sehr dünne Cytoplasmateile austreten. Die Hauptmasse dieser rhizopoden Scheinfüßchen tritt aus der Mündung heraus und bildet untereinander ein Netzwerk, verteilt über das ganze Gehäuse.[4]
Gehäuse
Die Gehäuse der Foraminiferen können sehr unterschiedlich gebaut sein, die Vielgestaltigkeit ihres Aufbaus dient als diagnostisches Merkmal zur Unterscheidung der Taxa. Relevant sind dabei zum einen das Material und zum anderen der zugrundeliegende Bauplan.

Baustoff
Anhand des Baustoffes ihrer Gehäuse lassen sich Foraminiferen in vier Gruppen einteilen:
Der bei weitem größten Gruppe dient sekretorisch ausgeschiedenes Calciumcarbonat (Kalk) als Baustoff, zumeist in Form des nicht stabilen Vaterit.[5] Später wird daraus Kalzit (Calcit), sehr selten Aragonit. Für eine genauere Untergliederung kann der Baustoff vor allem anhand seines Magnesiumsgehaltes (hoch/niedrig) weiter differenziert werden. Hingegen werden bei agglutinierenden Foraminiferen auf mineralischer oder proteinöser Basis aus dem Sediment aufgenommene Sandkörner oder andere Fremdkörper miteinander verklebt. Damit bilden sie eine höhere Form der rein proteinbasierten (selten sogar vollständig fehlenden) Gehäuse der Ordnung der Allogromiida, in die gelegentlich einzelne Partikel aus der Umgebung aufgenommen werden.[6]
Ein Sonderfall ist hingegen die nur aus der Gattung Miliammellus bestehende Ordnung Silicoloculinida, in der sich Gehäuse aus Opal finden (SiO2 x n H2O).[6]
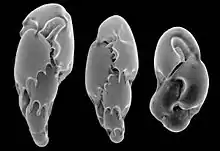
Bauplan
Die Gehäuse können aus nur einer Kammer bestehen (monothalam), aus einer Reihe von miteinander verbundenen Kammern (polythalam) oder – sehr selten – ganz fehlen (athalam).[2] Die Trennwände der Kammern („Septa“) sind jeweils durchbrochen (lat. foramen ‚Öffnung, Loch‘) und erlauben dem Protoplasmakörper so, sich innerhalb des Gehäuses zu bewegen; die Öffnung der jeweils letzten Kammer („Apertur“) dient als Tor zur Umgebung.[7]
Mehrkammerige Gehäuse können unterschiedlich angeordnet sein. Die schlichteste Form ist der uniseriale Bau, bei dem eine Kammer auf die nächste folgt. Wenn die Kammern zwei zueinander versetzte Reihen bilden, spricht man von biserialen Gehäusen. Triseriale Gehäuse, also aus drei versetzten Reihen gebildet, heißen auch trochospiral und bilden einen Gegensatz zu planspiralen Gehäusen. Bei letzteren findet jeder Umlauf der Spirale auf der gleichen Ebene wie der vorhergehende statt, in der Seitenansicht bleibt das Gehäuse also flach. Trochospirale Gehäuse hingegen stellen sich mit jedem Umlauf in verbreiternden, schraubenförmigen Spiralen dar; ihre Spiralseite ist aufgewölbt und die Unterseite abgeflacht. Sonderformen sind miliolide Gehäuse, bei denen ein Umlauf der Spirale aus nur zwei länglich-röhrenförmigen Kammern entsteht und annuläre Gehäuse, die – ähnlich wie Jahresringe – kreisförmig angelegt sind. Im Zentrum der Spiralen liegt der Nabel, der sogenannte Umbilikus.[7]
Die Gehäuse der sandschaligen Textulariida sowie aller kalkschaligen Arten mit Ausnahme jener der porzellanschaligen Miliolida weisen 1 bis 10 Mikrometer messende Poren auf, die dem Gasaustausch sowie der Aufnahme und Abgabe von Nährstoffen dienen.[8]

Zytoplasma
Die Gehäuse mehrkammeriger Foraminiferen sind oftmals nur zeit- oder teilweise mit Zytoplasma gefüllt, insbesondere jüngere Kammern bleiben oft leer. Das Zytoplasma ist zäh bis gelatinös und eigentlich farblos, wird aber durch Nahrung oder auch Endosymbionten vielfältig eingefärbt, von weißlich über gelblich, grünlich, orange, rötlich bis hin zu bräunlich. Die Färbung ist variabel und hängt auch davon ab, unter welchen ökologischen Umständen ein Individuum lebt oder in welcher Phase seines Lebenszyklus es sich befindet.[9]
Eine deutliche Differenzierung in Endoplasma und Ektoplasma gibt es nicht, das Gehäuse ist allerdings von einer dünnen Schicht Zytoplasma überzogen, das auch die Retikulopodien ausbildet.[9]
Retikulopodien
Wie alle Wurzelfüßer besitzen auch die Foraminiferen Scheinfüßchen (Pseudopodien). Diese Ausstülpungen aus dem Zytoplasma dienen der Verankerung im Untergrund, der Fortbewegung, der Aufnahme von Teilchen für den Gehäusebau sowie der Sammlung von Nährstoffen, dem Fang von Beute und gelegentlich der Verdauung außerhalb des Gehäuses. Sie sind lang, fadenförmig und dünn, an ihren jeweiligen Enden verjüngen sie sich auf einen Durchmesser von weniger als einen Mikrometer.[2][4]
Im Unterschied zu anderen Wurzelfüßern verfügen die Scheinfüßchen der Foraminiferen über die Fähigkeit der Anastomosie, können sich also verzweigen und mit anderen Scheinfüßchen wieder verschmelzen. Auf diese Weise können Foraminiferen ein komplexes Netz außerhalb ihres Körpers ausbilden, das sich über eine Fläche von mehreren hundert Quadratzentimetern ausbreiten kann. Man spricht in diesem Fall von Retikulopodien.[2]
Die Retikulopodien werden durch gelegentlich einzeln, meist jedoch in Bündeln auftretende Mikrotubuli verfestigt, die auch Bewegungen vermitteln, darunter als Besonderheit der Foraminifera eine bidirektionale Strömung des Zytoplasmas innerhalb der Retikulopodien.[2] Die Leitstruktur für die sogenannte „Körnchenströmung“ stellen Mikrotubulibündel dar, durch die mikroskopisch als Körnchen erkennbare Mitochondrien, Dichte Körper, Ummantelte und Elliptische Vesikel innerhalb der Retikulopodien in zwei Richtungen gleichzeitig (bidirektional) transportiert werden. Die ebenfalls als Körnchen in Erscheinung tretenden Phagosomen und Defäkationsvakuolen werden hingegen nur unidirektional transportiert.[10]
Lebenszyklus
Die Lebenszyklen von Foraminiferen-Arten sind bis in die Gegenwart nur spärlich erforscht; vollständig bekannt sind sie nur für weniger als 30 der rund 10.000 Arten. Als typisch gilt ein heterophasischer Generationswechsel zwischen sexueller, haploider und asexueller, diploider Generation. Dieser Generationswechsel ist in einigen Gruppen evolutionär wieder modifiziert worden. Die beiden Generationen sind dabei in ihrer Gestalt verschieden (Dimorphismus). Die Variabilität des Lebenszyklus ist innerhalb der Foraminiferen jedoch außerordentlich hoch, von fast jedem Merkmal des typischen Lebenszyklus findet sich auch eine abweichende Form.[4]
Neben geschlechtlicher Vermehrung können sich insbesondere einkammerige Foraminiferen-Arten auch ungeschlechtlich fortpflanzen, und zwar über Knospung, Zellteilung und Cytotomie[11].
Ökologie der Foraminiferen
Ökologisch lassen sich Foraminiferen in vier Gruppen teilen. Klassisch ist die Trennung zwischen den nur rund fünfzig als Plankton lebenden Arten und der größten Gruppe, den auf dem Meeresboden lebenden benthischen Foraminiferen. Eine Sondergruppe der benthischen Foraminiferen bilden die rund fünfzig in lichtdurchfluteten Flachgewässern zu findenden Großforaminiferen. Erst in den letzten Jahren zeichnen sich dazu die Umrisse einer vierten Gruppe ab, jene der unbeschalten, in Süßgewässern lebenden Foraminiferen. Von ihnen sind bisher rund fünfzig Arten bekannt. Über den endgültigen Umfang dieser Gruppe lassen sich derzeit noch keine Angaben machen.[12]
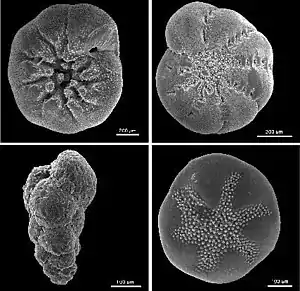
Benthische Foraminiferen
Die benthischen Foraminiferen sind die nach Artenzahl bei weitem größte Gruppe und umfassen rund 10.000 Arten. Sie lassen sich bis an den tiefsten Punkt der Ozeane im 10.900 Meter tiefen Challengertief nachweisen, wo sie überaus häufige Elemente der dortigen Fauna sind.[13] Am Boden können sie fest mit dem Substrat verbunden sein oder frei umherschweifen, die Übergänge sind aber fließend, die Zustände häufig temporär.[14]
Zur Anheftung bedürfen benthische Arten fester Untergründe, auf denen sie sich meist mittels ihrer Pseudopodien (so z. B. bei Astrorhiza limicola, Elphidium crispum, Bathysiphon spp.), aber auch mit organischen Membranen (Patellina corrugata), Haftscheiben (Halyphysema) oder schwefelsauren Mucopolysacchariden (Rosalina spp.) verankern. Die Anheftung ist häufig nur temporär, in der Vorbereitung zur Fortpflanzung z. B. werden die Verbindungen wieder gelöst. Manche Arten können mit Geschwindigkeiten von bis zu 12 Zentimetern pro Stunde wandern. Als Untergründe dienen jedoch nicht allein Felsen oder ähnliches, sondern z. B. auch Schalen von Muscheln, Hydrozoen oder Brachiopoden, wo sie als Kommensalen im Nahrungsstrom agieren. Epiphytisch finden sie sich in Algen- oder Seegrasvegetationen, wo anfallender Detritus ihre Nahrungsgrundlage bildet. Auf weniger festen Untergründen finden sie sich als sogenannte „endobenthische Foraminiferen“ nicht allein auf der Sedimentoberfläche, sondern auch in Tiefen von bis zu 16 Zentimetern im Sediment (z. B. Elphidium spp.), teils aktiv Nahrung aufnehmend oder sich reproduzierend.[14]
Lichtlos lebende Arten fungieren vielfach als Zersetzer des Detritus insbesondere phytoplanktischen Ursprungs. Arten der Tiefsee leben dabei von bereits stärker zersetztem Material. Darüber hinaus gibt es fleisch-, pflanzen- oder allesfressende Arten, die sich beispielsweise als Weidegänger, Destruenten, Filtrierer oder Parasiten ernähren; viele Arten sind in ihrer Ernährung auf einzelne Beutegruppen spezialisiert. Die Lebensweise einiger dieser Arten ist zeitweise auch planktisch.[14][4]
Großforaminiferen

Aus den benthischen Foraminiferen ausgegliedert wird meist die spezielle Gruppe der Großforaminiferen, die rund fünfzig Arten umfasst.[15] Sie zeichnen sich nicht allein durch ihre teils außerordentliche Größe von bis zu 13 Zentimetern aus, sondern vor allem durch ihre Lebensweise. Großforaminiferen kommen ausschließlich in flachen Gewässern von der Gezeitenzone bis rund 70, selten bis zu 130 Meter Tiefe vor. Sie beherbergen Algen (vereinzelt auch nur deren Chloroplasten) als Endosymbionten in ihren lichtdurchlässigen Gehäusen, über deren Photosynthese sie ihren Energiebedarf decken und Kalk zum Gehäusebau gewinnen. Großforaminiferen tragen rund 0,5 % zur weltweiten Karbonat-Produktion bei. Diese Symbiose ist mehrfach unabhängig voneinander entstanden und umfasst je nach Familie als Symbionten Rotalgen, Chlorophyten, Dinoflagellaten oder Kieselalgen. Die Symbionten finden sich als Zoochlorellae bzw. Zooxanthellae im Zytoplasma benthischer Foraminiferen und können bis zu 75 % des Gehäusevolumens einnehmen; ihre Anzahl beträgt nach Schätzungen über 100.000 bei Peneroplis pertusus bzw. rund 150.000 bei Heterostegina depressa.[16][17]

Großforaminiferen sind rein tropisch oder subtropisch verbreitet. Ihre höchste Artenvielfalt erreichen sie im indopazifischen Raum. Sie finden sich aber auch in der Karibik, im Zentralpazifik sowie im Golf von Akaba. Vertreter finden sich in den Familien Nummulitidae, Amphisteginidae und Calcarinidae der Ordnung Rotaliida, sowie Alveolinidae, Peneroplidae und Soritidae der Ordnung Miliolida. Die wohl bekanntesten Vertreter sind die Arten der Gattung Baculogypsina, deren charakteristisch geformte Gehäuse an den Stränden der Ryukyu-Inseln den sogenannten „Sternensand“ bilden. Die am weitesten verbreitete Art hingegen ist Heterostegina depressa.[17]
Die bestehenden Populationen der Großforaminiferen gelten als Relikte wesentlich diverserer Gruppen, die z. B. im Karbon und Perm (Fusulinida) bzw. im Tertiär sedimentbildende Verbreitung besaßen. Sie leben meist in großen Gruppen und sind sogenannte K-Strategen, die begrenzte Ressourcen nutzen und zu deren adäquater Nutzung nur langsam wachsen und in konstanten Populationsgrößen auftreten. Bemerkenswert ist ihre Lebensdauer, die mehrere Jahre betragen kann und von keinen anderen Einzellern erreicht wird.[15]
Planktische Foraminiferen
Mit nicht ganz fünfzig bekannten Arten, die sämtlich zur Ordnung Globigerinida gehören, ist der Anteil der im Plankton lebenden Foraminiferen rein nach Artenzahl gering. Die Tatsache, dass planktische Foraminiferen als die bedeutendsten Karbonat-Produzenten rund 20 % der jährlichen Menge produzieren, verdeutlicht jedoch ihre große Biomasse. Sie sind in polaren bis tropischen Meeren verbreitet, besonders viele Arten finden sich in subtropischen bis tropischen Gewässern. Gehäuft kommen sie vor allem in oberflächennahen Wasserlagen zwischen 10 und 50 Metern vor, reichen aber auch in Tiefen bis zu 800 Metern.[18] Viele Arten beherbergen wie die Großforaminiferen photosynthetisierende Symbionten in Gestalt des spezialisierten Dinoflagellaten Gymnodinium beii oder Goldbrauner Algen.[17]
Süßwasser-Foraminiferen
Die klassische Vorstellung von Foraminiferen als exklusiv marine Lebewesen mit Gehäusen wurde durch Forschungsergebnisse seit der Jahrtausendwende in Frage gestellt. Zwar waren bereits in der zweiten Hälfte des 19. Jahrhunderts mehrere Süßwasser-Arten aus dem Genfersee erstbeschrieben worden, ebenso wie bei der seit 1949 bekannten Reticulomyxa filosa aber war ihre systematische Position unklar, meist wurden sie zu anderen Gruppen als den Foraminiferen gestellt. Auch der Umfang der Gruppe, ihre Verbreitung und Lebensweise waren annähernd unerforscht, noch 2003 schrieb Maria Holzmann: „Süßwasserforaminiferen sind eine der rätselhaftesten Gruppen der Protisten.“[19] Über molekularbiologische Untersuchungen konnte nicht nur für einige von ihnen der Nachweis erbracht werden, dass es sich um Foraminiferen handelt,[20][21] sondern anhand von Sequenzierungen von Umweltproben verschiedener Herkunft konnte auch festgestellt werden, dass es zahlreiche noch unbekannte Arten gibt. Als Resümee dieser Proben konnte entgegen bisherigen Annahmen festgestellt werden, dass „Foraminiferen in Süßwasserumgebungen weitverbreitet sind“.[19] Die Erstbeschreibung einer sogar terrestrisch lebenden Art wie Edaphoallogromia australica zeigt, dass Foraminiferen auch außerhalb von Gewässern Verbreitung finden.[22][19]
Bedeutung der Foraminiferen

Foraminiferen sind unter anderem in der Paläontologie von Bedeutung. Verwesungsresistente Gehäuse können nach dem Absterben der Zelle durch Fossilisation erhalten bleiben. Anhand von fossilen Foraminiferen-Vergesellschaftungen kann man die Umweltbedingungen vergangener Zeiten rekonstruieren und die sie enthaltenden Gesteine relativ datieren (Biostratigraphie). Ab der Kreidezeit stellen planktische Foraminiferen aufgrund ihrer marinen Lebensweise und somit fast weltweiter Verbreitung wichtige Leitfossilien. Einige fossile Formen traten in solchen Mengen auf, dass sie gesteinsbildend wurden, so die Globigerinen (Globigerinida), die Fusulinen (Fusulinida) und die Nummuliten (Nummulitidae).[23] Berühmte derartige Gesteine sind die eozänen Nummulitenkalke, die beim Bau der ägyptischen Pyramiden verwendet wurden.[11][24][25]

Von großer Bedeutung ist dies für die Erdölindustrie. Bei Bohrungen kann anhand der Arten erkannt werden, ob hier zu früheren Zeiten für die Entstehung von Erdöllagern günstige klimatische Bedingungen geherrscht haben.[24]
Auch in der Paläoklimatologie spielen Foraminiferen eine wichtige Rolle als Proxy für die Rekonstruktion des Klimas vergangener Erdzeitalter. Speziell für die Erstellung der Sauerstoff-Isotopenstufen, aufgrund derer zwischen Warm- und Kaltzeiten unterschieden wird, kommen Foraminiferen aus limnischen oder marinen Sedimentbohrkernen zum Einsatz. Dabei erfolgt eine Altersdatierung anhand des Verhältnisses der Isotope 16O und 18O. Lokal wirken sich die reduzierten Ozeantemperaturen während der Kaltzeiten auch auf das Isotopenverhältnis der Kalkschale der Foraminifere aus, denn diese fraktioniert beim Einbau des Kalziumkarbonats in ihr Gehäuse das 16O/18O-Verhältnis bei geringeren Temperaturen hin zum schwereren Isotop (Temperatureffekt). Eine erhöhte Verdunstung im Lebensraum der Foraminifere, aber auch ein erhöhter Eintrag von isotopisch leichterem Schmelzwasser führen zu einer Verschiebung des 16O/18O-Verhältnisses im Wasser und somit im Gehäuse (Salinitätseffekt).[26][27]
Systematik
Adl et al. ordneten 2007 die Foraminiferen als eines der fünf Taxa innerhalb der Rhizaria ein, deren bei weitem größte Gruppe sie sind. Auf der Basis von molekularbiologisch ermittelten Stammbäumen stellten die Foraminiferen die Schwestergruppe der Gattung Gromia dar und bildeten entsprechend mit diesen ein gemeinsames Taxon.[28] Neuere molekularbiologische Untersuchungen von 2012 ergeben laut Adl et al. jedoch, dass die Gattung Gromia keine Schwestergruppe ist.[29] Die nächsten Verwandten sind wahrscheinlich die Acantharia und die Polycystinea.[29]
Die Foraminiferen umfassen rund 10.000 rezente und 40.000 fossil bekannte Arten[30] in rund 65 Überfamilien und 300 Familien, rund 150[17] davon rezent.
Die innere Systematik der Gruppe hingegen gilt unter molekulargenetischen Gesichtspunkten noch als weitgehend unklar. Vor allem die Tatsache, dass die dazu notwendige DNA meist nur in unzureichender Menge gewonnen werden kann, da sich die meisten Foraminiferen im Labor nicht kultivieren lassen und nur von extrem wenigen Arten überhaupt DNA zur Verfügung steht, erschwert umfangreiche und repräsentative Untersuchungen.[31] Auch technische Hindernisse machen die Erstellung phylogenetischer Stammbäume schwierig: Sogenannte Long-branch-attraction-Artefakte führen im Rahmen der für Untersuchungen häufig gebrauchten SSU rDNA oft zu schweren statistischen Fehlern. Daher konnte erst der Gebrauch experimenteller Markergene (Aktin-[32], RNA-Polymerase-II-Gen[31]) die anfänglichen Ergebnisse stabilisieren. Deutlich zeichnet sich in allen Untersuchungen ab, dass die Ordnungen Allogromiida und Astrorhizida zusammen mit einigen oft als Athalamidae geführten schalenlosen Foraminiferen eine paraphyletische Gruppe bilden und dass die Miliolida aus ihnen hervorgingen. Auch sind die Globigerinida ebenso wie die Buliminida wohl ein Teil der Rotaliida.
Alle bisherigen Systematiken basieren daher, auch aufgrund der großen Anzahl der ausschließlich durch ihre Gehäuse bekannten fossilen Arten, noch immer auf morphologischen Merkmalen[33]. Die derzeit aktuelle umfassende Systematik der Foraminiferen geht auf Alfred R. Loeblich und Helen Tappan zurück und wurde 1992 vorgestellt. Sie diente auch als Grundlage für die modifizierte und ergänzte Systematik von Barun Sen Gupta aus dem Jahre 2002, die hier herangezogen wird. Die Foraminiferen werden dort als Klasse verstanden und in 16 Ordnungen untergliedert († = ausgestorben).[6]

- Ordnung Allogromiida
- Ordnung Astrorhizida
- Ordnung Lituolida
- Ordnung Trochamminida
- Ordnung Textulariida
- Ordnung Fusulinida †
- Ordnung Miliolida
- Ordnung Carterinida
- Ordnung Spirillinida
- Ordnung Lagenida
- Ordnung Buliminida
- Ordnung Rotaliida
- Ordnung Globigerinida
- Ordnung Involutinida
- Ordnung Robertinida
- Ordnung Silicoloculinida
Spätere molekularbiologische Untersuchungen weisen darauf hin, dass auch die bis dato als eigene Klasse unsicherer Stellung verstandenen Xenophyophoren zu den Foraminiferen zu zählen und eng verwandt mit der Gattung Rhizammina (Astrorhizida) sind. Ihre genaue Position innerhalb des obigen Systems ist allerdings nicht definiert.[34]
Forschungsgeschichte
Lange wurden vom Menschen nur die fossilierten Schalen der Foraminiferen wahrgenommen. Frühe Autoren erkannten nicht deren Ursprung als Gehäuse von Lebewesen. So deutete Strabo die Nummuliten im Kalk der Pyramiden von Gizeh als Kotreste der Arbeiterschaft und noch vom 16. bis 18. Jahrhundert wurde wie bei allen Fossilien meist angenommen, es handele sich schlicht um Steine.[24]

Antoni van Leeuwenhoek dokumentierte 1700 den Fund einer Foraminiferenschale „nicht größer als ein Sandkorn“ im Magen einer Garnele. Von ihm als Weichtier angesehen, lässt sie sich anhand seiner Zeichnung sicher als Art der Gattung Elphidium bestimmen.[35] Unabhängig davon meinte Johann Jakob Scheuchzer zu gleicher Zeit, dass „diese Steine wahrhaft Schnecken und nicht in der Erden durch ich weiß nicht was vor einen Archeum gebildet worden“.[24] Diese Zuordnung zu den Weichtieren war zwar falsch, immerhin jedoch war nunmehr der Charakter der Foraminiferen als Lebewesen erkannt. Die Pionierarbeit von Janus Plancus, der 1739 einige Foraminiferen vom Strand von Rimini beschrieb, diente Carl von Linné 1758 als Grundlage für seine Platzierung der Arten bei den Perlbooten (Nautilus).[24]
Als eigenständige systematische Gruppe wurden sie jedoch erst 1826 durch die Erstbeschreibung der Foraminiferen von Alcide d’Orbigny manifest. Sah er sie ursprünglich noch als Ordnung der Kopffüßer an und blieb damit innerhalb der traditionellen Vorstellung der Foraminiferen als einer Gruppe von Weichtieren, so erhob er sie 1839 zu einer eigenen Klasse.
Dem voraus gingen die ersten Erkenntnisse zur Biologie der Foraminiferen, insbesondere die von Félix Dujardin (1801–1860) zum Aufbau des eigentlichen "Körpers". Er nannte den kontraktilen internen Stoff, der sich spontan durch die Poren der Kalkschalen in Form von Pseudopodien drängte, Sarkode; später wurde diese Bezeichnung von Hugo von Mohl (1805–1872) durch die bis heute gültige Protoplasma ersetzt. Félix Dujardin sah in den Foraminiferen Einzeller, Rhizopoden, wie er diese nannte, mit Schalen (Rhizopodes á coquilles).
D’Orbigny war es auch, der die paläontologische Erforschung der Foraminiferen begann, während zugleich vornehmlich britische Forscher erste ökologische Forschungen durchführten. In der zweiten Hälfte des 19. Jahrhunderts erwies sich die zwischen 1873 und 1876 unternommene Challenger-Expedition auch für die Foraminiferenkunde als außerordentlich erfolgreich. Henry Bowman Bradys 1884 erschienener „Report on the Foraminifera dredged by H.M.S. Challenger“ gilt bis in die Gegenwart als ein klassisches Werk über rezente Arten. Zu gleicher Zeit konnten auch grundlegende Fragen des Zellaufbaus (z. B. Nachweis eines Zellkerns durch Hertwig und Schulze 1877) und des Lebenszyklus (Entdeckung von Gehäusedimorphismen durch Maximilian von Hantken 1872, Grundlagen der Vermehrung von Schaudinn und Lister 1894/95) geklärt werden.[24]
Im 20. Jahrhundert wurden die Kenntnisse über die Foraminiferen vor allem durch drei US-amerikanische Forscher bereichert. Joseph Augustine Cushman legte den Grundstein der modernen Foraminiferenforschung, indem er neben der Beschreibung einer gewaltigen Anzahl neuer Arten auch das Cushman Laboratory for Foraminiferal Research sowie das bis in die Gegenwart bedeutende Fachmagazin „Contributions from the Cushman Laboratory for Foraminiferal Research“ gründete, heute „Journal of Foraminiferal Research“. Im Jahrzehnt zwischen 1931 und 1940 wurden 3800 Arten neu aufgestellt, im Jahr 1935 erschienen rund 360 Arbeiten über Foraminiferen, 1936 bereits doppelt so viele. Diese Wissensexplosion war einerseits auf die Materialzunahme durch Meeresexpeditionen zurückzuführen, andererseits aber auch auf das gestiegene Interesse der Erdölindustrie an Foraminiferen als Leitfossilien (Anzeiger für das geologische Alter der Erdschicht) bei der stratigraphischen Analyse von Erdölbohrungen.[24]
1940 erschien der erste Band des Catalogue of Foraminifera von B. F. Ellis und A. R. Messina, von dem bis heute 94 Bände erschienen sind, die annähernd jede je beschriebene Foraminifere aufführen.[11] Das noch immer weitergeführte Werk liegt mittlerweile in digitaler Form vor und enthält annähernd 50.000 Arten.[36]
Nach Cushmans Tod 1949 dominierte die Arbeit des Ehepaares Helen Tappan und Alfred R. Loeblich in der zweiten Hälfte des Jahrhunderts. War Cushman systematisch noch älteren Ideen verhaftet gewesen, überarbeiteten Loeblich und Tappan die Systematik der Foraminiferen grundlegend und publizierten Ihre Ergebnisse in zwei großen monographischen Veröffentlichungen 1964 und 1989, die bis in die Gegenwart maßgeblich sind. Neuere systematische Ansätze wie die von Valeria I. Mikhalevich[37] sind weder vollständig noch haben sie sich bisher durchgesetzt, ebenso wenig molekularbiologische Untersuchungen (insbesondere durch Jan Pawlowski).
Nachweise
Fußnoten direkt hinter einer Aussage belegen die einzelne Aussage, Fußnoten hinter einer Leerstelle vor Satzzeichen den gesamten vorangehenden Satz. Fußnoten hinter einer Leerstelle beziehen sich auf den kompletten vorangegangenen Text.
- Jan Pawlowski, Maria Holzmann, Cedric Berney, Jose Fahrni, Andrew J. Gooday, Tomas Cedhagen, Andrea Habura, Samuel S. Bowser: The evolution of early Foraminifera, In: Proceedings of the National Academy of Sciences of the USA, Vol. 100, S. 11494–11498, 2003
- Klaus Hausmann, Norbert Hülsmann, Renate Radek: Protistology, 3. Auflage, 2003, ISBN 3-510-65208-8, S. 129–134
- Rudolf Röttger, Gunnar Lehmann: Benthic foraminifera In: R. Röttger, R. Knight, W. Foissner (Hrsg.): A course in Protozoology, Protozoological Monographs Bd. 4, 2009, S. 111–123, ISBN 3-8322-7534-7
- Susan T. Goldstein: Foraminifera: A Biological Overview In: Barun K. Sen Gupta (Hrsg.): Modern Foraminifera. Springer Netherlands (Kluwer Academic), 2002, ISBN 1-4020-0598-9, S. 37–57.
- Jacob, Wirth, Agbaje, Branson, Eggins: Systematics of modern Foraminifera In: 'Planktic foraminifera form their shells via metastable carbonate phases'. Nature Communications. doi:10.1038/s41467-017-00955-0
- Barun K. Sen Gupta: Systematics of modern Foraminifera In: Barun K. Sen Gupta (Hrsg.): Modern Foraminifera. Springer Netherlands (Kluwer Academic), 2002, ISBN 1-4020-0598-9, S. 7–37.
- Rudolf Röttger: Wörterbuch der Protozoologie. In: Protozoological Monographs. Band 2. Shaker, Aachen 2001, ISBN 3-8265-8599-2, S. 83.
- Rudolf Röttger: Wörterbuch der Protozoologie. In: Protozoological Monographs. Band 2. Shaker, Aachen 2001, ISBN 3-8265-8599-2, S. 182.
- Klaus Nuglisch: Foraminiferen – marine Mikroorganismen, Wittenberg, 1985, „3. Zytoplasma und seine Strukturen“, S. 14–21
- Rudolf Röttger: Wörterbuch der Protozoologie. In: Protozoological Monographs. Band 2. Shaker, Aachen 2001, ISBN 3-8265-8599-2, S. 128.
- John J. Lee, Jan Pawlowski, Jean-Pierre Debenay, John Whittaker, Fred Banner, Andrew J. Gooday, Ole Tendal, John Haynes, Walter W. Faber: Class Foraminifera In: John J. Lee, G. F. Leedale, P. Bradbury (Hrsg.): An Illustrated Guide to the Protozoa. Band 2. Allen, Lawrence 2000, ISBN 1-891276-23-9, S. 877.
- Zur Einteilung siehe z. B.: Rudolf Röttger, Robert Knight, Wilhelm Foissner (Hrsg.): A Course in Protozoology – Second revised edition In: Protozoological Monographs – Vol. 4, 2009
- Yuko Todo, Hiroshi Kitazato, Jun Hashimoto, Andrew J. Gooday: Simple Foraminifera Flourish at the Ocean’s Deepest Point In: Science, 307:5710, S. 689, 2005
- Klaus Nuglisch: Foraminiferen – marine Mikroorganismen, Wittenberg, 1985, „11.1 Benthosforaminiferen“, S. 106–113
- Rudolf Röttger: Wörterbuch der Protozoologie In: Protozoological Monographs, Bd. 2, 2001, S. 96–98, ISBN 3-8265-8599-2
- Klaus Nuglisch: Foraminiferen – marine Mikroorganismen, Wittenberg, 1985, „5. Symbionten“, S. 25–28
- Pamela Hallock: Symbiont-bearing Foraminifera In: Barun K. Sen Gupta (Hrsg.): Modern Foraminifera. Springer Netherlands (Kluwer Academic), 2002, ISBN 1-4020-0598-9, S. 123–139.
- Pallavi Anand, Henry Elderfield, and Maureen H. Conte: Calibration of Mg/Ca thermometry in planktonic foraminifera from a sediment trap time seriens In: Paleoceanography, 18(2), S. 1050
- Maria Holzmann, Andrea Habura, Hannah Giles, Samuel S. Bowser, Jan Pawlowski: Freshwater Foraminiferans Revealed by Analysis of Environmental DNA Samples In: Journal of Eukaryotic Microbiology, Bd. 50, Nr. 2, 2003, S. 135–139
- Jan Pawlowski, Ignacio Bolivar, Jose F. Fahrni, Colomban De Vargas, Samuel S. Bowser: Molecular evidence that Reticulomyxa filosa is a freshwater naked foraminifer In: Journal of Eukaryotic Microbiology, 1999, Bd. 46, S. 612–617
- Ralf Meisterfeld, Maria Holzmann, Jan Pawlowski: Morphological and Molecular Characterization of a New Terrestrial Allogromiid Species: Edaphoallogromia australica gen. et spec. nov. (Foraminifera) from Northern Queensland (Australia) In: Protist, 152:3, 2001, S. 185–192
- Maria Holzmann, Jan Pawlowski: Freshwater Foraminiferans From Lake Geneva: Past And Present in: The Journal of Foraminiferal Research, 2002, Bd. 32, Nr. 4, S. 344–350
- Klaus Nuglisch: Foraminiferen – marine Mikroorganismen, Wittenberg, 1985, „1. Einleitung“, S. 5–7
- Klaus Nuglisch: Foraminiferen – marine Mikroorganismen, Wittenberg, 1985, „2. Geschichte der Foraminiferenforschung“, S. 7–14
- Bernhard Ziegler: Einführung in die Paläobiologie Teil 2, Schweizerbart’sche Verlagsbuchhandlung Stuttgart, 1983, S. 25
- James D. Wright: Paleo-oceanography: Cenozoic Climate – Oxygen Isotope Evidence. In: J. Steele, S. Thorpe, K. Turekian (Hrsg.): Encyclopedia of Ocean Sciences. Academic Press, 2001 (Online [PDF; 1,4 MB]).
- James D. Wright: Global climate change in marine stable isotope records. In: J. S. Noller, J. M. Sowers, W. R. Lettis (Hrsg.): Quaternary Geochronology: Methods and Applications, AGU Ref. Shelf, Bd. 4, S. 427–433, doi:10.1029/RF004p0427.
- Sina M. Adl, Brian S. Leander, Alastair G. B. Simpson, John M. Archibald, et al.: Diversity, Nomenclature and Taxonomy of Protists (= Systematic Biology. Band 56, Nr. 4). Oxford Journals, 2007, S. 685, doi:10.1080/10635150701494127 (Online).
- Sina M. Adl, Alastair G.B. Simpson, Christopher E. Lane, Julius Lukeš, David Bass, Samuel S. Bowser, Matthew W. Brown, Fabien Burki, Micah Dunthorn, Vladimir Hampl, Aaron Heiss, Mona Hoppenrath, Enrique Lara, Line le Gall, Denis H. Lynn, Hilary McManus, Edward A.D. Mitchell, Sharon E. Mozley-Stanridge, Laura W. Parfrey, Jan Pawlowski, Sonja Rueckert, Lora Shadwick, Conrad L. Schoch, Alexey Smirnov, A. und Frederick W. Spiegel: The Revised Classification of Eukaryotes (= The Journal of Eukaryotic Microbiology. Band 59, Nr. 5). International Society of Protistologists, 2012, S. 429–514, doi:10.1111/j.1550-7408.2012.00644.x.
- Samuel S. Bowser, Andrea Habura, Jan Pawlowski: Molecular evolution of Foraminifera In: Laura Katz Olson, Laura A. Katz, Debashish Bhattacharya: Genomics and Evolution of Microbial Eukaryotes, 2006, S. 78–94, ISBN 0-19-856974-2
- David Longet, Jan Pawlowski: Higher-level phylogeny of Foraminifera inferred from the RNA polymerase II (RPB1) gene In: European Journal of Protistology, 43 (2007), S. 171–177
- Jerome Flakowski, Ignacio Bolivar, Jose Fahrni, Jan Pawlowski: Actin Phylogeny Of Foraminifera In: Journal of Foraminiferal Research, 2005, Band 35, S. 93–102
- Sina M. Adl, Alastair G. B. Simpson, Mark A. Farmer, Robert A. Andersen, O. Roger Anderson, John A. Barta, Samual S. Bowser, Guy Brugerolle, Robert A. Fensome, Suzanne Fredericq, Timothy Y. James, Sergei Karpov, Paul Kugrens, John Krug, Christopher E. Lane, Louise A. Lewis, Jean Lodge, Denis H. Lynn, David G. Mann, Richard M. McCourt, Leonel Mendoza, Øjvind Moestrup, Sharon E. Mozley-Standridge, Thomas A. Nerad, Carol A. Shearer, Alexey V. Smirnov, Frederick W. Spiegel, Max F. J. R. Taylor: The New Higher Level Classification of Eukaryotes with Emphasis on the Taxonomy of Protists (= The Journal of Eukaryotic Microbiology. Band 52, Nr. 5). International Society of Protistologists, 2005, S. 418, doi:10.1111/j.1550-7408.2005.00053.x.
- Jan Pawlowski, Maria Holzmann, Jose Fahrni, Susan L. Richardson: Small Subunit Ribosomal DNA Suggests that the Xenophyophorean Syringammina corbicula is a Foraminiferan In: Journal of Eukaryotic Microbiology, 50:6, 2003, S. 483–487
- Barun K. Sen Gupta: Introduction to modern Foraminifera In: Barun K. Sen Gupta (Hrsg.): Modern Foraminifera. Springer Netherlands (Kluwer Academic), 2002, ISBN 1-4020-0598-9, S. 3–6.
- Eintrag im DEBIS, Online
- Valeria I. Mikhalevich: Über die heterogene Zusammensetzung der ehemaligen Gruppe Textulariina (Foraminifera) – Deutsche Übersetzung des Textteils und der Literaturangaben von: Valeria I. Mikhalevich: On the heterogeneity of the former Textulariina (Foraminifera) In: Proc. 6th Intern. Workshop Agglutinated Foraminifera., Grzybowski Foundation Spec. Publ., 2004, Bd. 8., S. 317–349, PDF Online
Weblinks
- Foraminifera.eu: Illustrierter Katalog rezenter und fossiler Foraminiferen
- Illustrated glossary of terms used in foraminiferal research
- Ökologie der Großforaminiferen – Film. IWF (Göttingen). Laufzeit: 10:41 Minuten. Erscheinungsjahr: 1982.