Mitochondriale DNA
Fachsprachlich wird als mitochondriale DNA, kurz mtDNA, die doppelsträngige, zumeist zirkuläre DNA im Inneren (Matrix) der Mitochondrien bezeichnet. Diese Bezeichnung setzt sich unter dem Einfluss zitierter Fachliteratur zunehmend gegen das deutsche Fremdwort „mitochondrielle DNS“ durch. Das mitochondriale Genom wird als Mitogenom oder (seltener) als Chondriom bezeichnet. Die mtDNA wurde 1963 von Margit Nass und Sylvan Nass[1] mit elektronenmikroskopischen Methoden[2] und 1964 von Ellen Haslbrunner, Hans Tuppy und Gottfried Schatz[3] aufgrund biochemischer Messungen entdeckt.[4]
Eigenschaften
Die mtDNA vielzelliger Organismen ist meist zirkulär organisiert, d. h., sie besteht aus einem zu einem Ring geschlossenen DNA-Doppelstrang. Bei vielen einzelligen Organismen und auch bei einigen Vielzellern (z. B. bei einigen Arten der Cnidaria), wurde jedoch auch linear organisierte mtDNA nachgewiesen (z. B. bei dem Ciliaten Tetrahymena oder der Grünalge Chlamydomonas reinhardtii). Die Enden dieser linearen mtDNA bilden Telomerase-unabhängige Telomere mit unterschiedlichen Replikationsmechanismen aus, was sie zu interessanten Forschungsobjekten macht, da sich unter den Protisten mit linearer mtDNA viele Pathogene finden.[5] Die Replikation und Transkription der mtDNA wird durch die mtDNA-Kontrollregion gesteuert.
Obwohl eine mtDNA-spezifische DNA-Polymerase vorhanden ist (die kerncodierte Pol γ), erlaubt das Vorhandensein einer eigenen mtDNA den Mitochondrien nicht, sich unabhängig von der Zelle, in der sie sich befinden, zu teilen und zu vermehren.[6] Allerdings ist die Teilungsfrequenz der Mitochondrien nur indirekt von der Teilungsfrequenz der Zelle abhängig. Auf der mtDNA befinden sich einige, wenn auch nicht alle, Gene für die Enzyme der Atmungskette sowie Gene, die für die Struktur und Reproduktion der Mitochondrien verantwortlich sind. Jedoch sind die Gene von mehr als 90 % der Proteine, aus denen ein Mitochondrium besteht, im Zellkern lokalisiert und werden im Cytoplasma der Zelle synthetisiert. Die fertigen Proteine werden im Anschluss an die Transkription und Translation mit Hilfe einer komplexen Translokationsmaschinerie (TOM/TIM) über die beiden mitochondrialen Membranen ins Innere der Mitochondrien importiert.[7]
Die mtDNA ist innerhalb der Matrix in sogenannten Nucleoiden organisiert, einem Zellkernäquivalent, wie es auch bei Prokaryoten zu finden ist. Diese enthalten sowohl die Nukleinsäure als auch Proteine.
Ursprung
Das Vorhandensein einer eigenen DNA ist einzigartig unter den Zellorganellen der Tiere, bei den Pflanzen besitzen die Chloroplasten (und anderen Plastiden) dieselbe Eigenschaft. Dies ist Ausgangspunkt für die Endosymbiontentheorie, die besagt, dass Mitochondrien und Chloroplasten ursprünglich eigenständige Organismen waren, die im Laufe der Evolution in tierische bzw. pflanzliche Vorläuferzellen inkorporiert wurden und nun bestimmte Aufgaben für diese Zellen übernehmen. Weitere Indizien hierfür sind, dass Mitochondrien in etwa die gleiche Größe wie kleine Bakterien haben, eine zirkuläre DNA besitzen und von zwei Membranen umgeben sind. Auch ist die Proteinsynthesemaschinerie (z. B. mitochondriale Ribosomen) der Mitochondrien der von Prokaryoten sehr ähnlich. Überdies enthält mtDNA, ähnlich wie bakterielle DNA, keine echten Histone und kaum Introns. Bei Bakterien, Mitochondrien und Plastiden wird die DNA jedoch durch funktionell histonähnliche Proteine (HLPs, englisch histone like proteins) verdichtet, die untereinander homolog sind.
Abweichende Genomorganisation
Merkwürdigerweise ist das beschriebene Muster bei den Mitochondrien der Menschenlaus (Pediculus humanus) nicht zu finden. Stattdessen ist das mitochondriale Genom hier in 18 minicirculären Chromosomen angeordnet, von denen jedes 3–4 kb lang ist und ein bis drei Gene codiert. Dieses Muster ist auch in anderen Echten Tierläusen (Anoplura) zu finden, nicht aber in Kieferläusen (Mallophaga). Es wurde gezeigt, dass zwischen den Minichromosomen Rekombination auftritt. Der Grund für diesen Unterschied ist nicht bekannt.[8]
Varianten im Genetischen Code
Im Jahr 1979 wurde entdeckt, dass in menschlichen Mitochondrien die mtDNA mit einem geringfügig vom Standard abweichenden Genetischen Code übersetzt werden.[9] Solche Abweichungen waren schon früher vorhergesagt worden.[10] Seitdem wurde eine ganze Reihe leichter Varianten des Genetischen Codes entdeckt, darunter auch verschiedene alternative Mitochondriencodes.[11][12] Allerdings verwenden die Mitochondrien vieler Eukaryoten, einschließlich der meisten Pflanzen, den Standardcode.[13]
| Organismus | Codon | Standard | Mitochondrien |
|---|---|---|---|
| Mammalia | AGA, AGG | Arginin | Stoppcodon |
| Wirbellose | AGA, AGG | Arginin | Serin |
| Pilze | CUA | Leucin | Threonin |
| Alle obigen | AUA | Isoleucin | Methionin |
| UGA | Stoppcodon | Tryptophan |
Einige dieser Unterschiede sollten als Pseudoveränderungen im genetischen Code angesehen werden, was auf das in Mitochondrien übliche Phänomen des RNA-Editing zurückzuführen ist. In höheren Pflanzen glaubte man, dass CGG für Tryptophan und nicht für Arginin kodiert – es wurde jedoch entdeckt, dass das Codon in der verarbeiteten RNA das UGG-Codon ist, was mit dem genetischen Standardcode für Tryptophan übereinstimmt.[15] Bemerkenswert ist, dass der mitochondriale genetische Code innerhalb einer Gruppe der Arthropoden eine parallele Entwicklung durchgemacht hat, wobei einige Organismen AGG eindeutig in Lysin (statt Serin) übersetzen.[16]
Endosymbiotischer Gentransfer bis zum Totalverlust
Mitochondriale Genome haben weit weniger Gene als die Bakterien, von denen sie vermutlich abstammen. Obwohl einige Gene verloren gingen, wurden viele in den Zellkern transferiert (endosymbiotischer Gentransfer, EGT), wie z. B. für die Proteinuntereinheiten des Respiratory Complex II.[17] Man nimmt an, dass dies im Laufe der Evolution seit Entstehung der Eukaryoten relativ häufig geschehen ist. Bei einigen Organismen wie Cryptosporidium parvum fehlt den Mitochondrien die DNA komplett. Vermutlich gingen alle ihre Gene verloren oder wurden auf den Zellkern übertragen.[18] In Cryptosporidium haben die Mitochondrien ein abweichendes System zur Synthese von ATP, das den Parasiten gegen viele klassische Mitochondrieninhibitoren wie Cyanid, Azide und Atovaquon resistent macht.[18]
Die mtDNA des Menschen
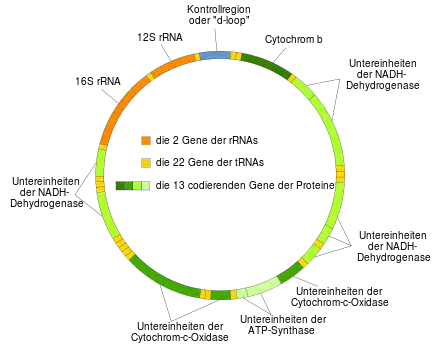
Die menschliche mtDNA besteht aus 16.569 Basenpaaren mit 37 Genen. Sie exprimieren 13 mRNAs, die für Protein-Untereinheiten der Atmungsketten-Komplexe I, III, IV und V codieren, sowie 22 tRNAs und zwei rRNAs (12S- und 16S-rRNA).[19][20] Die mtDNA besitzt bei 10–15 Molekülen pro Mitochondrium zwischen 100 und 10.000 Kopien pro Zelle.
Vererbung
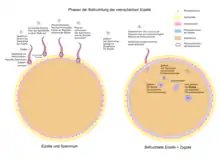
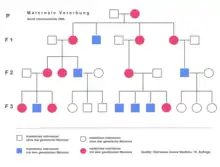
In der Genealogie und Anthropologie spielt die Vererbung der mtDNA eine große Rolle. Dies hat einerseits damit zu tun, dass Mitochondrien bei vielen Organismen in der Regel nur maternal, also nur von der Mutter an die Nachkommen weitergegeben werden. Die Mitochondrien des Spermiums befinden sich in dessen Mittelstück, das bei der Befruchtung in die Gallerthülle der Eizelle eindringt, aber nicht Bestandteil der Zygote wird. Außerdem sondert die Eizelle Enzyme ab, welche die Mitochondrien des Spermiums auflösen. Genauer gesagt, werden sie mit Ubiquitin markiert und anschließend abgebaut.
Die mtDNA mutiert mit einer sehr konstanten Rate, sodass man relativ genau sagen kann, wie nah (zeitlich gesehen) zwei Volksstämme verwandt sind, d. h., wann sich die Vorläufer dieser Stämme trennten. In der Anthropologie konnte so gezeigt werden, dass die amerikanische Urbevölkerung am engsten mit der Urbevölkerung Eurasiens verwandt ist (also von einem gemeinsamen Vorläufer abstammt); außerdem konnten Hypothesen über die Ursprünge des Jetztmenschen (Mitochondriale Eva) bestätigt werden. Das 2005 gestartete Genographic-Projekt, welches Erbgut von Menschen auf allen Kontinenten mit dem Ziel untersucht, genauere Erkenntnisse über die Verwandtschaftsbeziehungen der verschiedenen Bevölkerungen sowie den Ablauf der Besiedlung der Erde durch den Homo sapiens zu gewinnen, macht sich diese Eigenschaften der mtDNA zu Nutze.
Bei der maternalen Vererbung von Mutationen der mtDNA vererben betroffene Frauen das Merkmal an ihre Kinder beiderlei Geschlechts. Betroffene Männer vererben es an keines ihrer Kinder. Vor einigen Jahren wurde eine sogenannte paternale Vererbung von mtDNA bei etlichen Tierarten und in einem Fall beim Menschen postuliert. Sie scheint offenbar relativ selten zu sein (bei Mäusen beträgt die Rate 1:10.000). Sie sorgt dafür, dass auch väterliche mtDNA auf die Nachkommen übertragen wird. Die genauen Vorgänge sind noch nicht geklärt. Seit 2002 ist ein einziger Fall bekannt, dass eine besondere Eigenheit/Mutation der mtDNA vom Vater auf seinen Sohn vererbt worden sein sollte: Während die Blut-mtDNA von der Mutter geerbt war, stimmten 90 % der Muskel-mtDNA mit der Sequenz des Vaters überein.[21] Nach weiteren Untersuchungen wird allgemein davon ausgegangen, dass dieser spezielle Befund der Annahme, dass Mitochondrien beim Menschen in der Regel nur mütterlicherseits vererbt werden können, nicht widerspricht; methodische Probleme der Analyse können eine paternale Vererbung vortäuschen.[22][23][24][25][26][27]
Neandertaler-mtDNA
Svante Pääbo und Kollegen gelang es 2008, das mitochondriale Genom eines Neandertalers (Homo neanderthalensis), der vor 38.000 Jahren lebte, vollständig, mit einer bisher nicht erreichten Genauigkeit, zu sequenzieren.[28][29]
Humane mitochondriale Haplogruppe
| Evolutionsbaum Haplogruppen Mitochondriale DNA (mtDNA) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Gene
| Gen | Typ | Genprodukt | Position im Mitogenom |
Strang |
|---|---|---|---|---|
| MT-ATP8 | proteincodierend | ATP-Synthase, Fo subunit 8 (complex V) | 08,366–08,572 (Überlappung mit MT-ATP6) | H |
| MT-ATP6 | proteincodierend | ATP-Synthase, Fo subunit 6 (complex V) | 08,527–09,207 (Überlappung mit MT-ATP8) | H |
| MT-CO1 | proteincodierend | Cytochrom-c-Oxidase, subunit 1 (complex IV) | 05,904–07,445 | H |
| MT-CO2 | proteincodierend | Cytochrom-c-Oxidase, subunit 2 (complex IV) | 07,586–08,269 | H |
| MT-CO3 | proteincodierend | Cytochrom-c-Oxidase, subunit 3 (complex IV) | 09,207–09,990 | H |
| MT-CYB | proteincodierend | Cytochrom b (complex III) | 14,747–15,887 | H |
| MT-ND1 | proteincodierend | NADH-Dehydrogenase, subunit 1 (complex I) | 03,307–04,262 | H |
| MT-ND2 | proteincodierend | NADH-Dehydrogenase, subunit 2 (complex I) | 04,470–05,511 | H |
| MT-ND3 | proteincodierend | NADH-Dehydrogenase, subunit 3 (complex I) | 10,059–10,404 | H |
| MT-ND4L | proteincodierend | NADH-Dehydrogenase, subunit 4L (complex I) | 10,470–10,766 (Überlappung mit MT-ND4) | H |
| MT-ND4 | proteincodierend | NADH-Dehydrogenase, subunit 4 (complex I) | 10,760–12,137 (Überlappung mit MT-ND4L) | H |
| MT-ND5 | proteincodierend | NADH-Dehydrogenase, subunit 5 (complex I) | 12,337–14,148 | H |
| MT-ND6 | proteincodierend | NADH-Dehydrogenase, subunit 6 (complex I) | 14,149–14,673 | L |
| MT-TA | transfer RNA | tRNA-Alanin (Ala oder A) | 05,587–05,655 | L |
| MT-TR | transfer RNA | tRNA-Arginin (Arg oder R) | 10,405–10,469 | H |
| MT-TN | transfer RNA | tRNA-Asparagin (Asn oder N) | 05,657–05,729 | L |
| MT-TD | transfer RNA | tRNA-Asparaginsäure (Asp oder D) | 07,518–07,585 | H |
| MT-TC | transfer RNA | tRNA-Cystein (Cys oder C) | 05,761–05,826 | L |
| MT-TE | transfer RNA | tRNA-Glutaminsäure (Glu oder E) | 14,674–14,742 | L |
| MT-TQ | transfer RNA | tRNA-Glutamin (Gln oder Q) | 04,329–04,400 | L |
| MT-TG | transfer RNA | tRNA-Glycin (Gly oder G) | 09,991–10,058 | H |
| MT-TH | transfer RNA | tRNA-Histidin (His oder H) | 12,138–12,206 | H |
| MT-TI | transfer RNA | tRNA-Isoleucin (Ile oder I) | 04,263–04,331 | H |
| MT-TL1 | transfer RNA | tRNA-Leucin (Leu-UUR oder L) | 03,230–03,304 | H |
| MT-TL2 | transfer RNA | tRNA-Leucin (Leu-CUN oder L) | 12,266–12,336 | H |
| MT-TK | transfer RNA | tRNA-Lysin (Lys oder K) | 08,295–08,364 | H |
| MT-TM | transfer RNA | tRNA-Methionin (Met oder M) | 04,402–04,469 | H |
| MT-TF | transfer RNA | tRNA-Phenylalanin (Phe oder F) | 00,577–00,647 | H |
| MT-TP | transfer RNA | tRNA-Prolin (Pro oder P) | 15,956–16,023 | L |
| MT-TS1 | transfer RNA | tRNA-Serin (Ser-UCN oder S) | 07,446–07,514 | L |
| MT-TS2 | transfer RNA | tRNA-Serin (Ser-AGY oder S) | 12,207–12,265 | H |
| MT-TT | transfer RNA | tRNA-Threonin (Thr oder T) | 15,888–15,953 | H |
| MT-TW | transfer RNA | tRNA-Tryptophan (Trp oder W) | 05,512–05,579 | H |
| MT-TY | transfer RNA | tRNA-Tyrosin (Tyr oder Y) | 05,826–05,891 | L |
| MT-TV | transfer RNA | tRNA-Valin (Val oder V) | 01,602–01,670 | H |
| MT-RNR1 | ribosomale RNA | Small subunit : SSU (12S) | 00,648–01,601 | H |
| MT-RNR2 | ribosomale RNA | Large subunit : LSU (16S) | 01,671–03,229 | H |
Im Jahr 2020 berichteten Wissenschaftler, mittels eines neuartigen CRISPR-freien Geneditors, erstmals die Gene von Mitochondrien bearbeitet zu haben.[31][32] Genomweite Assoziationsstudien untersuchen mtDNA auf Assoziationen mit Phänotypen wie Lebenserwartung und Risiken für Krankheiten wie Typ-2-Diabetes.[33][34]
Mitochondrial-derived peptides
Seit etwa 2013 ist bekannt, dass zusätzlich zu den im Mitochondrium gebildeten Proteinen hier verschiedene Peptide gebildet werden. Diese Peptide werden teilweise ins Zytoplasma freigesetzt und besitzen regulatorische Aufgaben. Es existieren keine eigenständigen für diese Peptide kodierenden Gene, sie sind innerhalb von offenen Leserastern überlappend mit proteinkodierenden Genen kodiert. Dem entsprechend ist ihre genaue Anzahl bis heute unbekannt. Das zuerst entdeckte mitochondriale Peptid war das 2001 von Yuichi Hashimoto entdeckte Humanin, dessen kodierende Sequenz mit mt-RNR2 überlappt.[35] Es besitzt Bedeutung beim Schutz der Zelle vor oxidativem Stress. Im Jahr 2020 sind insgesamt acht mitochondrial-derived peptides (MDP) bekannt. Alle besitzen eine mit Humanin vergleichbare zelluläre Schutzfunktion.[36] Einige besitzen darüber hinaus möglicherweise Bedeutung als Chaperone.[37]
Literatur
- Chen, X.J. & Butow, R. A. (2005): The organization and inheritance of the mitochondrial genome. In: Nat. Rev. Genet. 6(11):815–825. PMID 16304597, doi:10.1038/nrg1708
- Bryan Sykes: Die sieben Töchter Evas. Lübbe, 2001, ISBN 3-7857-2060-2
- Jürgen Groth: Das Mitochondriengenom. In: Meine Moleküle, Deine Moleküle. Von der molekularen Individualität. Berlin, 2009 (Online-Buch)
Weblinks
Einzelnachweise
- Wenner-Gren Institute for Experimental Biology, Stockholm University, Stockholm, Sweden.
- Margit M. Nass, Sylvan Nass (1963): Intramitochondrial Fibers with DNA characteristics. In: J. Cell. Biol. Bd. 19, S. 593–629. PMID 14086138 PDF
- Institut für Biochemie an der medizinischen Fakultät der Universität Wien.
- Haslbrunner, E. et al. (1964): Deoxyribonucleic Acid associated with Yeast Mitochondria. In: Biochem. Biophys. Res. Commun. Bd. 15, S. 127–132. PDF (Memento des Originals vom 10. September 2008 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Nosek J., Tomáska, L., Fukuhara, H., Suyama, Y., Kovác, L. (1998) Linear mitochondrial genomes: 30 years down the line, Trends Genet., 14(5), S. 184–188. PMID 9613202
- Hoppins, S. et al. (2007): The Machines that Fuse and Divide Mitochondria. In: Ann Rev Biochem Bd. 76, S. 751–80. PMID 17362197
- Rehling, P. Meisinger, C. (2003): Proteintransport in Mitochondrien: TOM- und TIM-Komplexe. In: Biospektrum. Bd. 9, S. 460–463. PDF
- Shao R, Kirkness EF, Barker SC: The single mitochondrial chromosome typical of animals has evolved into 18 minichromosomes in the human body louse, Pediculus humanus. In: Genome Research. 19, Nr. 5, Mai 2009, S. 904–912. doi:10.1101/gr.083188.108. PMID 19336451. PMC 2675979 (freier Volltext).
- B. G. Barrell, A. T. Bankier, J. Drouin: A different genetic code in human mitochondria. In: Nature. 282, Nr. 5735, November 1979, S. 189–194. bibcode:1979Natur.282..189B. doi:10.1038/282189a0. PMID 226894.
- Francis H. C. Crick, L. E. Orgel et al.: Directed panspermia. In: Icarus. 19, Nr. 3, 1973, S. 341–346. bibcode:1973Icar...19..341C. doi:10.1016/0019-1035(73)90110-3. „S. 344: It is a little surprising that organisms with somewhat different codes do not coexist.“ Diskussion.
- Andrzej Elzanowski, Jim Ostell: The Genetic Codes. NCBI
- T. H. Jukes, S. Osawa: The genetic code in mitochondria and chloroplasts. In: Experientia. 46, Nr. 11–12, Dezember 1990, S. 1117–1126. doi:10.1007/BF01936921. PMID 2253709.
- Andrzej (Anjay) Elzanowski, Jim Ostell: Mitochondrial Genetic Code in Taxonomy Tree. NCBI
- Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter: Molecular Biology of the Cell. Garland Publishing Inc., New York 1994, ISBN 978-0-8153-3218-3.
- Hiesel R, Wissinger B, Schuster W, Brennicke A: RNA editing in plant mitochondria. In: Science. 246, Nr. 4937, Dezember 1989, S. 1632–1634. bibcode:1989Sci...246.1632H. doi:10.1126/science.2480644. PMID 2480644.
- Abascal F, Posada D, Knight RD, Zardoya R: Parallel evolution of the genetic code in arthropod mitochondrial genomes. In: PLoS Biology. 4, Nr. 5, Mai 2006, S. e127. doi:10.1371/journal.pbio.0040127. PMID 16620150. PMC 1440934 (freier Volltext).
- Chan DC: Mitochondria: dynamic organelles in disease, aging, and development. In: Cell. 125, Nr. 7, Juni 2006, S. 1241–1252. doi:10.1016/j.cell.2006.06.010. PMID 16814712.
- Henriquez FL, Richards TA, Roberts F, McLeod R, Roberts CW: The unusual mitochondrial compartment of Cryptosporidium parvum. In: Trends in Parasitology. 21, Nr. 2, Februar 2005, S. 68–74. doi:10.1016/j.pt.2004.11.010. PMID 15664529.
- MITOMAP: Revised Cambridge Reference Sequence (rCRS) of the Human Mitochondrial DNA
- RefSeq: NC_012920
- Schwartz, M. & Vissing, J. (2002): Paternal inheritance of mitochondrial DNA. In: N. Engl. J. Med. Bd. 347, S. 576–580. PMID 12192017, doi:10.1056/NEJMoa020350 (freier Volltext).
- Taylor, R.W. et al. (2003): Genotypes from patients indicate no paternal mitochondrial DNA contribution. In: Ann. Neurol. Bd. 54, S. 521–524. PMID 14520666
- Filosto, M. et al. (2003): Lack of paternal inheritance of muscle mitochondrial DNA in sporadic mitochondrial myopathies. In: Ann. Neurol. Bd. 54, S. 524–526. PMID 14520667
- Schwartz, M. & Vissing, J. (2004): No evidence for paternal inheritance of mtDNA in patients with sporadic mtDNA mutations. In: J. Neurol. Sci. Bd. 218, S. 99–101. PMID 14759640
- Bandelt, H-J. et al. (2005): More evidence for non-maternal inheritance of mitochondrial DNA? In: J. Med. Genet. Bd. 42, S. 957–960. PMID 15923271 doi:10.1136/jmg.2005.033589
- Neiman, M. & Taylor, D. R. (2009): The causes of mutation accumulation in mitochondrial genomes. In: Proc. R. Soc. B. Bd. 276, Nr. 1660, S. 1201–1209. PMID 19203921 doi:10.1098/rspb.2008.1758
- Sabine Lutz-Bonengel, Harald Niederstätter, Jana Naue, Rafal Koziel, Fengtang Yang, Timo Sänger, Gabriela Huber, Cordula Berger, René Pflugradt, Christina Strobl, Catarina Xavier, Marianne Volleth, Sandra Carina Weiß, Jodi A Irwin, Erica L Romsos, Peter M Vallone, Gudrun Ratzinger, Matthias Schmuth, Pidder Jansen-Dürr, Thomas Liehr, Peter Lichter, Thomas J Parsons, Stefan Pollak, Walther Parson (2021): Evidence for multi-copy Mega-NUMTs in the human genome. Nucleic Acids Research 49 (3): 1517–1531. doi:10.1093/nar/gkaa1271 (open access)
- Green, R. E. et al. (2008): A complete Neandertal mitochondrial genome sequence determined by high-throughput sequencing. In: Cell. Bd. 134, Nr. 3, S. 416–426. PMID 18692465, PMC 2602844 (freier Volltext).
- EBI: AM948965
- S. Anderson, A. T. Bankier, B. G. Barrell, M. H. de Bruijn, A. R. Coulson, J. Drouin, I. C. Eperon, D. P. Nierlich, B. A. Roe, F. Sanger, P. H. Schreier, A. J. Smith, R. Staden, I. G. Young: Sequence and organization of the human mitochondrial genome. In: Nature. Band 290, Nummer 5806, April 1981, S. 457–465, PMID 7219534.
- The powerhouses inside cells have been gene-edited for the first time. In: New Scientist, 8. Juli 2020. Abgerufen am 12. Juli 2020.
- Beverly Y. Mok, Marcos H. de Moraes, Jun Zeng, Dustin E. Bosch, Anna V. Kotrys, Aditya Raguram, FoSheng Hsu, Matthew C. Radey, S. Brook Peterson, Vamsi K. Mootha, Joseph D. Mougous, David R. Liu: A bacterial cytidine deaminase toxin enables CRISPR-free mitochondrial base editing. In: Nature. 583, Nr. 7817, Juli 2020, ISSN 1476-4687, S. 631–637. doi:10.1038/s41586-020-2477-4. PMID 32641830. PMC 7381381 (freier Volltext).
- Mothers can influence offspring's height, lifespan and disease risk through mitochondria (en). In: phys.org. Abgerufen am 14. Juni 2021.
- Ekaterina Yonova-Doing, Claudia Calabrese, Aurora Gomez-Duran, Katherine Schon, Wei Wei, Savita Karthikeyan, Patrick F. Chinnery, Joanna M. M. Howson: An atlas of mitochondrial DNA genotype–phenotype associations in the UK Biobank. In: Nature Genetics. 17. Mai 2021, ISSN 1546-1718, S. 1–12. doi:10.1038/s41588-021-00868-1. PMID 34002094.
- Changhan Lee, Kelvin Yen, Pinchas Cohen (2013): Humanin: a harbinger of mitochondrial-derived peptides? Trends in Endocrinology and Metabolism 24 (5): 222–228. doi:10.1016/j.tem.2013.01.005
- Troy L. Merry, Alex Chan, Jonathan S. T. Woodhead, Joseph C Reynolds, Hiroshi Kumaga, Su-Jeong Kim, Changhan Lee (2020): Mitochondrial-derived peptides in energy metabolism. American Journal of Physiology. Endocrinologa and Metabolism (online ahead of print) doi:10.1152/ajpendo.00249.2020.
- Alan K. Okada, Kazuki Teranishi, Fleur Lobo, J. Mario Isas, Jialin Xiao, Kelvin Yen, Pinchas Cohen, Ralf Langen (2017): The Mitochondrial-Derived Peptides, HumaninS14G and Small Humanin-like Peptide 2, Exhibit Chaperone-like Activity. Scientific Reports 7, article number: 7802. doi:10.1038/s41598-017-08372-5