β-Nitrostyrol
β-Nitrostyrol ist ein aromatisches Nitroalken, das überwiegend in der trans-Konformation vorliegt und durch eine Henry-Reaktion aus Benzaldehyd und Nitromethan einfach zugänglich ist.[8] Als α,β-ungesättigte Nitroverbindung ist β-Nitrostyrol ein geeigneter Akzeptor für enantioselektive Michael-Additionen an Michael-Donatoren, wie z. B. Aldehyde oder Ketone.[9] β-Nitrostyrol findet in Synthesevarianten der γ-Aminobuttersäure-Derivate Baclofen und Phenibut[10] sowie als Vorstufe für Phenethylamin und seine Derivate Verwendung.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
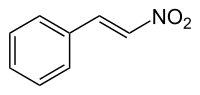 | |||||||||||||||||||
| trans-β-Nitrostyrol | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | β-Nitrostyrol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H7NO2 | ||||||||||||||||||
| Kurzbeschreibung |
hellgelbes bis gelbes kristallines Pulver[1] bzw. prismatische Kristalle[2][3] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 149,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
250–260 °C[4] | ||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser,[5] löslich in Ethanol und Aceton, sehr gut löslich in Diethylether, Chloroform und Kohlenstoffdisulfid[6] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Vorkommen und Darstellung
Eduard Simon erhielt bereits im Jahr 1839 beim Destillieren von flüssigem Storaxharz mit konzentrierter Salpetersäure ein stark nach Zimt riechendes und in „prachtvollen Prismen“ erstarrendes „ätherisches Öl“, das er Nitrostyrol nannte.[2]
August Wilhelm von Hofmann[11] beschrieb und bestätigte die nach der Vorschrift von E. Simon erhaltene Substanz als Nitrostyrol.
Die erste gezielte Synthese von β-Nitrostyrol wurde 1883 mit der Umsetzung von Benzaldehyd mit Nitromethan in Gegenwart von Zinkchlorid (saure Katalyse) berichtet.[12]
Johannes Thiele stellte β-Nitrostyrol erstmals 1899 in einer später als Henry-Reaktion benannten Nitroaldolkondensation durch basische Katalyse mittels Kaliummethanolat in „ausgezeichneter Ausbeute“ als gelbliche Prismen dar.[3]
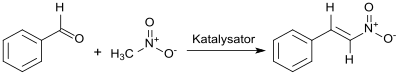
Der in der Reaktion von Benzaldehyd mit Nitromethan intermediär entstehende Nitroalkohol dehydratisiert spontan unter Bildung des α,β-ungesättigten Nitroalkens.[13]
Mit Amylamin als Katalysator erhielt Emil Knoevenagel β-Nitrostyrol in 75 %iger Ausbeute.[14]
Eine präparativ einfache Laborvorschrift[15] mit Natronlauge als Katalysator gibt eine Ausbeute von 80 bis 83 % an.
Die Verwendung von Methylamin oder Ammoniumacetat in Essigsäure als Katalysator[16] bringt keine Vorteile gegenüber Alkalihydroxiden oder -alkoholaten.
Die Nitroaldol-Reaktion in der ionischen Flüssigkeit 2-(Hydroxyethyl)ammoniumformat liefert in Kleinansätzen β-Nitrostyrol in 90 %iger Ausbeute.[17]
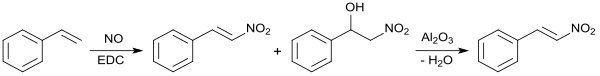
Nitrierung von Styrol mit Stickstoffmonoxid NO in 1,2-Dichlorethan EDC und Dehydratisierung des gleichzeitig entstehenden Nitroalkohols durch Erhitzen mit saurem Aluminiumoxid liefert in Kleinstansätzen (1 mmolar) β-Nitrostyrol in 95 %iger Ausbeute.[18]
Eigenschaften
β-Nitrostyrol ist eine gelbe kristalline Substanz, die aus Ethanol beim Abkühlen in rhombischen Prismen kristallisiert[2] und sich in vielen organischen Lösungsmitteln löst. Die Verbindung „riecht in höchstem Maße nach Zimmt“ und besitzt „einen süßen, aber äußerst brennenden Geschmack und zu Thränen reizenden Geruch“.[11] Die Dämpfe heißer β-Nitrostyrol-Lösungen wirken äußerst reizend auf Nase und Augen; die Gesichtshaut reagiert besonders empfindlich auf die Festsubstanz.[15]
Anwendungen
Hydrierungen zum β-Phenylethylamin
Die vollständige Hydrierung von β-Nitrostyrol mit Wasserstoff an einem Palladium-Kontakt[19] liefert in 84%iger Ausbeute β-Phenylethylamin, gegenüber 88 % bei der Reduktion mit Boran-Tetrahydrofuran-Komplex,[20]

während die Hydrierung mit Lithiumaluminiumhydrid[21] lediglich in 60%iger Ausbeute zum Phenylethylamin führt, der Stammverbindung pharmakologisch wirksamer, insbesondere psychotroper Phenylethylamine.
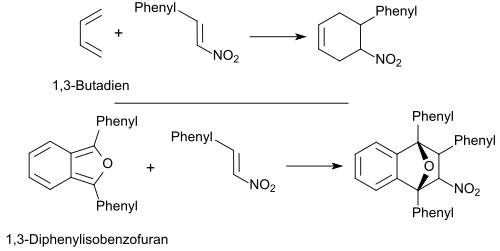
Diels-Alder-Reaktionen
Als aktiviertes Alken und Dienophil reagiert β-Nitrostyrol mit Dienen, wie z. B. 1,3-Butadien oder 1,3-Diphenylisobenzofuran in einer Diels-Alder-Reaktion[22] mit hohen Ausbeuten zu den entsprechenden Addukten.
Mit Cyclopentadien entsteht in 85%iger Ausbeute ein Phenyl-2-nitronorbornen.[23]
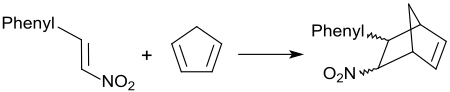
Michael-Reaktionen
Als α,β-ungesättigte Nitroverbindung eignet sich β-Nitrostyrol als ausgezeichneter Akzeptor in Michael-Additionen.[9] Mit Meldrumsäure reagiert β-Nitrostyrol in Gegenwart von Hydrotalkit in 95%iger Ausbeute zum Michael-Additionsprodukt,[10]
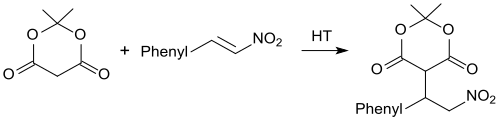
das beim Erhitzen in Ethanol unter Abspaltung von Aceton und CO2 in 85%iger Ausbeute 3-Phenyl-4-nitrobuttersäureethylester – eine γ-Nitrobuttersäureverbindung – bildet. Der Nitrobuttersäureester wird mit Natriumborhydrid in Gegenwart von Nickel(II)-chlorid-hexahydrat in 4-Phenylpyrrolidin-2-on (82 %) überführt, das mit 6M Salzsäure in das γ-Aminobuttersäure-(GABA)-Derivat 4-Amino-3-phenylbuttersäure (als Hydrochlorid) Phenibut gespalten wird.
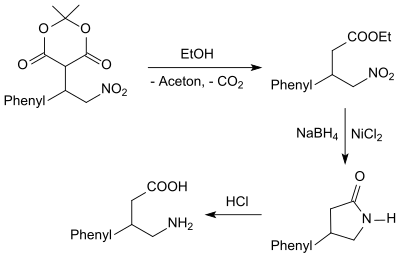
Die gleiche Reaktionsfolge mit 4-Chlor-β-nitrostyrol als Startverbindung liefert das als Muskelrelaxans wirksame γ-Aminobuttersäurederivat Baclofen.
Bei Verwendung chiraler Katalysatoren, wie z. B. Chinin-Alkaloiden,[24] Prolinol-Derivaten[25] oder Thioharnstoffen[26] können mit Aldehyden – selbst mit dem schwachen Nukleophil Acetaldehyd[27]
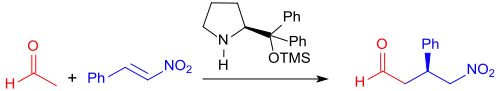
– und 1,3-Dicarbonylverbindungen – auch mit dem sterisch stark behinderten Dipivaloylmethan[28] – Michael-Additionsprodukte in praktisch quantitativer Ausbeute und Enantiomerenüberschüssen von bis zu 99 % dargestellt werden.
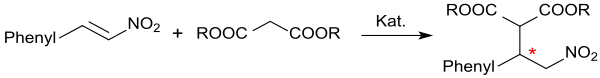
Baylis-Hillman-Reaktion
Die Baylis-Hillman-Reaktion[29] eignet sich zur basenkatalysierten C-C-Verknüpfung zwischen Aldehyden (bzw. Elektrophilen) und aktivierten Alkenen in Gegenwart von Basen, wie z. B. DABCO, wobei hochfunktionalisierte Produkte, wie z. B. α-substituierte Allylalkohole, entstehen. In Gegenwart von Diarylthioharnstoffen und der Base DMAP reagiert der Aldehyd Glyoxylsäureethylester mit β-Nitrostyrol in hohen Ausbeuten zu 2-Hydroxy-3-nitro-4-arylbut-3-enoaten.[30]
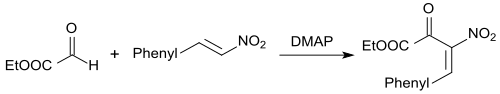
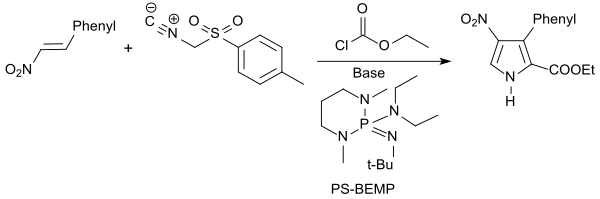
Barton-Zard-Reaktion
Die nach Derek H. R. Barton benannte Barton-Zard-Reaktion,[31][32] bei der β-Nitrostyrol(derivate) mit Alkylisocyanoacetaten bzw. Tosylmethylisocyanid TosMIC in Gegenwart einer starken Base, wie z. B. n-Butyllithium reagieren, erzeugt substituierte Pyrrole.[33] Aus β-Nitrostyrol entsteht mit dem Isocyanid TosMIC und Ethylchlorformiat in Gegenwart der polymerfixierten Superbase[34] PS-BEMP das 4-Nitro-3-phenyl-1H-pyrrol-2-ethylcarboxylat in 76 %iger Ausbeute.
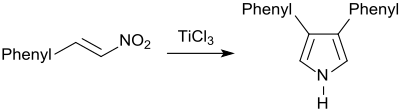
3,4-Diarylpyrrole sind als Ausgangsverbindungen für arylsubstituierte Porphyrine von Interesse und können durch Reduktion von β-Nitrostyrol mit Titan(III)-chlorid in wässrigem 1,4-Dioxan in bescheidener Ausbeute (ca. 50 %), jedoch präparativ sehr einfach dargestellt werden.[35]
Weitere Pyrrolsynthesen unter Verwendung von β-Nitrostyrol(derivaten) sind beschrieben.[36]
Wirkstoffe auf der Basis von β-Nitrostyrol
Additionsprodukte von Dithiocarbamaten an β-Nitrostyrol wurden synthetisiert und auf ihre Wirksamkeit gegen Bakterien und Pilze geprüft.[37]
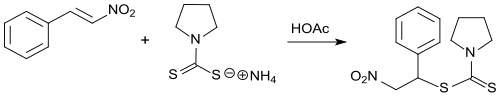
β-Nitrostyrol und seine halogen- bzw. methylsubstituierten Derivate wurden auf antibakterielle Eigenschaften hin untersucht, da sie gegenüber Thiolen aus cysteinreichen Enzymen hohe Reaktivität in der Michael-Addition zeigen.[38][39] β-Nitrostyrol selbst ist allerdings wenig aktiv.
In Gegenwart von Natriummethanolat-Spuren bildet sich aus β-Nitrostyrolen und zwei Äquivalenten Dimethylformamid-dimethylacetal in DMF in mäßigen Ausbeuten (bis 40 %) 1,3,5-Triphenylbenzole.[40]
Anmerkung
Fälschlicherweise wird β-Nitrostyrol gelegentlich als Vorstufe für den Farbstoff Indigo angegeben. Dabei wird jedoch das von Ludwig Gattermann[41] irrtümlich als Zwischenstufe vermutete 2-Nitrostyrol mit β-Nitrostyrol verwechselt.[42]
Übersichtsartikel
Einzelnachweise
- Eintrag zu trans-β-Nitrostyrene bei TCI Europe, abgerufen am 25. Oktober 2017.
- E. Simon: Ueber den flüssigen Storax (Styrax liquidus). In: Liebigs Ann. Chem. Band 31, Nr. 3, 1839, S. 265–277, doi:10.1002/jlac.18390310306.
- J. Thiele: Condensation des Nitromethans mit aromatischen Aldehyden. In: Ber. Dtsch. Chem. Ges. Band 32, Nr. 1, 1899, S. 1293–1295, doi:10.1002/cber.189903201209.
- Datenblatt trans-β-Nitrostyrene 99% bei Sigma-Aldrich, abgerufen am 25. Oktober 2017 (PDF).
- Datenblatt trans-beta-Nitrostyrene, 98% bei AlfaAesar, abgerufen am 25. Oktober 2017 (PDF) (JavaScript erforderlich).
- William M. Haynes: CRC Handbook of Chemistry and Physics, 91st Edition. CRC Press, Boca Raton, FL, U.S.A. 2010, ISBN 978-1-4398-2077-3, S. 3–396.
- Datenblatt β-Nitrostyrol zur Synthese (PDF) bei Merck, abgerufen am 25. Oktober 2017.
- C. Yu, W. Wang: Nitrostyrene. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2014, doi:10.1002/047084289X.rn01748.
- N. Mase, K. Watanabe, H. Yoda, K. Takabe, F. Tanaka, C.F. Barbas: Organocatalytic direct Michael reaction of ketones and aldehydes with β-nitrostyrene. In: J. Am. Chem. Soc. Band 128, Nr. 15, 2006, S. 4966–4967, doi:10.1021/ja060338e.
- C.R.M. D’Oca et al.: New Multicomponent Reaction for the Direct Synthesis of β-Aryl-γ-nitroesters Promoted by Hydrotalcite-Derived Mixed Oxides as Heterogeneous Catalyst. In: J. Braz. Chem. Soc. Band 28, Nr. 2, 2017, S. 285–298, doi:10.5935/0103-5053.20160175.
- J. Blyth, A.W. Hofmann: Ueber das Styrol und einige seiner Zersetzungsproducte. In: Liebigs Ann. Chem. Band 53, Nr. 3, 1845, S. 289–329, doi:10.1002/jlac.18450530302.
- B. Priebs: Einwirkung von Benzaldehyd auf die Mononitrokohlenwasserstoffe der Fettreihe. In: Ber. Dtsch. Chem. Ges. Band 16, Nr. 2, 1883, S. 2591, doi:10.1002/cber.188201602191.
- J. Thiele, S. Haeckel: Ueber Abkömmlinge des Phenylnitroäthylens. In: Liebigs Ann. Chem. Band 325, Nr. 1, 1902, S. 1–18, doi:10.1002/jlac.19023250102.
- E. Knoevenagel, L. Walter: Condensation aliphatischer Nitrokörper mit aromatischen Aldehyden durch organische Basen. In: Ber. Dtsch. Chem. Ges. Band 37, Nr. 4, 1904, S. 4502–4510, doi:10.1002/cber.19040370443.
- D.E. Worrall: Nitrostyrene In: Organic Syntheses. 9, 1929, S. 66, doi:10.15227/orgsyn.009.0066; Coll. Vol. 1, 1941, S. 413 (PDF).
- C.B. Gairaud, G.R. Lappin: The synthesis of β-nitrostyrenes. In: J. Org. Chem. Band 18, Nr. 1, 1953, S. 1–3, doi:10.1021/jo01129a001.
- S. Pavlovica, A. Gaidule, A. Zicmanis: Synthesis of β-nitrostyrene in highly hydrophilic ionic liquid media. In: Latvian J. Chem. Band 1, 2013, S. 49–53, doi:10.2478/ljc-2013-0005.
- T. Mukaiyama, E. Hata, T. Yamada: Convenient and simple preparation of nitroolefins Nitration of olefins with nitric oxide. In: Chem. Lett. Band 24, Nr. 7, 1995, S. 505–506, doi:10.1246/cl.1995.505.
- K. Kindler, E. Brandt, E. Gehlhaar: Studien über den Mechanismus chemischer Reaktionen. V. Die Bedeutung von Molekülverbindungen bei katalytischen Hydrierungen. In: Liebigs Ann. Chem. Band 511, Nr. 1, 1934, S. 209–212, doi:10.1002/jlac.19345110117.
- G.W. Kabalka, L.H.M. Guindi, R.S. Varma: Selected reductions of conjugated nitroalkenes. In: Tetrahedron. Band 46, Nr. 21, 1990, S. 7443–7457, doi:10.1016/S0040-4020(01)89059-1.
- R.F. Nystrom, W.G. Brown: Reduction of organic compounds by lithium aluminum hydride. III. Halides, quinones, miscellaneous nitrogen compounds. In: J. Am. Chem. Soc. Band 70, Nr. 11, 1948, S. 3738–3740, doi:10.1021/ja01191a057.
- C.F.H. Allen, A. Bell, J.W. Gates, Jr.: The diene synthesis with β-nitrostyrene. In: J. Org. Chem. Band 08, Nr. 4, 1943, S. 373–379, doi:10.1021/jo01192a011.
- J. Bourguignon, G. Le Nard, G. Queguiner: Synthèse d’aryl nitrobornènes par cycloaddition de Diels-Alder entre les aryl-nitroéthylènes et le cyclopentadiène. Justification de la stéréochimie et de la réactivité relative observées par la methode CNDO/II. Obtention d’aryl aminonorbornènes. In: Can. J. Chem. Band 63, Nr. 9, 1985, S. 2354–2361, doi:10.1139/v85-390.
- H. Li, Y. Wang, L. Tang, L. Deng: Highly enantioselective conjugate addition of malonate and β-ketoester to nitroalkenes: Asymmetric C-C bond formation with new bifunctional organic catalysts based on cinchona alkaloids. In: J. Am. Chem. Soc. Band 126, Nr. 32, 2004, S. 9906–9907, doi:10.1021/ja047281l.
- D. Sarkar, R. Bhattarai, A.D. Headley, B. Ni: A novel recyclable organocatalytic system for the highly asymmetric Michael addition of aldehydes to nitroolefins in water. In: Synthesis. Band 12, 2011, S. 1993–1997, doi:10.1055/s-0030-1260465.
- Enantio- and Diastereoselective Michael Reaction of 1,3-Dicarbonyl Compounds to nitroolefins Catalyzed by a Bifunctional Thiourea. In: J. Am. Chem. Soc. Band 127, Nr. 1, 2005, S. 119–125, doi:10.1021/ja044370p.
- P. Garciá-Garciá, A. Ladépeche, R. Halder, B. List: Catalytic asymmetric Michael reactions of acetaldehyde. In: Angew. Chem. Band 120, Nr. 25, 2008, S. 4797–4799, doi:10.1002/ange.200800847.
- Organocatalytic enantioselective Michael addition of β-diketones to β-nitrostyrene: The first Michael addition of dipivaloylmethane to an activated olefin; D.P. Gavin, J.C. Stephens, Arkivoc, 2011(ix), 407–421 (PDF).
- Patent DE2155113: Verfahren zur Herstellung von Acrylverbindungen. Angemeldet am 5. November 1971, veröffentlicht am 10. Mai 1972, Anmelder: Celanese Corp., Erfinder: A.B. Baylis, M.E.D. Hillman.
- H.-H. Kuan, R.J. Reddy, K. Chen: An efficient Morita-Baylis-Hillman reaction for the synthesis of multifunctional 2-hydroxy-3-nitrobut-3-enoate derivatives. In: Tetrahedron. Band 66, Nr. 52, 2010, S. 9875–9879, doi:10.1016/j.tet.2010.10.061.
- D.H.R. Barton, S.Z. Zard: A new synthesis of nitroalkenes. In: J. Chem. Soc., Chem. Commun. 1985, S. 1098–1100, doi:10.1039/C39850001098.
- Barton-Zard Pyrrole Synthesis. In: Comprehensive Organic Name Reactions and Reagents. 2010, doi:10.1002/9780470638859.conrr057.
- I.R. Baxendale, C.D. Buckle, S.V. Ley, L. Tamborini: A base-catalysed one-pot three-component coupling reaction leading to nitrosubstituted pyrroles. In: Synthesis. Band 9, 2009, S. 1485–1493, doi:10.1055/s-0028-1087991.
- S.V. Ley, J.J. Scicinski: Schwesinger Base, Polymer-supported. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2002, doi:10.1002/047084289X.rn00026.
- N. Ono, H. Miyagawa, T. Ueta, H. Tani: Synthesis of 3,4-diarylpyrroles and conversion into dodecaarylporphyrins; a new approach to porphyrins with altered redox potential. In: J. Chem. Soc., Perkin I. 1998, S. 1595–1601, doi:10.1039/A801185K.
- V. Estévez, M. Villacampa, J.C. Menéndez: Multicomponent reactions for the synthesis of pyrroles. In: Chem. Soc. Rev. Band 39, 2010, S. 4402–4421, doi:10.1039/b917644f.
- Patent US4148795: Dithiocarbamate ester bactericides and fungicides. Angemeldet am 7. Dezember 1976, veröffentlicht am 10. April 1979, Anmelder: American Cyanamid Co., Erfinder: T.A. Lies, J.W. Clapp.
- H. Cornell, T. Nguyen, G. Nicoletti, N. Jackson, H. Hügel: Comparisons of halogenated β-nitrostyrenes as antimicrobial agents. In: Appl. Sci. Band 4, Nr. 3, 2014, S. 380–389, doi:10.3390/app4030380.
- N. Milhazes et al.: β-Nitrostyrene derivatives as potential antibacterial agents: A structure–property–activity relationship study. In: Bioorg. Med. Chem. Band 14, Nr. 12, 2006, S. 4078–4088, doi:10.1016/j.bmc.2006.02.006.
- T.Y. Kim, H.S. Kim, K.Y. Lee, J.N. Kim: N,N-Dimethylformamide dimethylacetal (DMF-DMA) catalyzed formation of 1,3,5-trisubstituted benzene derivatives from α,β-unsaturated nitro compounds. In: Bull. Korean Chem. Soc. Band 20, Nr. 11, 1999, S. 1255–1256 (easechem.com (Memento vom 26. Oktober 2017 im Internet Archive) [PDF]).
- L. Gattermann, Laboratory Methods of Organic Chemistry, S. 371–372, The Macmillan Co., New York, 1937.
- F. Sánchez-Viesca, M. Berros, R. Gómez: On the mechanism of the Baeyer-Drewsen synthesis of indigo. In: Amer. J. Chem. Band 6, Nr. 1, 2016, S. 18–22, doi:10.5923/j.chemistry.20160601.04.
- A.G.M. Barrett, G.G. Graboski: Conjugated nitroalkenes: Versatile intermediates in organic synthesis. In: Chem. Rev. Band 86, Nr. 5, 1986, S. 751–762, doi:10.1021/cr00075a002.
- G.W. Kabalka, R.S. Varma: Syntheses and selected reductions of conjugated nitroalkenes a review. In: Org. Prep. Proced. Int. Band 19, Nr. 4–5, 1987, S. 283–328, doi:10.1080/00304948709356200.
- G. Yan, A.J. Borah, L. Wang: Recent advances in the synthesis of nitroolefin compounds. In: Org. Biomol. Chem. Band 12, 2014, S. 6049–6058, doi:10.1039/c4ob00573b.
